运动对抑郁障碍治疗的协同作用
梁卉薇,杨婵娟,汪钦林,钟潇琦,曹莉萍,李 烜
(广州市惠爱医院,广州医科大学附属脑科医院,广东 广州 510370
抑郁障碍的终生患病率高达4%~10%,是疾病负担重、致残率高的疾病之一[1]。研究显示,即使采用系统的抗抑郁药物治疗,部分患者的效果依然欠佳[2]。运动作为一项经济、易操作的生活方式疗法,对抑郁症的治疗可能有一定的辅助作用[3]。近年来多项研究显示,运动锻炼对老年抑郁症患者、围绝经期和绝经期抑郁症患者及女性大学生抑郁症患者等均有一定疗效[4-7]。但上述研究仅纳入轻度抑郁症患者,且未按照规范运动方案指导和监督患者进行运动干预。由于运动干预在临床工作中常常难以推广,精神专科就诊的抑郁障碍患者受病情影响,更难以配合运动。基于此,本研究采用微信方式,由专人对抑郁症患者的运动进行监督管理,探讨常规药物治疗联合运动干预对抑郁障碍的效果。
1 对象与方法
1.1 对象
连续纳入2016年12月-2017年6月在广州市惠爱医院门诊就诊的60例患者。入组标准:①符合《国际疾病分类(第10版)》(International Classification of Diseases,tenth edition,ICD-10)抑郁障碍诊断标准;②年龄18~45岁;③患者签署知情同意书。排除标准:①既往有符合ICD-10诊断标准任一轴I的其他精神障碍或精神发育迟滞者;②有明确的脑外伤所致意识丧失史;③患有神经系统疾病以及其他影响接受临床评估和运动干预的躯体疾病。干预6周后,运动次数≥16次的患者视为运动达标,纳入运动组(n=35),未达标及不运动患者纳入对照组(n=25)。本研究经广州市惠爱医院伦理委员会审核批准,所有受试者均签署知情同意书。
1.2 运动干预方法
入组患者均接受常规抗抑郁药物治疗,在本研究期间维持入组时用药种类及剂量。根据权威指南的规范方案[8-9]由专人指导患者运动:①运动频率每周不少于3~4次;②每次持续30~40 min;③运动后心率达到最大心率的60%~80%;④运动干预持续6周;⑤根据个人耐受情况选择慢跑或快走,户外或室内跑步机进行均可。入组时,护士建立微信群,接受运动干预的患者按入组次序先后入群,患者按要求在每次运动后将运动数据通过微信发送至护士收集整理,包括运动日期、运动起止时间、运动前后心率(次/min)、运动方式(跑步、游泳、打球、健身操或舞蹈、骑自行车)等。护士每周在微信群内公布运动情况两次,每周在群内留言,鼓励患者运动并提醒患者及时上传运动数据,鼓励患者分享运动后感受,同时对其他患者起督促作用,定期私信患者,督促其进行运动。
1.3 临床评定方法
护士采用自制表格收集患者人口学资料、现病史、既往史和用药情况。由一名高年资精神科主治医师在基线期和干预6周后对患者进行汉密尔顿抑郁量表-17项版(Hamilton Depression Scale-17 item,HAMD-17)、汉密尔顿焦虑量表(Hamilton Anxiety Scale,HAMA)、自尊量表(Self-Esteem Scale,SES)和一般自我效能感量表(General Self-Efficacy Scale,GSES)评定,评定地点为门诊访视室。HAMD-17多数项目采用5级评分,无、轻度、中度、重度、很重分别计0~4分;部分项目为3级评分,无、轻-中度、重度分别计0~2分。7分
1.4 统计方法
采用SPSS 22.0进行统计分析。人口学资料中的计量资料、生化指标以及量表评分中满足正态分布资料的组间比较采用t检验,不满足正态分布数据的组间比较采用两组独立样本的秩和检验。人口学资料中的计数资料组间比较采用χ2检验。由于两组基线期症状不同,需要校正,故采用协方差分析(ANCOVA),协变量为发作次数与基线期分数。优势比(OR)用于反映运动与不运动对缓解率≥25%与缓解率<25%的影响。检验水准α=0.05。
2 结 果
2.1 两组一般资料比较
运动组和对照组年龄、性别、受教育年限、共病情況、发病年龄、用药情况等方面比较差异均无统计学意义(P均>0.05)。见表1。

表1 两组基线期一般资料比较
续表1:
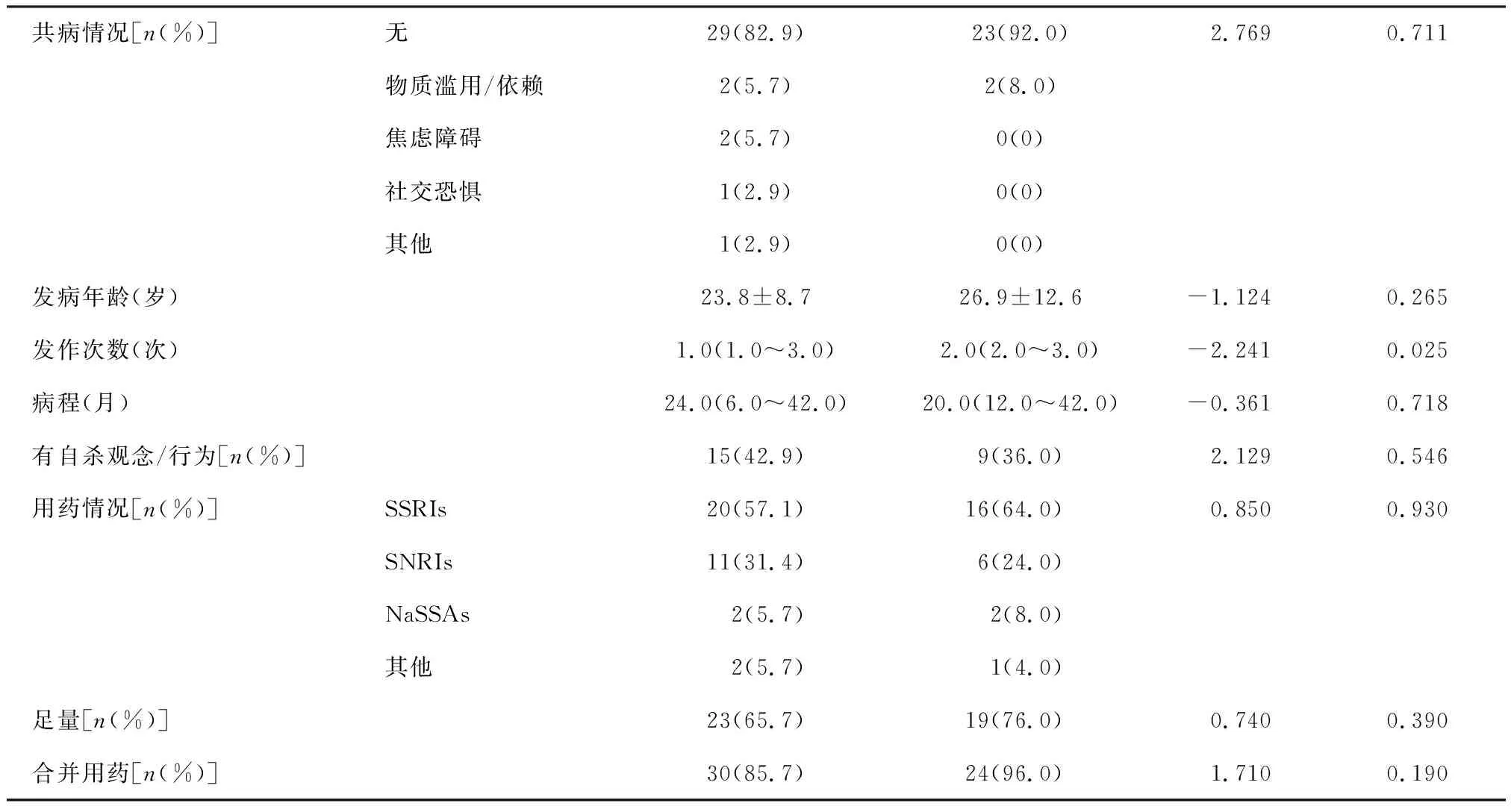
共病情况[n(%)]无29(82.9)23(92.0)2.7690.711物质滥用/依赖2(5.7)2(8.0)焦虑障碍2(5.7)0(0)社交恐惧1(2.9)0(0)其他1(2.9)0(0)发病年龄(岁)23.8±8.726.9±12.6-1.1240.265发作次数(次)1.0(1.0~3.0)2.0(2.0~3.0)-2.2410.025病程(月)24.0(6.0~42.0)20.0(12.0~42.0)-0.3610.718有自杀观念/行为[n(%)]15(42.9)9(36.0) 2.1290.546用药情况[n(%)]SSRIs20(57.1)16(64.0) 0.8500.930SNRIs11(31.4)6(24.0)NaSSAs2(5.7)2(8.0)其他2(5.7)1(4.0)足量[n(%)]23(65.7)19(76.0) 0.7400.390合并用药[n(%)]30(85.7)24(96.0) 1.7100.190
注:SSRIs,选择性5-羟色胺再摄取抑制剂;SNRIs,5-羟色胺和去甲肾上腺素再摄取抑制剂;NaSSAs,去甲肾上腺素能及特异性5-羟色胺能抗抑郁药
2.2 两组HAMA、HAMD-17评分比较
基线期两组HAMA、HAMD-17评分比较差异无统计学意义(P均>0.05)。干预6周后,运动组HAMD-17评分减分率≥25%的患者共24例(68.57%),对照组为9例(36.00%),两组差异有统计学意义(χ2=5.93,P=0.015),减分率效应量(95%CI)=3.88(1.61~17.01);运动组HAMA评分减分率≥25%的患者共25例(71.43%),对照组为10例(40.00%),两组差异有统计学意义(χ2=6.25,P=0.012),减分率效应量(95%CI)=3.75(1.27~11.1)。见表2。

表2 两组HAMA、HAMD-17评分比较分)
注:HAMA,汉密尔顿焦虑量表;HAMD-17,汉密尔顿抑郁量表17项版
2.3 两组SES、GSES评分比较
基线期两组SES、GSES评分比较差异无统计学意义(P均>0.05)。干预6周后,两组SES评分比较差异无统计学意义(F=1.76,P=0.190),GSES评分比较差异有统计学意义(F=0.52,P=0.001)。治疗前后运动组和对照组SES评分变化值比较差异无统计学意义(F=3.29,P=0.075),两组GSES评分变化值比较差异有统计学意义(F=1.21,P=0.002)。见表3。
2.4 两组代谢指标比较
随访6周末,对照组共24例患者配合代谢指标检测。两组基线期体质量及代谢指标差异均无统计学意义(P均>0.05);干预6周后,运动组和对照组腰围比较,差异有统计学意义(F=8.22,P=0.006);两组体质量指数(BMI)、腰臀比及其他糖脂代谢指标比较差异均无统计学意义(P均>0.05)。见表4。
3 讨 论
在现有研究中,药物治疗是抑郁障碍的一线治疗措施。但在使用抗抑郁药物治疗有效的患者中,约50%仍有残留症状,不能达到痊愈[11]。有研究指出,抑郁障碍的部分症状可通过运动得以改善,且这一改善与其总体预后的改善相关性较好[12],而动力和精力的变化更能反映运动治疗的效果[13]。

表3 两组SES、GSES评分比较分)
注:SES,自尊量表;GSES,一般自我效能感量表
表4 两组代谢指标比较
注:CHOL,总胆固醇;TG,甘油三酯;HDL,高密度脂蛋白;LDL,低密度脂蛋白;Alc,糖化血红蛋白;BMI,体质量指数
本研究按照运动是否达标将患者分为运动组和对照组,随访6周后,两组抑郁、焦虑症状均有改善,且运动组HAMD-17和HAMA评分减分率≥25%的人数比例均高于对照组,提示与单用药物治疗相比,运动协同药物治疗对抑郁症的效果可能更好。既往研究表明,抑郁症患者焦虑症状的发生率高,抑郁症状严重、高神经质水平、经历更多负性生活事件、倾向于采用消极应对方式的抑郁症患者更可能伴有焦虑症状[14]。本研究结果与上述观点吻合。而运动组HAMA评分减分率高于对照组,提示运动干预也有助于缓解焦虑症状。
为从多角度探讨运动对抑郁症状的改善效果,本研究使用SES、GSES进行评定以充分了解患者主观感受。Lepore等[14]研究显示,运动锻炼可能通过转移患者对负性思维的注意、提高应对问题能力和自我效能感、扩大社会交往等方式缓解抑郁。其后的相关研究结果均支持上述观点[15-16]。本研究中,干预6周后运动组GSES评分较对照组高,差异有统计学意义(F=0.52,P=0.001),提示自我效能感的改善亦可能有助于提高患者的治疗依从性,从而改善病情及社会功能。
本研究中运动组在接受6周运动干预后,与对照组比较腰围更小(F=8.22,P<0.01)。这一结果提示,运动对改善抑郁障碍患者体型有明显效果,尤其以腰围减少更早体现。但两组的体质量、BMI及其他代谢指标比较差异无统计学意义,可能与随访时间较短有关。
本研究的局限性包括非随机、样本量较小、随访时间较短、患者的运动可能存在不均一性等。运动干预对抑郁症状的效果以及对代谢指标的影响等,需要今后样本量更大、随访时间更长以及对运动方式有更清晰界定的多中心随机对照临床试验进一步研究。

