急性主动脉夹层发生低氧血症患者危险因素的Meta分析*
张欢欢,杨玉金,张加乐,郑春艳,朱剑,李霏
(南昌大学第二附属医院 血管外科,江西 南昌 330006)
主动脉夹层(aortic dissection, AD)又称主动脉夹层动脉瘤,是一种具有潜在威胁患者生命、异常凶险、围手术期并发症多且严重的疾病[1]。有研究报道主动脉夹层的误诊率高达38%[2],从国际的注册中心急性主动脉夹层调查小组最新报告急性Stanford A型主动脉夹层术后死亡率高达约23.9%[3]。低氧血症是急性主动脉夹层术后,尤其是Stanford A型主动脉夹层术后常见的并发症,低氧血症使患者的机械通气时间和ICU滞留时间延长,增加主动脉夹层围术期的病死率[4]。有研究报道[5]低氧血症是一种严重的并发症,连续的低氧血症会导致肺和其他器官严重的功能失调。也有研究报道主动脉夹层术后发生低氧血症的死亡率高达51.06%[6],AD患者经常会出现多脏器衰竭以及严重的氧合障碍[7]。因此,主动脉夹层合并低氧血症的早期诊断、早期发现对患者的预后有很大影响,怎样早期明确主动脉夹层的危险因素,降低急性期病死率成为临床治疗的难题[8]。本研究旨在通过国内外公开发表的有关主动脉夹层合并低氧血症患者危险因素的研究进行Meta分析,为临床早期预测,降低主动脉夹层低氧血症的病死率提供循证依据。
1 资料与方法
1.1 检索策略
计算机检索中英文数据库:MEBASE、Web of knowledge、The Cochrane Library、PubMed、中国知网数据库、万方数据库、中国期刊全文数据库、维普中文科技期刊数据库、中国生物医学文献数据库,检索时限均从建库至2016年,英文检索词“acute aortic dissection, hypoxemia, risk factors”。中文检索词为“主动脉夹层、低氧血症、危险因素”。应用滚雪球的方法对纳入的文献进行筛选,注意灰色文献。
1.2 研究纳入与排除标准
纳入标准:①均进行CT/磁共振、超声、血气分析等结合进行诊断,诊断为主动脉夹层的患者;②分型不限,住院时间从发病到术后出院;③研究类型为随机对照研究、队列研究、病例对照研究;④中英文公开发表,发表时间为1980年至今。排除标准:①研究例数>30例;②研究类型为横断面研究、质性研究、病例报道;③只有摘要发表,无法获取全文;④主动脉夹层合并慢性阻塞性肺疾病的患者。
1.3 文献资料筛选
由2位研究者按照纳入与排除标准独立筛选文献、提取数据并交叉核对。若遇到分歧与第三方讨论解决。提取资料包括:作者、年份、主动脉夹层低氧血症、纳入排除标准、样本量、危险因素、低氧血症的发生率,必要时联系原作者进一步获取相关研究信息。
1.4 文献质量评价
纳入研究的方法学质量评价参考Cochrane系统评价手册5.0版。文献质量评价包括以下4个方面:①研究疾病定义、诊断、危险因素是否正确;②是否采用RCT,是否采用分配隐藏,隐藏方案是否充分;③暴露因素是否采用盲法,研究方法是否相同;④偏倚是否控制得当,是否具有可比性、结局的情况。每篇由2位评价者进行评价。队列研究和病例对照研究采用NOS量表进行评价。
1.5 统计学方法
采用RevMan 5.0统计软件对文献进行Meta分析,对研究资料进行异质性检验,若异质性检验P>0.1,I2≤50%,研究间具有同质性,选择固定效应模型计算合并量,若异质性检验P<0.1,I2>50%,则不同质则应采用随机效应模型计算合并量。二分类变量采用比值比(O^R)作为效应量指标,计量资料以均数±标准差(±s)表示。对所获得的研究结果进行敏感性分析,主动脉夹层氧血症组为实验组,主动脉夹层非低氧血症组为对照组,对其相关危险因素进行Meta分析。
2 结果
2.1 文献检索结果
通过计算机文献数据库初检出相关文献,经过Note Express软件去除重复文献10篇,共检索930篇,阅读题目和摘要27篇,阅读全文排除12篇,排除不符合纳入排除标准和文献质量较低的文献8篇,最终纳入7篇(中文3篇,英文4篇)。见图1。
2.2 纳入文献特征
纳入7篇文献中,7篇为回顾性研究,研究文献样本量为70~403例,共计1 175例,主动脉夹层低氧血症患者为376例,主动脉夹层非低氧血症患者为799例,发表时间为2006~2016年,纳入研究危险因素主动脉低氧血症的发生率为17.12%~51.06%。见附表。
2.3 Meta分析结果
2.3.1 患者的因素 研究涉及的患者的因素包括体重指数(BMI)>25 kg/m2、年龄、高血压、糖尿病、吸烟等,7项研究报道BMI与主动脉夹层低氧血症有关,其中4篇文献提取的数据进行Meta分析结果显示:P>0.1,I2=45%,其中I2<50%,采用固定效应模型。BMI>25 kg/m2是主动脉夹层低氧血症的危险因素(95%CI:2.48,5.68),P=0.000]。见图2、3。2.3.2 患者术后氧合因素 依据2010年柏林标准对急性呼吸窘迫综合征(ARDS)的诊断标准,根据患者术后48 h内动脉血氧分压/吸人氧浓度(PaO2/FiO2)判断患者的氧合情况,200 mmHg(1 mmHg=0.133 kPa)<PaO2/FiO2≤300 mmH为轻度低氧,100 mmHg<Pa02/Fi02≤200 mmHg为中度低氧,PaO2/FiO2≤100 mmHg为重度低氧。本研究纳入6项研究报道PaO2/FiO2≤300 mmHg是主动脉夹层低氧血症的独立危险因素,其中对3篇文献提取的数据进行Meta分析结果显示:P>0.1,I2=36%,其中I2<50%,采用固定效应模型。PaO2/FiO2≤300 mmHg是主动脉夹层低氧血症的危险因素(95%CI:3.24,7.73),P=0.000]。见图4、5。
2.3.3 治疗因素 研究涉及的治疗因素包括:体外循环时间、机械通气时间、留置ICU时间等。其中5项研究报道体外循环时间越长是主动脉夹层低氧血症的危险因素,其中3项研究Meta分析结果显示:P>0.1,I2=0%,其中I2<50%,采用固定效应模型。体外循环时间延长是主动脉夹层低氧血症的危险因素(95%CI:2.95,8.50),P=0.000](见图6、7);其中4项研究报道机械通气延长是主动脉夹层低氧血症的危险因素,其中合并Meta分析结果显示:P>0.1,I2=0%,其中I2<50%,采用固定效应模型。机械通气延长是主动脉夹层低氧血症的危险因素(95%CI:54.54,69.94),P=0.000](见图8、9);其中3项研究报道ICU留置时间越长是主动脉夹层低氧血症的危险因素,其中合并Meta分析结果显示:P<0.1,I2=85%,其中I2>50%,采用随机效应模型。ICU留置时间延长是主动脉夹层低氧血症的危险因素(95%CI:2.19,4.76),P=0.000](见图10、11)。
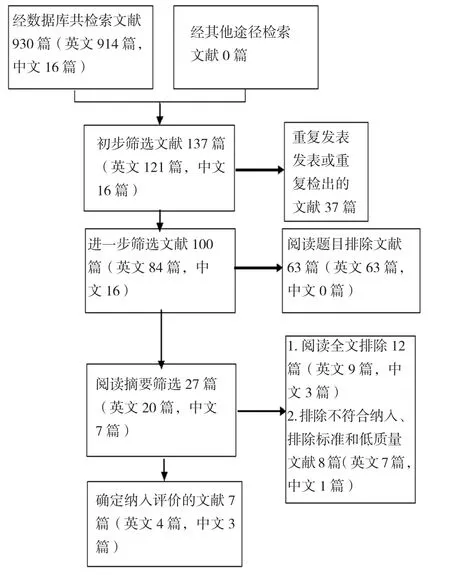
图1 筛选文献的流程图
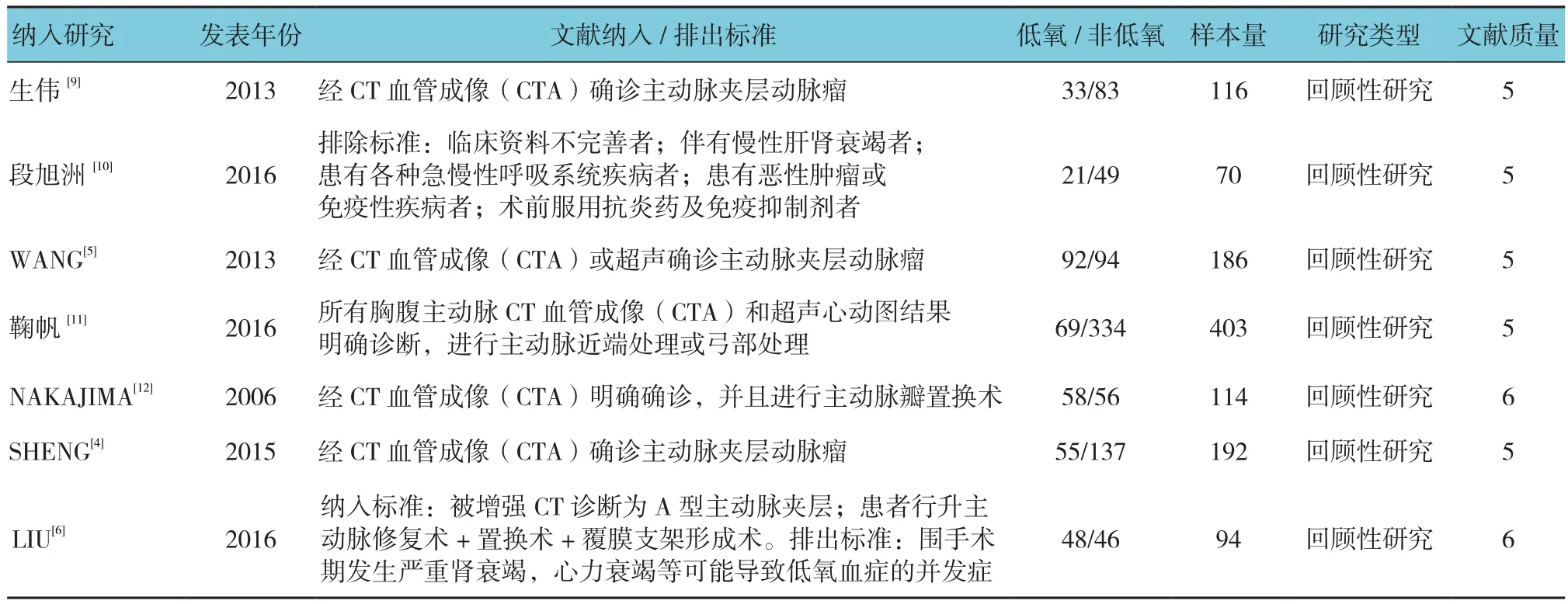
附表 纳入研究的基本特征
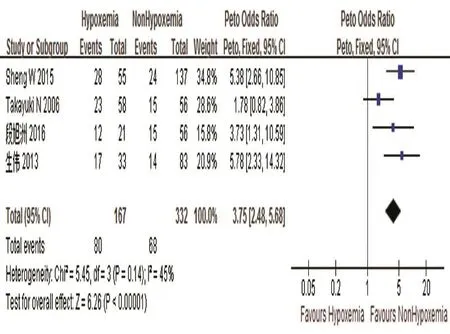
图2 BMI>25 kg/m2与主动脉夹层合并低氧血症关系的森林图

图3 BMI>25 kg/m2与主动脉夹层合并低氧血症关系的漏斗图
图4 PaO2/FiO2≤300 mmHg与主动脉夹层合并低氧血症关系的漏斗图
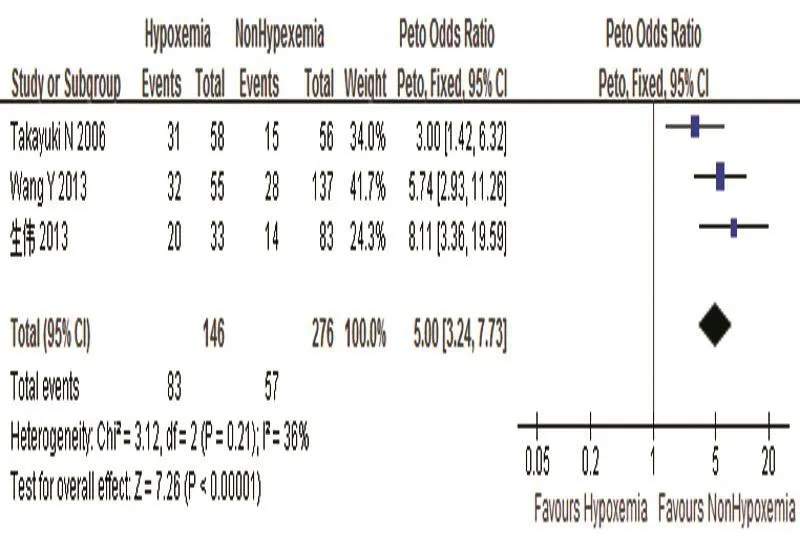
图5 PaO2/FiO2≤300 mmHg与主动脉夹层合并低氧血症关系的森林图
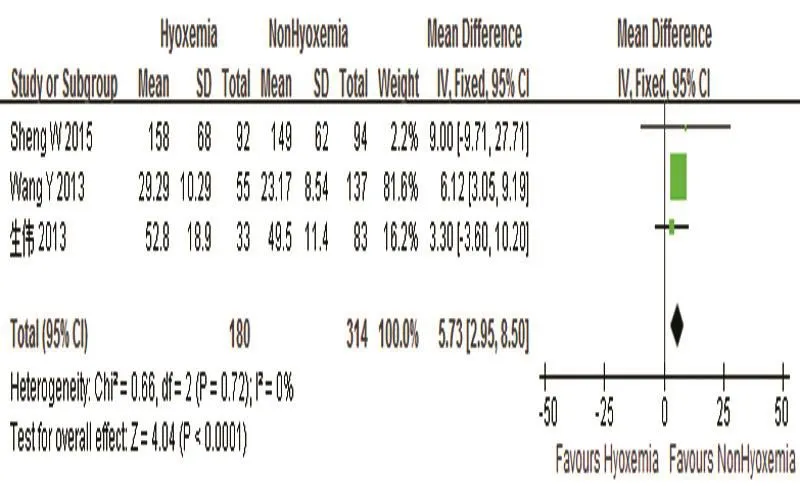
图6 体外循环时间与主动脉夹层合并低氧血症关系的森林图

图7 体外循环时间与主动脉夹层合并低氧血症关系的漏斗图
图8 机械通气时间与主动脉夹层合并低氧血症关系的漏斗图

图9 机械通气时间与主动脉夹层合并低氧血症关系的森林图

图10 留置ICU时间与主动脉夹层合并低氧血症的森林图
图11 留置ICU时间与主动脉夹层合并低氧血症的漏斗图
3 讨论
主动脉夹层是致命的心血管疾病,急性期如没有手术治疗或者其他干预,主动脉夹层的死亡率可高达50%[13]。国际研究表明血流动力学不稳定的患者院内死亡率为31.4%,血流动力学稳定的主动脉夹层患者院内死亡率为16.7%[14]。有研究报道[15]主动脉夹层患者的开胸术后发生低氧血症导致的病死率仍然较高,低氧血症处理不及时会导致严重的呼吸衰竭综合征[16]。在过程的20年由于缺乏有效的治疗,主动脉夹层合并呼吸衰竭综合征导致的病死率约25%~67%,51%的远端型急性主动脉夹层患者在24 h内发生过氧合障碍,临床转归较差[17]。本研究纳入的危险因素主动脉低氧血症的发生率为17.12%~51.06%,因此明确主动脉夹层发生低氧血症的相关危险因素,为降低主动脉夹层的病死率提供依据。
3.1 患者的因素
有研究显示肥胖是急性呼吸综合征/急性肺损伤(ARDS/ALI)的风险因素,大部分肥胖患者存在慢性过度炎症,增加循环中性粒细胞升高和氧应激,ARDS/ALI发生抗炎和促炎,氧化和抗氧化,凝血因子和肺血管内皮细胞损伤等平衡失调与肥胖有密切的关系[18-19]。本研究对4篇文献提取的数据进行Meta分析结果显示:BMI>25 kg/m2主动脉夹层发生低氧血症的患者是BMI≤25 kg/m2的3.75倍,BMI>25 kg/m2是主动脉夹层低氧血症的危险因素。这与肥胖患者最显著的改变是肺顺应性下降有关,主要起因于以下因素:胸壁的脂肪浸润、肺血容量增加、胸廓外源性压迫作用,使肺活量下降及肺不张,增加气道阻力,通气和灌注不匹配等[4,20];这与肥胖使肺血管内皮细胞损伤,使脂肪因子释放和结合发生异常,增加呼吸衰竭综合征的风险有关[19]。因此,肥胖患者易发生肺动力学的改变,呼吸阻力明显增加,呼吸功能下降,主动脉夹层动脉瘤手术后患者心肺功能相对较差,需氧量增加,难以承受以往的负荷,术后表现尤其显著,术后应进行针对行的处理。
3.2 患者术后氧合因素
有研究报道[21]主动脉夹层患者的PaO2/FiO2比值的下降可能是主动脉夹层的系统炎症反应有关。炎症反会释放促炎细胞因子,引起肺部中性粒细胞积累和激活,中性粒细胞可以释放一些毒素媒介,这可能损害肺毛细血管内皮细胞和增加毛细血管通透性,这种改变会导致肺泡炎症和呼吸衰竭[22]。据诊断PaO2/FiO2≤300 mmHg可考虑为肺损伤,PaO2/FiO2≤200 mmHg为氧损伤,在急性主动脉夹层患者中发生率约50%[23-24]。本研究对3篇文献提取的数据进行Meta分析结果显示:PaO2/FiO2≤300 mmHg的主动脉夹层低氧血症的发生率是PaO2/FiO2正常值的5倍。
3.3 治疗因素
本研究结果显示体外循环时间、机械通气时间、留置ICU时间等是主动脉夹层低氧血症的危险因素。有研究报道主动脉夹层心脏手术期间常常以体外循环支持,体外循环在手术期间可以有效维持肺功能[25]。但是体外循环会导致全身炎症反应,补体、细胞因子、内皮素、多种炎症介质和免疫损伤被激活,增加血管的渗透性,严重导致器官功能障碍[5]。也有研究报道体外循环也会导致组织灌注的改变,血液动力学改变、其他组织、器官缺氧和肺部并发症[26]。本研究结果显示体外循环时间越长,主动脉夹层越容易发生低氧血症。有研究报道[27]术后应用高剂量的中性粒细胞抑制剂,多形核中性粒细胞弹性蛋白酶可以减少肺损伤,改善DHCA体外循环后的肺功能。主动脉夹层术后血流动力学不稳定者、体外循环、器官衰竭者、主动脉夹层激起肺损伤引起全身炎症反应的患者需要延长机械通气[28-29]。有研究报道[30]机械通气超过48 h为机械通气延长,主动脉弓置换术后机械通气可以有效的提高患者短期低氧血症的氧分数,维持动脉氧饱和度,但是时间延长会导致其他严重并发症,甚至发生更高的病死率。有研究报道机械通气超过7 d,患者的院内病死率为45%,机械通气超过48 h的病死率为3.6%[1]。本研究结果显示主动脉夹层低氧血症患者机械通气时间延长是主动脉夹层非低氧血症的机械通气的62.24倍。因此,改善患者氧合能力、管理围手术期抗炎治疗、调整术后早期机械通气策略和加强呼吸道管理可以有效的降低主动脉夹层的低氧血症的发生率。有研究显示[31]主动脉夹层ICU留置时间>96 h,可考虑ICU留置时间延长。主动脉夹层低氧血症存在多种风险因素,脑卒中、体外循环延长、低氧血症、呼吸衰竭等会导致主动脉夹层ICU住院时间延长[32]。大量研究报道[33-35]主动脉夹层患者出院后生活质量较差,出院后的病死率也较高,1年左右的病死率高达34%,3年左右的病死率在60%左右。本研究对3篇文献进行Meta分析结果显示留置ICU住院时间是主动脉夹层低氧血症危险因素。主动脉夹层低氧血症患者的平均留置ICU时间比非低氧血症患者的平均留置ICU时间多3.48倍。这可能与主动脉夹层低氧血症患者应急状态、体外循环等导致其他严重并发症,导致住院时间延长有关。
3.4 其他因素
本研究纳入文献报道介入支架是主动脉夹层低氧血症的保护因素;HDCA、白细胞升高、CPR、24 h输血量>3 000 ml等是主动脉夹层低氧血症的危险因素,但是仍需要大量高质量的研究进行分析。可能与主动脉夹层使机体处于高度应激状态,全身炎症反应、血流动力学的改变等,多因素合并引起一系列功能失调有关。本研究目前国内外报道的较少,仍需要高质量的文献进行支持。
本研究纳入的文献为公开发表的文献,只纳入了中英文文献,可能存在检索不全而导致的发表偏倚;纳入研究中全部为回顾性研究,缺少前瞻性研究,部分研究文献未报告随机方法和分配隐藏方法,单个研究的样本量较小,容易产生偏倚;本研究目前国内外报道的较少,可能存在发表偏倚。目前关于主动脉夹层低氧血症危险因素研究证据不足,仍需要大量的研究和循证医学进一步探讨。今后需要更谨慎的设计,大量高质量的前瞻性研究来分析主动脉夹层的综合效应,为主动脉夹层低氧血症的预防提供科学依据。
——体外循环质量控制的基石

