精养池塘水中胞外酶动态特征及与环境因子的相关性
苟 青,陶 玲,李晓莉,宋超峰,彭 亮,代梨梨,李 谷
(1.上海海洋大学海洋科学学院,上海 201306;2.中国水产科学研究院长江水产研究所,武汉 430223)
胞外酶(extracellular enzyme)是指细胞内合成穿过细胞膜并在细胞外发挥作用,使多糖、蛋白质和脂质等高聚物裂解变为可穿过细胞质膜而被吸收利用的小分子物质的一类酶[1]。水体中的溶解有机碳大多以高聚物的形式存在,不能被细菌等异养微生物直接利用,只有通过胞外酶的水解作用,把这些高聚物分解为小分子单体或低聚物才能被微生物利用[2]。这一关键的生化过程,改变了有机物的组成和可利用性,是调节水体有机营养平衡的重要生态因子,也是众多异养微生物赖以生存的基础。因此,水中胞外酶活性不仅可以反映水环境中有机物的数量和质量,还能反映浮游生物对有机组分的改造程度及该有机物组分对浮游生物生长繁殖的营养贡献[3]。水环境中的胞外酶进行着物质的转化和元素的循环,并促使能量的流动,调控着整个水生态系统的结构与功能。另外,胞外酶活性的变化及其分布特征可反映微生物活性及水环境营养状况。Kiersztyn等[4]提出了酶TSI指标来评价水环境的营养状况,并证明该指标在水体质量监测中非常有效。
水中胞外酶活性特征指标还可以早期预警水环境胁迫[5]。养虾池塘水中低蛋白酶活性与高生产力相关,水中高水平的蛋白酶活性和几丁质酶活性指示水质恶化和环境胁迫[6]。但目前对淡水养殖池塘水中胞外酶活性特征的研究还鲜见报道。本研究运用荧光模拟底物法对养殖池塘水体中的碱性磷酸酶(AP)、β-葡萄糖苷酶(BG)、亮氨酸氨肽酶(LAP)以及脂肪酶(LIP)活性随养殖进程的动态变化进行监测,分析精养池塘水中胞外酶活性在不同粒径生物上的分布,并研究池塘水中各酶活性与水质理化因子之间的相关性,以全面了解养殖池塘中物质循环以及评估养殖水体环境质量和生态效率,为池塘水质监测和调控提供基础性资料和科学依据。
1 材料与方法
1.1 实验地点
实验在中国水产科学研究院长江水产研究所窑湾实验基地进行。实验在4口大小完全一样的养殖池塘中进行,池塘面积667 m2,水深1.5 m。池塘主养草鱼,放养规格100 g/尾,平均放养密度为1 000尾/667 m2,配养鲢规格为300 g/尾,鳙规格为150 g/尾。
1.2 采集与分析
1.2.1水质指标
1.2.2胞外酶活性
同时采集水样装入灭菌玻璃瓶用于酶活性测定,水样分别用3 μm和0.22 μm的滤膜逐级过滤,以区分不同粒径来源的胞外酶活性,将胞外酶的来源分为:>3 μm粒径浮游生物酶活性,0.22~3 μm粒径浮游生物酶活性,<0.22 μm的浮游生物酶活性。
酶活性的测定采用荧光模拟底物法(FMS)[8],向待测水样中加入相应的酶底物,在模拟现场温度,避光条件下与酶反应3 h,在反应结束后加入HgCl2阻止反应,并迅速冷冻保存,空白样在取水样后直接加入HgCl2阻止反应,冷冻保存。测试前逐步解冻恢复至室温,用荧光分光光度计测定样品荧光强度。β-葡萄糖苷酶、碱性磷酸酶和脂肪酶使用4-甲基伞形酮(MUF)为底物,反应生成4-甲基伞形酮-β-D-葡萄糖苷、4-甲基伞形酮酰磷酸酯和4-甲基伞形酮油酸酯,MUF的激发和发射波长分别是365 nm和455 nm。亮氨酸氨肽酶使用7-氨基-4甲基香豆素(AMC)为底物,反应生成L-亮氨酰-7-氨基-4-甲基香豆素盐酸盐,AMC的激发波长和发射波长分别是380 nm和440 nm。以酶水解底物释放出显色荧光团(MUF或AMC)的速率来表示胞外酶活性。
1.2.3细菌总数
细菌总数采用平板涂布计数法,将处理好的水样进行稀释,分别取合适稀释度的0.1 mL稀释液涂布于营养琼脂平板,37 ℃倒置培养24 h,计数。
1.3 数据统计与分析
胞外酶活性与环境因子的相关分析在SPSS 20.0中进行,用Pearson 检验方法(检验水平为P<0.05和P<0.01)检验数据间的相关水平,主成分分析用Canoco for windows 4.5完成,用Origin 2015软件绘图。
2 结果与分析
2.1 池塘水质理化因子动态变化特征
池塘水体的理化指标如图1所示。整个实验期间,池塘水温平均值为25.7 ℃,水温的变化与气温保持一致,8月份最高为31.9 ℃,10月份最低为18.5 ℃。pH的变化范围是6.8~8.1,且各月份的差异不大。DO随着时间的变化先下降,在8月份的时候降到最低,后期略微上升。池塘水体透明度前期5-8月较高,后期9-10月份较低。

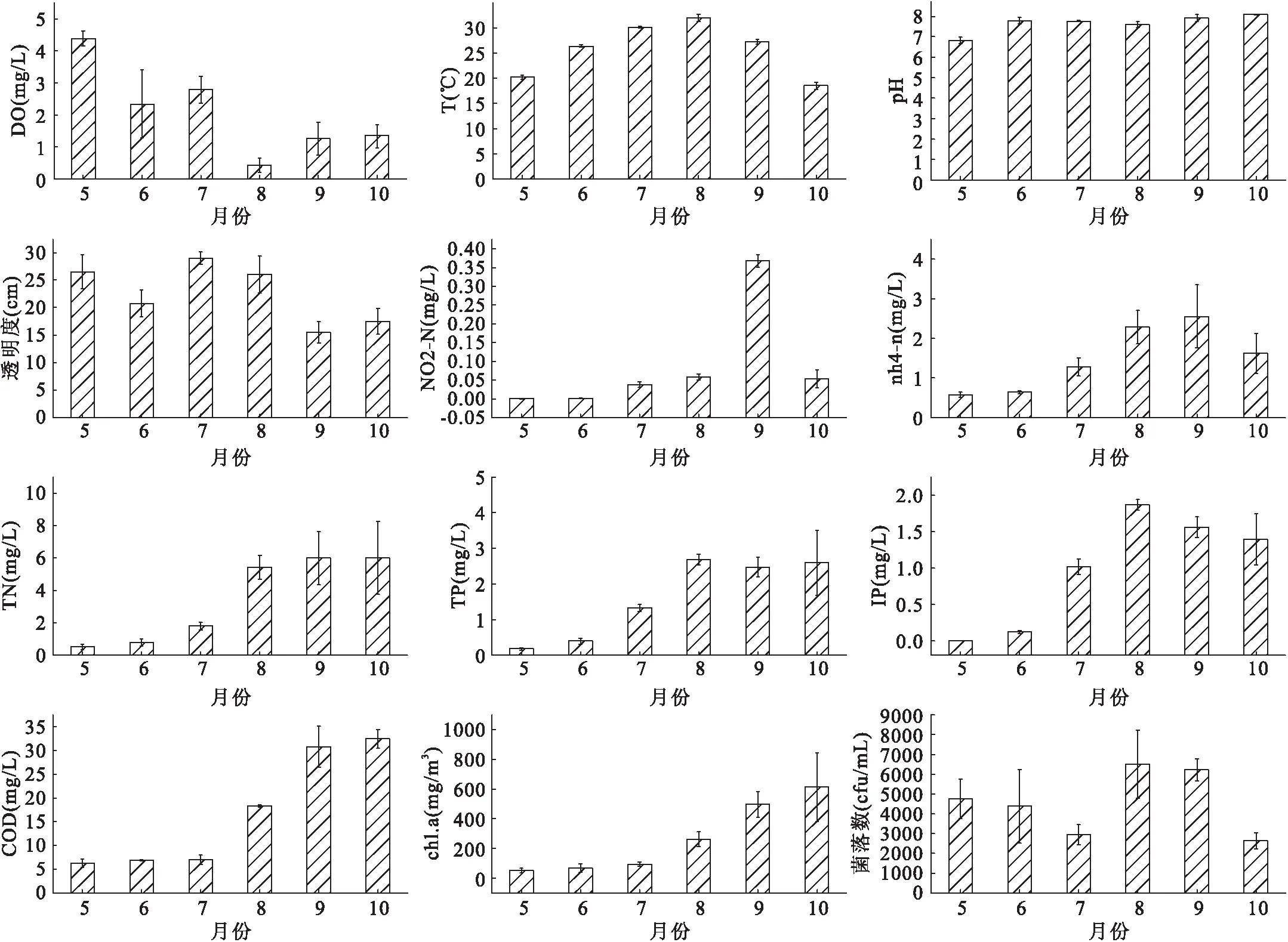
图1 池塘水质理化因子的季节变化Fig.1 Seasonal variation of physicochemical parameters in ponds
2.2 池塘水中胞外酶活性动态变化特征
由图2可以看出,池塘水中胞外酶活性均较高,总β-葡萄糖苷酶活性变化范围为0.18~1.63 μmol/(L·h),总碱性磷酸酶活性变化范围为0.96~3.49 μmol /(L·h),总脂肪酶活性变化范围为1.48~2.68 μmol/(L·h),总亮氨酸氨肽酶活性变化范围为0.28~1.66μmol/(L·h)。总β-葡萄糖苷酶活性随着养殖时间的延长而升高,在8月份达到最高值(1.63 μmol/(L·h))后9月份下降,在10月份又升高至1.63 μmol/(L·h)。总碱性磷酸酶的活性在实验开始时处于较高水平,随后下降再上升,在8月份达到另一个小高峰(3.5 μmol/(L·h)),之后则开始下降。总脂肪酶活性变化趋势与碱性磷酸酶一致,先下降再升高再下降,不同的是,最低点(1.61 μmol/(L·h))出现在7月份,再次升高的最高点(2.15 μmol/(L·h))在9月份,但是比5月份(2.68 μmol/(L·h))的酶活性低。总亮氨酸氨肽酶活性在5-9月呈逐渐增加的趋势(从0.29 μmol/(L·h)到1.69 μmol/(L·h)),10月份有所下降(0.93 μmol/(L·h))。

图2 池塘水中胞外酶的动态变化Fig.2 Dynamics of extracellular enzymes in the pond water
为研究池塘水中胞外酶活性动态变化特点,对胞外酶数据进行标准化变换后,应用Canoco for Windows 4.5实施主成分分析。提取了4个主成分,主成分1(PC1)为65.3%,主成分2(PC2)为20.6%,前两轴的累积贡献率为85.9%。从排序图可以看出,池塘水体胞外酶的月份变化比较明显,各月份的胞外酶活性在排序图上很好地分离开来。5月份各样点分布于第一象限,6月份和7月份位于第四象限,8月份位于第二象限,9月份和10月份位于第三象限。
2.3 不同粒径胞外酶活性分布
本研究中β-葡萄糖苷酶在养殖水体中的分配比例最高的是>3 μm粒径浮游生物,其所占比例为70%~78%,其次为<0.22 μm的游离态,且随着温度的升高,游离态所占的比例增加,最高可达到51%。碱性磷酸酶活性主要来源为<0.22 μm的游离态,平均比例占到57.13%,其中,7月高温季节,游离态碱性磷酸酶活性占绝对优势,达到79%。脂肪酶活性主要来源于<0.22 μm的游离态和>3 μm粒径浮游生物,但不同月份在不同粒径上的分布有所差别,6-10月,>3 μm粒径浮游生物来源的脂肪酶活性呈逐渐升高趋势。>3 μm粒径浮游生物来源的亮氨酸氨肽酶活性始终处于优势地位,占75.04%~95.37%,其次是0.22~3 μm粒径来源的亮氨酸氨肽酶占3.96%~12.3%,游离态的亮氨酸氨肽酶比例最低,而且随着养殖时间的增加,游离态亮氨酸氨肽酶活性越低。
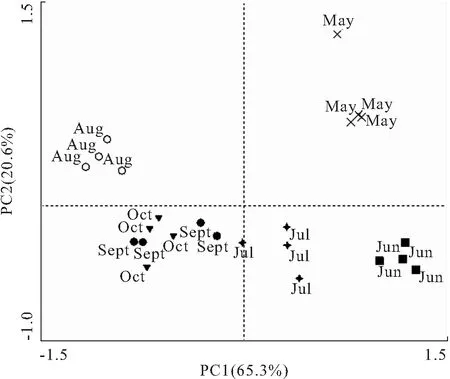
图3 池塘水中胞外酶活性的主成分分析Fig.3 Principal component analysis of extracellular enzyme activities in the pond water
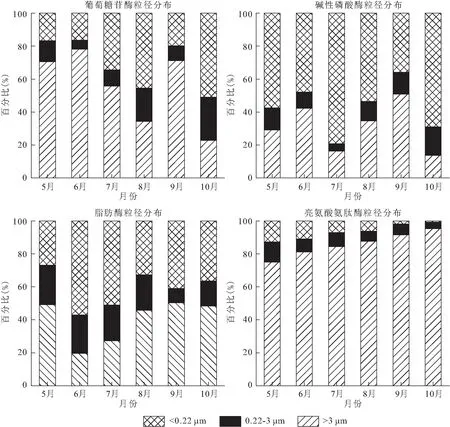
图4 池塘中不同来源胞外酶活性的百分比图Fig.4 Percentage of extracellular enzyme activities at various carriers in ponds
2.4 水中胞外酶活性与环境因子的关系
3 讨论

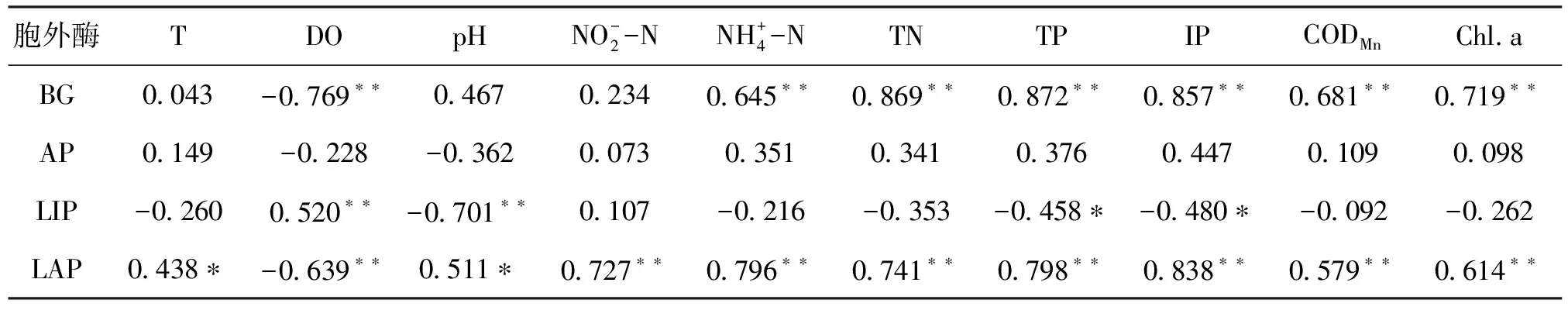
表1 池塘水中胞外酶活性与水质理化因子的相关性分析Tab.1 Relationship of extracellular enzyme activities and water physical-chemical parameters
注:*表示在0.05水平上显著相关;**表示在0.01水平上显著相关
淡水养殖池塘中,碱性磷酸酶水解是磷转化再生的重要机制[17]。碱性磷酸酶能够酶促磷酸酯水解而释放出磷酸根,将有机磷水解为无机磷,多具有外部功能,其主要作用是向细胞提供磷营养,它的合成有赖于环境中磷的营养状态,与水体的磷循环和碳循环密切相关[18]。本研究中<0.22 μm的游离态为碱性磷酸酶主要的来源(57.13%),在厦门西海域[19]的研究也有相似的结果。海水中81.2% 碱性磷酸酶活性来自于<0.22 μm粒径的游离态[15]。在法国海湾的研究[20]中发现,碱性磷酸酶的主要来源为0.22~3 μm粒径(60%),与本研究有所差异,可能原因是养鱼对水体的溶解态碱性磷酸酶有重要贡献[21],养殖饲料的输入及鱼的粪便增加了底质的酶活性,鱼的活动扰动底质,从而增加了池塘的自由态的碱性磷酸酶活性。另外一个可能的原因是细胞裂解产生的游离态碱性磷酸酶在水体中持久时间更长[22]。
脂肪酶是一种较小的蛋白质,是参与脂质降解最典型的酶,能够将脂肪水解为甘油和脂肪酸,在脂质转化过程中起到主要作用。在水生生态系统中,脂肪占所有有机物的 3%~55%。活的或死亡的浮游植物、浮游动物和大型植物是水体脂肪的主要来源[23]。养殖池塘水中残饵含有较高的脂肪,这可能是本研究中池塘水中具有较高脂肪酶活性的原因,其最高可达到2.68 μmol/(L·h)。Gajewski[24]在多瑙河的研究中发现<0.2 μm粒径来源的游离态脂肪酶活性占总脂肪酶活性的20.1%~56.3%,0.2~1 μm粒径浮游生物来源的脂肪酶活性占21.2%~36%,>1 μm粒径浮游生物来源的脂肪酶活性占18.2%~58.8%。本研究中脂肪酶的形态主要为游离态和>3 μm粒径浮游生物来源(分别为40.78%和40.04%),这可能跟不同水体脂肪来源不同有关,养殖池塘水中细胞裂解形成的游离态酶及浮游植物和大颗粒附着态细菌来源的脂肪酶占主导,这可能与本研究池塘中浮游植物具有较高的生物量相关(Chl.a含量为264.6 mg/m3)。同时,浮游植物死亡之后,脂肪的浓度较高[24],实验中发现5-9月池塘中浮游植物裂解在水面形成脂质油膜,可能增加水中游离态脂肪酶的活性。
亮氨酸氨肽酶能从N端依次水解L型氨基酸组成的肽和酰肽,将多肽分解为亮氨酸和其他疏水性的氨基酸,从而为异养细菌的生长提供所需的氮源物质,在水环境中氮元素的生物地球化学循环过程中起着非常重要的作用[25]。水体中的肽酶很大程度上依赖于水体中多肽的浓度,当水体中的蛋白质明显增加时,亮氨酸氨肽酶会迅速的合成[26]。Patel 等[27]报道亮氨酸氨肽酶活性随着富营养化程度提高而提高,这解释了本研究中随着养殖进程池塘水中氮磷等营养水平提高,亮氨酸氨肽酶活性也呈提高的趋势。Konopka等[2]的研究发现87%的氨肽酶是附着态的。法国Aydat湖的研究[28]也表明,大于1 μm的亮氨酸氨肽酶活性占总的亮氨酸氨肽酶酶活性的75.4%,0.2~1 μm的占12.1%,小于0.2 μm的游离态占12.4%,与本研究的结果一致,大于3 μm粒径浮游生物来源的亮氨酸氨肽酶活性比例最高,占75.04%~95.37%。浮游植物同化形成的蛋白质能调控亮氨酸氨肽酶活性,本研究中亮氨酸氨肽酶活性与叶绿素浓度呈正相关,表明养殖池塘中浮游植物也能对亮氨酸氨肽酶活性进行调控。另外,亮氨酸氨肽酶活性与DO负相关,与其他水质因子正相关,说明含氮有机物的分解需要消耗大量氧气,亮氨酸氨肽酶活性越高,分解作用越强,导致的池塘DO水平降低,这可能是亮氨酸氨肽酶活性越高,养殖生产力越低[6]的原因。养殖过程中亮氨酸氨肽酶活性在10月份以前呈逐渐上升趋势,提示了养殖水质有恶化倾向。因此,养殖过程中更应该关注亮氨酸氨肽酶活性。通过亮氨酸氨肽酶活性监测淡水养殖池塘水质进行早期预警,具可行性。
酶的种类和活性水平的变化反映了环境的营养状态,浮游细菌可以通过优势种类的变化和相同种类浮游细菌相关酶基因表达量的变化来应对环境中有机物浓度和成分变化[29]。胞外酶活性在较短时间内具有动态变化幅度大的特点,可反映浮游细菌种类和环境因子的动态变化。因此,本研究通过弄清养殖过程中胞外酶活性动态特征,在养殖生产中可针对池塘水中胞外酶活性动态(特别是亮氨酸氨肽酶活性)调整管理措施,及时调节水体有机营养平衡。另外,水解酶的活性受到底物种类和浓度的影响,本研究中未测定池塘水中颗粒态和溶解态有机物的浓度,下一步研究中应当同时监测池塘水中有机物种类和浓度,结合胞外酶活性动态,以全面了解池塘生态系统的物质循环。

