无乳链球菌不同途径感染吉富罗非鱼后病原菌在体内的分布规律研究
朱佳杰,沈夏霜,罗 伟,敖秋桅,谭 芸,罗永巨,蒋和生,甘 西
(1.广西大学,南宁 530004;2.广西壮族自治区水产科学研究院,广西水产遗传育种与健康养殖重点实验室,南宁 530021)

1 材料与方法
1.1 试验鱼来源
试验鱼取自广西水产科学研究院那马淡水中试基地。选取同一个家系吉富罗非鱼500尾,体重(56.48±1.70) g,试验前对吉富罗非鱼抽样进行多重PCR检测及平板划线接种。将实验鱼暂养在5个塑料大桶中(容积5 000 L),暂养14~15 d。暂养期间每天投喂专用罗非鱼膨化颗粒饲料(深农饲料公司2.0号浮料)2次(9∶00和17∶00),按鱼体重的3.5%进行投喂,每隔2 d更换二分之一水体,保持24 h增氧,水温控制在31~32 ℃。暂养结束后,挑选400尾有活力的吉富罗非鱼进行人工感染试验。
1.2 无乳链球菌菌株复苏与培养
试验所用的无乳链球菌菌株(HN016)由广西水产科学研究院鱼病防治研究室馈赠,已证实该菌株为我国罗非鱼主要养殖地区的优势菌株[16]。从-80 ℃冰箱中取出HN016菌株,解冻后先对该菌株进行毒力复壮。然后从发病鱼的脑组织中分离病原菌接种到鸡血平板上,32 ℃恒温培养18-24 h,待鸡血平板上长出菌落后,用接种环挑取单个菌落进行革兰氏染色,检测其是否携带杂菌。鉴定后在无菌环境下随机挑取单个菌落置于200 mL胰蛋白胨大豆肉汤培养基中,在振荡摇床上33 ℃恒温培养12 h后,经平板计数测定菌液的浓度后用无菌生理盐水将菌液浓度稀释至注射半数致死浓度为1×107CFU/mL(前期多次测试过该菌株的半数致死浓度),然后置于4 ℃冰箱保存待用。
1.3 实验设计
实验共设4个组,其中3个实验组分别为注射组、灌胃组和浸泡组,另1组为对照组,无乳链球菌感染后各组鱼均养殖在水温31~32 ℃的大桶中。每个实验组设2个平行组,每组各40尾鱼,一组用于统计感染无乳链球菌后罗非鱼的死亡规律,另一组用于体内病原菌的分离。注射感染采用每尾鱼腹腔注射0.2 mL浓度为1×107CFU/mL的无乳链球菌(HN016)方式;灌胃感染采用每尾鱼灌胃0.2 mL浓度为1×107CFU/mL的无乳链球菌(HN016)方式;浸泡感染采用先将吉富罗非鱼背部刮去部分鱼鳞使其皮肤轻微刮伤,再将鱼置于浓度为1×107CFU/mL的养殖水体中。实验观察为期10 d,每天早晚各投喂一次,感染后每隔2 h记录实验鱼情况,若发现有发病鱼及时捞出,死鱼数量较多时要及时换水以保证水质健康。
1.4 感染后组织病原菌的分离
三种方式感染后的2、5、8、12、24 h分别随机取3尾鱼进行解剖,采集试验鱼的脑、脾、肝、前肾、胃、肠、鳃、皮肤、肌肉等组织,用鸡血平板进行病原菌的分离、培养,最后对菌落数目进行统计记录。
1.5 病原菌的形态观察与分子鉴定
形态观察:用接种环挑取鸡血平板上培养生长的单个典型菌落,在载玻片上进行革兰氏染色,染色后在100倍油镜下观察细菌的形态。
分子鉴定: 吉富罗非鱼感染无乳链球菌后的PCR鉴定参考[17]。
2 结果
2.1 吉富罗非鱼感染无乳链球菌HN016菌株后的症状及死亡率
三种方式感染HN016菌株后,注射组、灌胃组均表现出明显的发病症状,主要表现:鱼体逐渐失去平衡,在水体中出现翻滚和旋转现象,胸鳍及鳃盖下缘出现弥漫性或点状出血,眼球肿大充血、甚至混浊、眼球脱落等症状,剖检侧翻的病鱼发现其胆囊、肝脏、脾脏明显肿大,部分鱼的肠道出现积水或黄色的黏液,肛门明显发红突出。
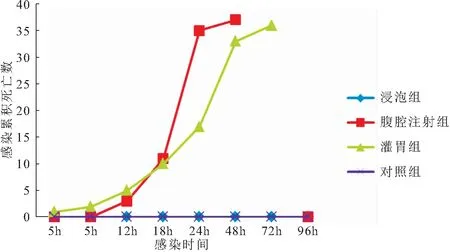
图1 吉富罗非鱼感染HN016菌株后累积死亡数量与感染时间的关系Fig.1 The relationship between cumulative mortality and post-infection time of O.niloticus infected by HN016 strain
由图1可见,注射组和灌胃组在感染5 h后均出现发病死鱼,其中注射组在感染后18~24 h出现死亡高峰期,之后逐渐趋向稳定,试验96 h内共死亡37尾,死亡率为92.5%;灌胃组感染72 h后共死亡36尾,死亡率为90%;而浸泡组和对照组在整个感染期间均未出现发病症状。
2.2 病原菌的鉴定
将表现出疾病症状的病鱼脑组织,接种于鸡血平板上,33 ℃恒温培养10 h,便可在显微镜下观察到呈球状或卵圆形的菌落,其直径约为0.6~1.0 mm(见图2)。经革兰氏染色镜检可观察到菌体为链状或成对排列的革兰氏阳性球菌(见图3),PCR鉴定结果也为无乳链球菌。
2.3 吉富罗非鱼体内病原菌分离
试验组吉富罗非鱼感染无乳链球菌后,注射组和灌胃组的鱼除脑组织外其它组织在感染2 h后均可分离出无乳链球菌,注射组2 h菌落数目>30 CFU的组织为脾、肝、肾;而灌胃组2 h菌落数目>30 CFU的组织为胃、肠、鳃;5 h后这两组的脑组织均能分离出无乳链球菌,且菌落数量随感染时间的延长而增多。浸泡组在感染5 h后除脑组织外,在其它组织中均能分离出少量的无乳链球菌,12 h后体内的无乳链球菌数量明显下降,对照组则均未分离出无乳链球菌。见表1。
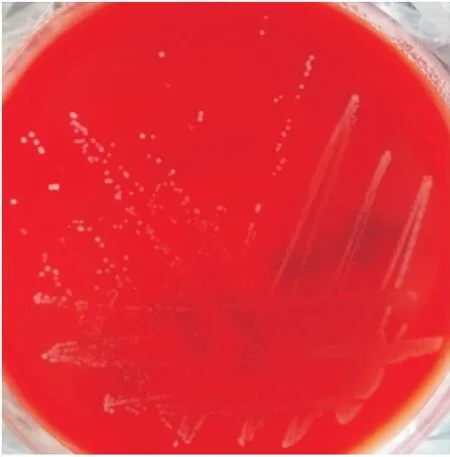
图2 鸡血平板上分离出的病原菌Fig.2 The separation of pathogens on blood agar plate

图3 分离菌株的革兰氏染色(A)及电镜负染(B)照片Fig.3 The figures of gram stain (A) and electron microscope negative stain (B) of separation pathogens
3 讨论
水产动物直接与外界环境接触的黏膜组织如鳃、皮肤、肠道是病原细菌感染动物体内的主要途径,而作为第一道免疫屏障的黏膜组织在不断地进化后形成硬骨鱼类黏膜相关淋巴组织,才有完善的免疫体系用于抵抗病原细菌的侵染[18,19]。Minami[20]和 Kim等[21]研究发现黄尾鲱(Seriolalalandi)和牙鲆(Paralichthysolivaceus)是摄食了携带链球菌的杂鱼而引起链球菌病爆发。Nguyen等[22]发现无乳链球菌是通过粪-口途径在水体中接触感染周围的罗非鱼,而Mian等[23]发现腹腔注射、浸泡和鳃接种均能使罗非鱼鱼感染链球菌,且后续研究也表明人工肌肉注射、强行喂食伴有细菌饲料以及鼻接种等都能使鱼类感染链球菌。Patterson等[24]
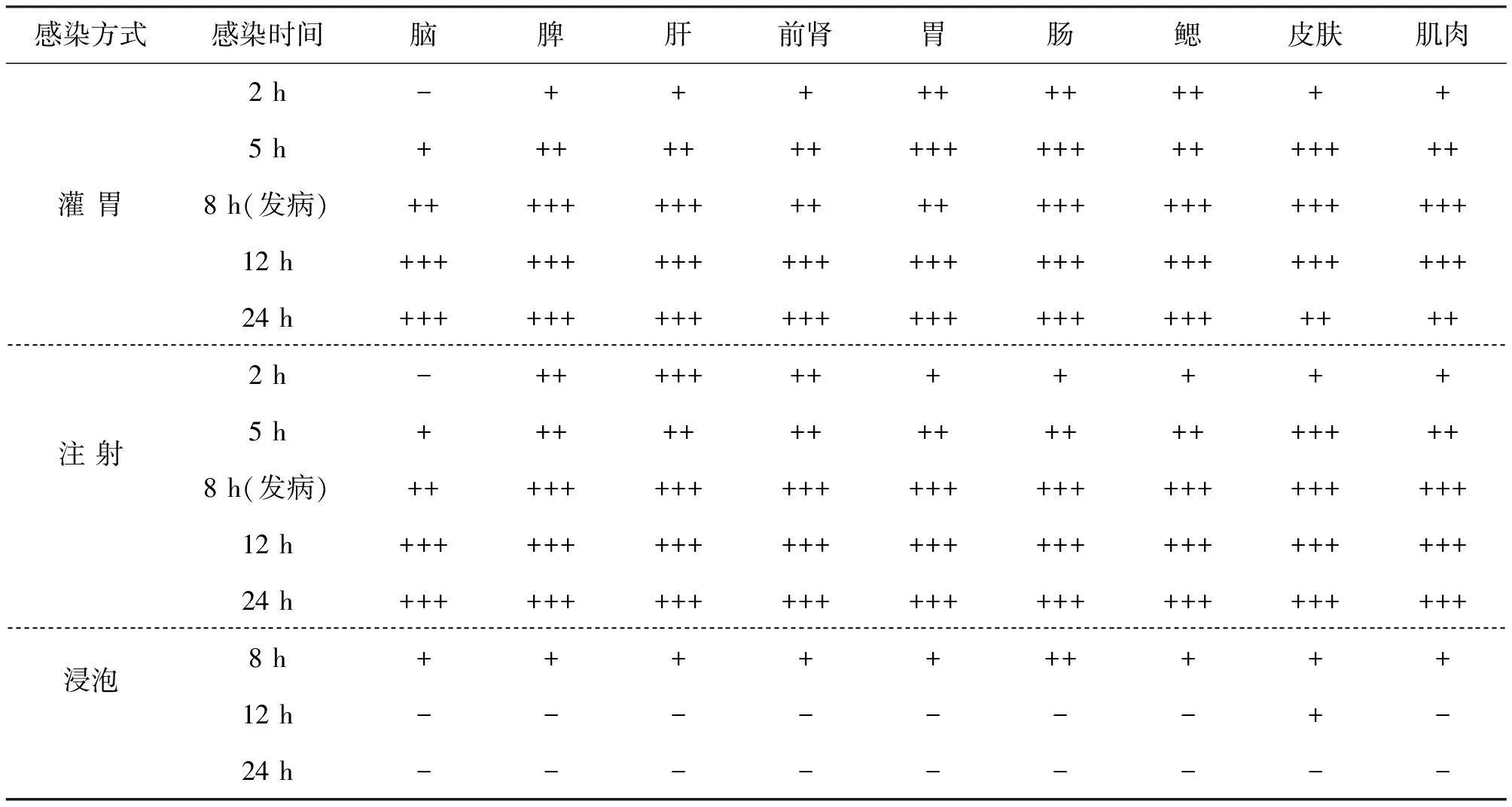
表1 试验组吉富罗非鱼各组织细菌分离结果Tab.1 The isolated pathogenic bacteria in vivo after infection
注:“﹢”“﹢﹢”和“﹢﹢﹢”分别表示血平板上的菌落数目< 30CFU、> 30小于300CFU和>300CFU。
研究结果表明,人工进行腹腔注射感染无乳链球菌可以绕过其皮肤等黏膜组织的防御机制而直接感染鱼体,从而导致更严重的病理变化。本研究采用注射、浸泡和灌胃三种方式进行感染,以期找出这三种方式感染后首先侵染的靶器官及病原菌在体内的增殖变化。结果发现注射和灌胃两种方式均可以使吉富罗非鱼快速感染无乳链球菌而呈现发病症状,并在感染5 h后相继出现死王。而浸泡组在高浓度浸泡感染后虽然在体内分离出了无乳链球菌,但并没有观察到明显的发病症状,且浸泡的水温为31~32 ℃,已接近了自然条件下发病的水温。由此可推测,浸泡感染方式不会引起罗非鱼大面积爆发无乳链球菌病。本研究结果与Mian等[23]和 Soto等[25]报道的浸泡方式可以引起感染发病不一致,分析其原因可能是菌株的分型、毒力、浓度、感染的水温及溶氧量等环境条件差异所造成的。
对感染无乳链球菌后的吉富罗非鱼解剖发现多个组织器官出现变性、坏死及出血症状,尤其是肝脏、脾脏、肾脏和脑等重要器官功能障碍和衰竭,最后导致鱼体死亡。其中注射感染组的鱼首先在肝脏中分离出大量的病原菌,其主要原因是肝脏是鱼类的供血器官和排毒器官,病原菌经注射后进入体内血液循环系统,快速到达肝脏组织,引起肝脏的功能发生障碍,导致机体免疫机能下降,从而使病原菌突破机体的免疫防御系统,在体内快速繁殖并破坏细胞的结构,从而引起组织的病变。而灌胃方式首先在胃部、肠部和腮部分离得到较多的病原菌,其原因是由于病原菌直接通过口腔灌注入胃部和肠部,并在这两个组织中渗透进入体内血液循环系统,而在鳃部也分离出较多的病菌,可能与腮部存在丰富的毛细血管有关。浸泡感染5 h后在脾脏、肝脏、前肾、胃部、肠部、鳃部、皮肤及肌肉均可以分离出病原菌,但其数量比相同时期的注射组和灌胃组少,其主要原因是通过浸泡方式突破机体免疫系统的病原菌数量少,同时机体凭借自身的免疫防御系统又吞噬清除了部分病原菌,从而制约了病原菌在体内的繁殖,所以并没有表现出发病的症状。
4 结论
本研究结果表明注射、灌胃以及浸泡三种均可以让吉富罗非鱼感染无乳链球菌,其中注射和灌胃两种感染方式均表现出了典型的无乳链球菌发病症状,而浸泡组在高浓度的无乳链球菌水体环境中虽然感染了无乳链球菌,但并没有表现出发病症状,也没有出现死鱼。由此我们推测,在自然条件下养殖的罗非鱼是通过口腔摄食携带有无乳链球菌的食物而被感染。

