FOXM1、hTERC与C-myc在HPV阳性宫颈癌筛查意义
陈光治 王晓娟 何 燕 王月明 罗卉丽
湖北省十堰市妇幼保健院(442000)
中国每年新发宫颈癌13万例且呈现年轻化上升趋势[1]。目前已知人类乳头瘤病毒(HPV)感染,特别是高危型别HPV是宫颈上皮内瘤变(CIN)及宫颈癌的重要诱因[2]。HPV持续阳性者2年内发生CIN I-II级的风险为28%,其中3%会在今后10年内继续发展为宫颈癌[3]。目前较为明确的高危型别HPV是HPV 16和HPV 18[4]。近年来研究发现HPV感染可以造成人类染色体端粒酶基因(hTERC)重新激活,其过表达则可导致宫颈癌发生[5]。Forkhead家族转录因子(FOXM1)和C-myc癌基因(C-myc)作为调控细胞周期的原癌基因,也在肿瘤的病理改变过程起到促进作用,均共同调控肿瘤的生长侵袭与转移[6]。目前将FFOXM1、hTERC、C-myc结合应用于HPV阳性宫颈癌患者的检测价值尚不明确。本研究选择这3种标志物作为HPV阳性的宫颈癌诊断标志物,检测并评估其临床筛查意义。
1 资料与方法
1.1 临床资料
本研究经过医院伦理委员会批准,经研究对象签署知情同意书后标本采集。选择2015年1月-2016年1月在本院妇产科接受HPV检测且阳性妇女360例。其中,经病理确诊为宫颈癌患者120例(宫颈癌组),年龄43.4±8.2岁,按照国际妇产科联盟(FIGO 2010)制定的临床分期标准分为IA2 期35例、IB1期30例、IB2期31例、IIA1 期12例、IIA2期12例;CIN I-III期患者120例(CIN组),其中I期45例、II期40例、III期35例,年龄42.2±9.5岁;良性子宫颈病变者120例(对照组),年龄43.8±6.9岁。上述病理学诊断依据参考文献[7]标准分型。
1.2 基因检测方法及阳性判断
取患者宫颈组织切片在恒温水浴箱内展开后取出标记,将免疫组化染色片冷切后放入-80 ℃冰箱备用。准备FOXM1、hTERC与C-myc相应的已知阳性切片作为阳性对照,磷酸盐缓冲液(PBS)做阴性对照。采用免疫组织化学法,即用型免疫组化MaxVision检测试剂盒(福州迈新)检测FOXM1、hTERC与C-myc表达。分别由病理科两位医生镜下阅片,根据阳性表达细胞数比例及细胞染色强度判断:①无阳性细胞或细胞染色为浅黄色或棕黄色,或阳性细胞比例<25%,染色为浅黄色为阴性;②阳性细胞比例为25%~50%,或比例<25%但染色为棕黄色为阳性(+);③阳性细胞比例>50%,或比例为25%~50%染色为棕褐色,或比例25%~50%但染色为棕黄色为阳性(++),其中(+)和 (++)均记录为阳性[8]。PCR+膜倒流杂交法[凯普HPV(21型)核酸分型检测试剂盒提供]检测HPV16、18、31、33、35、39、45、51、52、56、58、59、66、68等14种高危型别,1种疑似高危型别HPV53,6种低危型别HPV6、11、42、43、44,CP8304(81)。
1.3 统计学处理
采用SPSS2.0 统计软件分析数据,用例数及百分比进行统计描述,用卡方检验或Fisher确切概率法,用Spearman秩相关分析各个指标间的相关性。以P<0.05表示差异具有统计学意义。
2 结果
2.1 3种基因在HPV阳性不同宫颈组织中表达
FOXM1、hTERC、C-myc三者的阳性率在HPV阳性者的宫颈正常组织、CIN组织与宫颈癌组织标本中存在差异(P<0.05),在宫颈癌组织中均出现了高表达,而在正常组织中表达水平最低。见表1。

表1 HPV阳性者不同宫颈组织中各基因表达情况[例(%)]
*与正常组织比较#与CIN组织比较P<0.05
2.2 宫颈癌组织中FOXM1、hTERC与C-myc表达的相关性
120例宫颈癌组织标本中: FOXM1阳性88例,与C-myc共表达阳性62例,二者共表达阴性17例,秩相关分析显示FOXM1与C-myc表达呈正相关(r=0.227,P=0.024);FOXM1与hTERC共表达阳性58例,二者共表达阴性22例。秩相关分析显示FOXM1与hTERC表达呈正相关(r=0.317,P=0.035);C-my阳性77例,与hTERC共表达阳性60例,二者共表达阴性35例。秩相关分析显示C-myc与hTERC表达呈正相关(r=0.356,P=0.014)。具体见表2。宫颈CIN组织和正常组织中未发现FOXM1、hTERC与C-myc三者间表达有相关性。

表2 宫颈癌组织中FOXM1、hTERC、C-myc表达的情况(例)
2.3 HPV阳性宫颈癌组织中基因表达与临床因素的关系
FOXM1的表达与年龄、脉管侵犯无关,与浸润深度、临床分期、分化程度及淋巴结转移有关(P<0.05);hTERC的表达与年龄、临床分期、脉管侵犯及淋巴结转移无关,与浸润深度、分化程度及有关(P<0.05);C-myc的表达与年龄、脉管侵犯、临床分期及淋巴结转移无关,与浸润深度有关(P<0.05)。见表3。
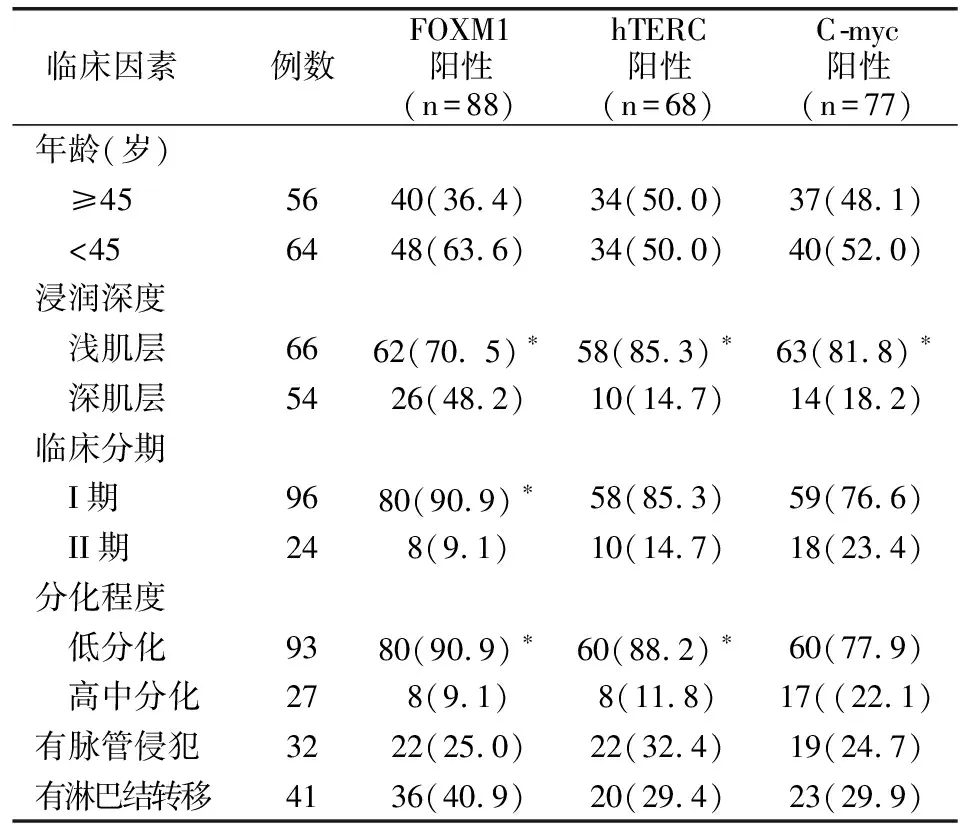
表3 宫颈癌组织中基因表达与临床因素的关系[例(%)]
*组间比较P<0.05
3 讨论
中国作为宫颈癌的高发国,这一恶性肿瘤严重地危害着我国女性的身心健康。如今宫颈癌治疗重点在于防治,HPV检测是宫颈癌筛查的首选方案[8]。细胞学检查是HPV阳性的分检方法,由于HPV检测敏感性不高、特异性低,亟需探究HPV阳性筛查方法[9]。本研究结果提示FOXM1、hTERC与C-myc在宫颈癌的发生发展中可能具有重要的作用,有可能作为HPV阳性者宫颈癌的筛查及预后评估的标志物。
3.1 FOXM1基因的作用
尽管目前FOXM1诱导肿瘤生长的机制尚未明确,但已经发现其与多个信号通路相关,特别是细胞周期相关信号通路[10]。有研究[11]发现,FOXM1在宫颈癌多个细胞系中表达高于永生化的正常宫颈上皮细胞,表明FOXM1可能参与CIN进一步的癌变。而且FOXM1在其他类别肿瘤中的研究[12-15]也发现,其与肺癌、喉癌、肝癌、胰腺癌等肿瘤的分化程度、淋巴结转移、分期等密切相关。这与本研究发现的FOXM1蛋白表达与浸润深度、临床分期、分化程度及淋巴结转移等临床特征有关相一致。
3.2 hTERC基因的作用
本研究中发现,hTERC基因阳性表达与宫颈癌的分化、浸润深度密切相关,但未发现其与淋巴结转移、脉管侵犯等有关。考虑可能HPV感染后,病毒整合导致染色体不稳定,致癌基因编码的原癌蛋白表达促使hTERC基因表达。已有研究[16]表明hTERC基因与HPV感染高度相关,可能HPV感染启动端粒酶基因重新激活,二者共同作用促进宫颈癌变细胞增殖。有研究[17]结果发现hTERC基因阳性扩增与HPV阳性率正相关,且随着组织学病变程度加重,表达呈现增加趋势,提示hTERC基因的异常表达可能预示着宫颈早期病变。
3.3 C-myc基因的作用
在卵巢癌和乳腺癌的研究[18-19]中,C-myc被发现其在肿瘤发生早期的事件触发上起到的影响比较大,而对预后影响较小。这也支持了本文研究的结果:C-myc的表达只与浸润深度有关。考虑可能因为原癌基因C-myc参与细胞增殖、分化和凋亡,作为核转录因子通过编码蛋白质结合DNA链调控转录过程。当其过度表达时,可引发细胞过度增殖且协同其他癌基因,造成细胞恶变[20]。
3.4 3种基因的相互作用
本研究发现,FOXM1、hTERC与C-myc三者之间表达两两相关,提示这三者之间可能存在协同作用。C-myc是周期调控蛋白FOXM1的下游靶基因,二者共同调节细胞分化增殖和凋亡。有研究[20]提示,二者的作用机制可能是通过5′-AC/T-AAA-C/T-AA-3′结合发挥作用,或可能是FOXM1结合TATA盒,转录活化C-myc。而这二者在癌变过程中可能进一步促发了细胞分裂过程中的端粒酶基因的过表达。
综上所述,FOXM1、hTERC与C-myc在宫颈癌的发生发展中可能具有重要的作用,有可能作为HPV阳性宫颈癌的筛查及预后评估的标志物。但这三者之间的具体相互作用机制尚不明确, HPV如何激活FOXM1、hTERC与C-myc还有待进一步深入研究。

