鲭鱼罐头蒸煮液蛋白酶解产物的生物活性分析
林 云, 林 娟, 许鑫琦, 毕丹丹, 郭耀湘
(福州大学生物科学与工程学院, 福建省海洋酶工程重点实验室, 福建 福州 350116)
0 引言
传统观点认为, 蛋白质吸收是蛋白质水解为游离氨基酸后才被吸收利用, 但最近的研究发现, 蛋白质在人类消化道内, 经过多重酶水解, 不仅会以氨基酸的形式进行吸收, 同时还会以小肽的形式吸收, 并且发现小肽的吸收速度比同一组成氨基酸的吸收速度要快[1-2].生物活性肽是指相对分子质量小于6 ku, 对生物体具有一定生理作用或者功能的生物学功能多肽.生物活性肽在消化道内不会被各种消化酶再水解, 而是直接被小肠上皮细胞吸收, 进入人体的循环系统, 并且吸收速度快, 可以很快发挥作用[3].
在水产品加工过程中产生大量下脚料, 由于目前企业缺乏有效的技术手段, 对富含蛋白质的水产品加工蒸煮液利用很少, 多数采用直接排放, 这不仅造成资源的浪费, 同时也对海洋和陆地环境造成污染[4].因此, 对水产品加工废弃液进行综合开发利用, 变废为宝, 生产出农业、 医药、 食品等行业需要的新产品, 将大大降低主导产品成本, 产生较高的经济、 生态和社会效益.
鲭鱼是我国重要的经济鱼类之一, 每百克鱼肉含蛋白质21.4 g, 常被人们用作主要的蛋白质来源.沿海地区鲭鱼产量丰富, 每年捕捞大量鲭鱼制作罐头, 在罐头加工过程产生的大量蒸煮液一般采取直接排放[5].本研究以鲭鱼罐头生产的副产物-蒸煮液为原料, 利用生物酶解技术制备生物活性肽, 既可减少蒸煮液直接排放造成的环境污染, 又可实现鱼罐头加工废弃液的高值化利用.
1 材料与方法
1.1 材料
鲭鱼罐头蒸煮液由福州百洋海味食品有限公司提供.
1.2 主要试剂
胰蛋白酶、 碱性蛋白酶购自南宁庞博生物科技有限公司; 1, 1-diphenyl-2-picrylhydrazyl(DPPH)购自上海Aladdin公司; 血管紧张素转化酶(angiotensin-converting-enzyme, ACE)、 马尿酰-组氨酰-亮氨酸(HHL)、 2, 2′-azinobis-(3-ethylbenzthiazoline-6-sulphonate)(ABTS)购自美国Sigma公司; 其余试剂均为国产分析纯, 购自北京国药股份有限公司、 美国Sigma公司等.
1.3 主要仪器设备
双光束分光光度计(HITACHI U-2910, 日本Hitachi(日立)公司); 高效液相色谱仪(HITACHI L-2000型, 日本Hitachi(日立)公司); 中空纤维柱(MSC-300型, 上海摩速科学器材公司); 分子筛色谱柱(TSK-gel G3000sw, 日本TOSOH公司).
1.4 实验方法
1.4.1单酶和复合酶酶解方法
碱性蛋白酶酶解条件: 反应温度59 ℃, 反应pH值为8.5, 酶添加量为6 752.46 U·g-1, 反应时间3 h; 胰蛋白酶酶解条件: 反应温度55 ℃, 反应pH值为7, 酶添加量为7 450.54 U·g-1, 反应时间4 h; 复合酶酶解条件: 先添加胰蛋白酶进行反应, 温度为55 ℃, 酶添加量为7 450.54 U·g-1, 反应pH值为8, 反应时间为4 h; 而后添加碱性蛋白酶进行反应, 酶添加量为6 752.46 U·g-1, 温度为59 ℃, 反应pH值为8, 反应时间为3 h.
1.4.2酶解产物相对分子质量的高效液相色谱测定
相对分子质量校正所用标准品: 谷胱甘肽(MW=309.5 u), 马尿酸(MW=429.5 u), 维生素B12(MW=1 355 u), 胰岛素(MW=5 734 u), 细胞色素C(MW=12 500 u).
使用对数线性模型(loglinear model)对5种标准品出峰时间进行分析, 得到相对分子质量标准曲线, 关系式为y=-0.396 5x+9.116(R2=0.991 3).
按以下条件对单酶酶解产物、 复合酶酶解产物的相对分子质量进行色谱检测: 色谱柱TSK-gel G3000sw, 流速0.8 mL·min-1, 柱温30 ℃, 流动相0.1 mol·L-1磷酸缓冲液(pH=6.7), 含0.05%(质量分数) NaN3和 0.1 mol·L-1Na2SO4.
1.4.3羟自由基抑制率的测定[6]
在15 mL试管中依次加入0.5 mL不同浓度的样品, 2.0 mmol·L-1FeSO41.5 mL, 6 mmol·L-1H2O21.5 mL和6.0 mmol·L-1水杨酸1.5 mL, 摇匀.37 ℃反应30 min, 取出, 流水冷却, 10 000 r·min-1离心2 min后测定OD510, 以蒸馏水为空白对照, 同时以抗坏血酸(Vc)为阳性对照, 所有实验设置3组平行.其对羟自由基抑制率按以下公式计算:
羟自由基抑制率(%)=[1-(A1-A2)/A0]×100
式中:A0为未加清除剂的吸光度;A1为加入清除剂的吸光度;A2为空白对照的吸光度.
1.4.4DPPH自由基抑制率的测定[7]
取0.1 mL不同浓度的样品, 加入质量浓度为25 mg·L-1的DPPH甲醇溶液(现用现配)3.9 mL, 摇匀, 暗处反应30 min后, 测定OD515, 以0.1 mL甲醇代替样品作空白.
DPPH自由基抑制率(%)=(A0-A1)/A0×100
式中:A0为空白组吸光值;A1为样品组吸光值.
1.4.5ABTS自由基抑制率的测定[8]
2 mL ABTS 溶液(7 mmol·L-1)与1 mL过硫酸钾溶液(终浓度2.45 mmol·L-1)反应产生ABTS 自由基正离子(ABTS+·)溶液, 将该混合物在使用前于暗处室温下保存12~16 h.测定时, (ABTS+·)溶液用5 mmol·L-1磷酸盐缓冲液(pH值7.4)稀释至OD734为0.7±0.02.测定时取50 μL样品与5 mL已稀释的(ABTS+·)溶液混合, 30 ℃下准确读取开始混合后1、 4、 6 min的OD734.每个样品重复测定3次.以不含ABTS溶液的磷酸盐缓冲液为空白.
ABTS自由基抑制率(%)=(A0-A1)/A0×100
式中:A0为734 nm下空白的吸光值;A1为734 nm下样品的吸光值.
1.4.6 超氧阴离子自由基抑制率的测定[8]
将1.0 mL样品与1.8 mL 50 mmol·L-1Tris-HCl 缓冲液(pH=8.2)混合, 混合物在25 ℃下保温10 min, 然后加入0.1 mL 10 mmol·L-1邻苯三酚.测定OD320, 每0.5 min读一次数, 读数8次, 斜率为邻苯三酚自氧化速率.样品抑制邻苯三酚自氧化速率记为ΔA1, 空白的邻苯三酚自氧化速率以1.0 mL双蒸水代替样品(ΔA0)进行测定.
超氧阴离子抑制率(%)=(ΔA0-ΔA1)/ΔA0×100
1.4.7ACE抑制活性的测定[9]
样品溶于0.1 mol·L-1硼酸缓冲液(含0.3 mol·L-1NaCl, pH值为8.3), 制成相应的样品液, ACE、 HHL分别用0.1 mol·L-1硼酸缓冲液配成100 mU·mL-1ACE溶液和5 mmol·L-1HHL溶液.将30 μL HHL和10 μL样品(或缓冲溶液)混匀后, 于37 ℃保温5 min, 再加入20 μL的ACE启动反应, 混匀后继续于37 ℃下反应1 h, 迅速加入70 μL HCl(1 mol·L-1)终止反应, 采用高效液相色谱分析结果.同时用硼酸缓冲液代替样品溶液做空白对照.
按以下条件进行色谱检测: C18柱; 流动相为乙腈-0.05%(体积分数)三氟乙酸水溶液, 梯度条件为乙腈10%~60%(体积分数), 流速0.8 mL·min-1; 检测波长228 nm; 柱温30 ℃; 进样量10 μL.
ACE抑制率(%)=(1-AF/AK)×100
式中: AF为样品马尿酸峰面积; AK为空白组马尿酸峰面积.
2 结果与讨论
蛋白酶是制备生物活性肽的关键因素, 不同的蛋白酶具有不同的专一性以及酶切位点, 选择使用不同的蛋白酶可能会得到功能不同的酶解肽段.而肽段的生物活性与其相对分子质量和氨基酸组成密切相关, 小分子肽段一般具有较好的生物活性.为了得到更小相对分子质量的生物活性肽, 比较单酶和复合酶对酶解产物相对分子质量分布的影响.
2.1 单酶以及复合酶酶解产物的相对分子质量分布差异性分析
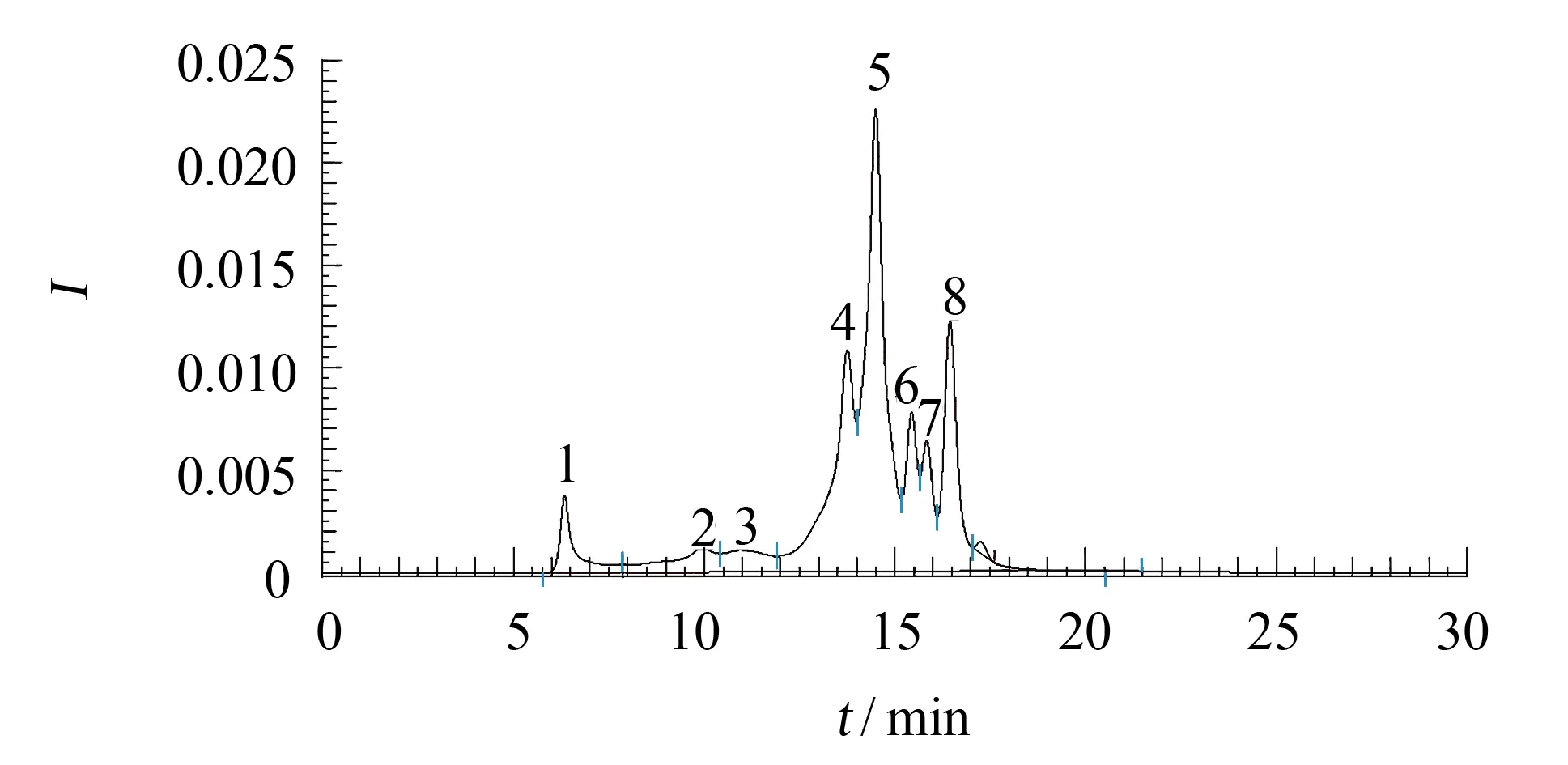
图1 碱性蛋白酶水解产物的高效液相色谱分析 Fig.1 Hydrolysates of alcalase analysed by HPLC
在前期实验中发现, 采用碱性蛋白酶和胰蛋白酶水解得到的产物抗氧化活性较高.在此基础上, 比较碱性蛋白酶、 胰蛋白酶单酶酶解和二者复合酶解得到的产物相对分子质量大小.
2.1.1碱性蛋白酶酶解产物分子量分布
使用TSK-gel G3000sw 色谱柱对碱性蛋白酶酶解产物进行相对分子质量大小分析, 结果如图1所示.碱性蛋白酶酶解产物中MW<10 ku占86%; 其中MW<1 ku的产物占30%, 1~3 ku的占36%, 3~10 ku的占20%.这与蒸煮液酶解前蛋白质相对分子质量主要分布在30 ku以上相比, 蒸煮液蛋白已得到了较大程度的水解.
2.1.2胰蛋白酶酶解产物相对分子质量分布
使用TSK-gel G3000sw 色谱柱对胰蛋白酶酶解产物进行相对分子质量大小分析, 结果如图2所示.胰蛋白酶酶解产物中相对分子质量在10 ku以上的只占4%; 其中MW<1 ku的产物占28%, 1~3 ku的占39%, 3~10 ku的占30%.比较胰蛋白酶和碱性蛋白酶酶解产物的相对分子质量分布情况, 发现在碱性蛋白酶酶解产物中出现的相对分子质量为14.8 ku和5.9 ku的组分在胰蛋白酶酶解产物中不存在, 这表明两种蛋白酶的酶切位点是不相同的, 导致酶解产物不一样.
2.1.3复合酶酶解产物相对分子质量分布
使用TSK-gel G3000sw 色谱柱对复合酶酶解产物进行相对分子质量大小分析, 结果如图3所示.使用碱性蛋白酶和胰蛋白酶复合酶解后, 产物中MW<1 ku的组分占50%, 高于碱性蛋白酶(30%)和胰蛋白酶(28%)单酶水解效果.说明使用分段复合酶解可大幅度提高制备小分子肽段的得率.

图2 胰蛋白酶酶解产物的高效液相色谱分析Fig.2 Hydrolysates of typsin analysed by HPLC
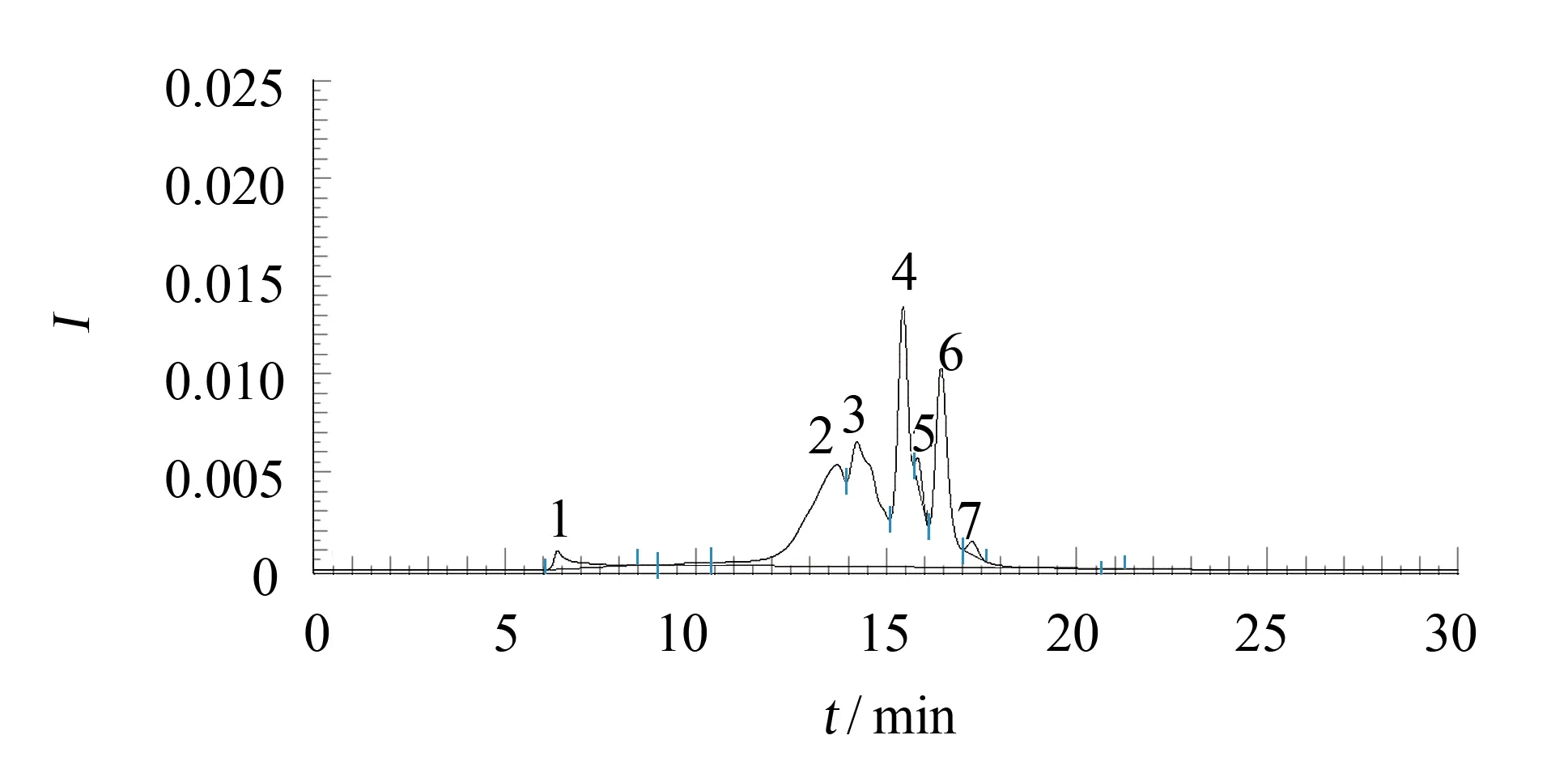
图3 复合酶酶解产物高效液相色谱分析Fig.3 Hydrolysates of compound proteases analysed by HPLC
2.2 复合酶酶解产物的生物活性分析
采用不同截留相对分子质量(10、 3、 1 ku)的超滤膜对复合酶酶解产物进行分离, 得到MW <1 ku(P1)、 MW=1~3 ku(P2)、 MW=3~10 ku(P3)3个组分, 分析不同相对分子质量范围的3个组分的抗氧化能力和降血压活性.
2.2.1不同相对分子质量组分的抗氧化能力比较
分析按节2.2得到的3个组分对羟自由基、 DPPH自由基、 ABTS自由基、 超氧阴离子自由基的清除能力以及还原力, 测定结果如图4所示.分析该3个组分抗氧化活性的IC50值(IC50定义为抑制率达到50%时对应的抑制剂样品的质量浓度), 结果见表1.
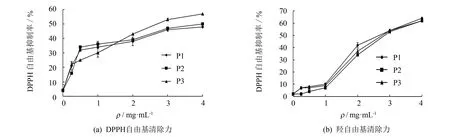

图4 3个酶解组分的抗氧化能力测定Fig.4 Antioxidation ability of different UF fractions about enzymatic hydrolysates of mackerel juice
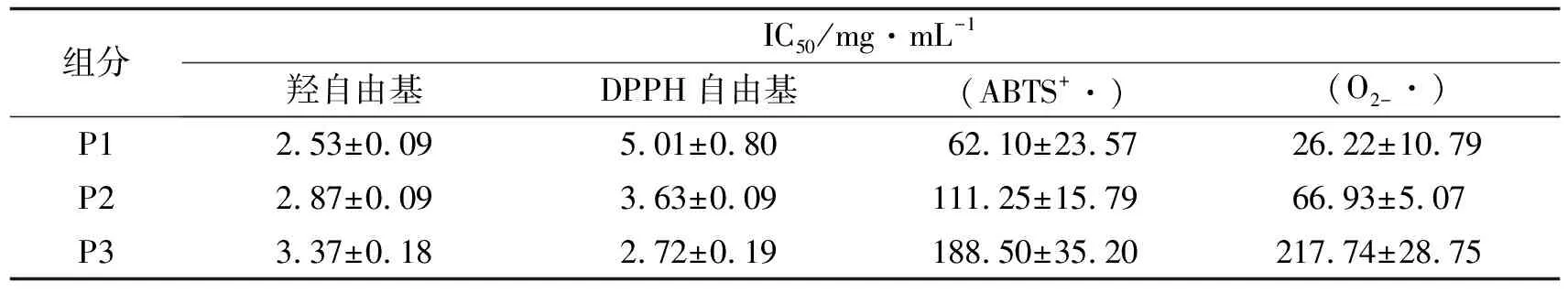
组分IC50/mg·mL-1羟自由基DPPH自由基(ABTS+·)(O2-·)P12.53±0.095.01±0.8062.10±23.5726.22±10.79P22.87±0.093.63±0.09111.25±15.7966.93±5.07P33.37±0.182.72±0.19188.50±35.20217.74±28.75
在DPPH自由基的抑制能力方面, P1组分的IC50最大, P3组分的IC50最小.可见, 对DPPH自由基而言, 相对分子质量越小的肽段, 其抑制DPPH自由基的能力越弱.对于DPPH自由基的抑制效果, 往往是相对分子质量大的肽段具有较高的DPPH自由基抑制率, 这与本实验得出的结论相一致, 导致这一结果的原因尚需进一步研究.相反, 对(ABTS+·)、 (O2-·)、 羟自由基抑制率方面, 则是相对分子质量越小的肽段抑制效果越好.
在还原力方面, P1>P3>P2; 可能是因为分布在3~10 ku的肽段暴露出更多的羟基, 所以其还原力测定效果要好于P2组分, 具体原因有待进一步研究.
综合以上5种抗氧化评价结果, MW<1 ku的肽段具有较好的抗氧化活性.这与文献[10]报道的鳕鱼排水解产物中相对分子质量小于1 ku的组分具有较好抗氧化活性的结论相吻合.
2.2.2不同相对分子质量组分的ACE抑制活性比较
HHL(马尿酰-组氨酰-亮氨酸)在ACE的催化下快速分解为马尿酸和一种二肽(HL, His-Leu), 当加入具有抑制ACE活性的肽段时, ACE受到抑制, HHL分解受到抑制, 导致马尿酸变少, 因此可以通过高效液相色谱检测, 计算得到马尿酸的含量, 进而获得ACE活性抑制率, 评价活性肽对ACE活性的抑制效果.
在ACE反应体系中加入不同组分的活性肽, ACE活性受到了不同程度的抑制, 导致HHL反应生成的马尿酸含量明显下降.具体结果如图5所示.3个组分的ACE活性抑制率随着浓度的增加而增加, 抑制效果为: P1>P2>P3.3个组分对应的IC50值如表2所示.
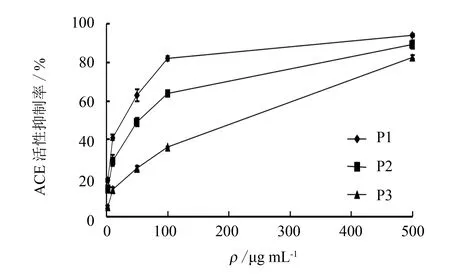
图5 ACE活性抑制率Fig.5 ACE inhibitory rate of UF fractions

组分IC50/μg·mL-1P117.58±1.86P237.23±2.70P3105.19±13.36
Oshima等[11]的研究表明, 一般具有生物活性的多肽的相对分子质量在1 500 u以下; Kim等[12]研究表明, MW<1 ku的组分抑制ACE活性效果最好; Masuda 等[13]从酸奶中分离出一个3肽小分子(400 u 对比碱性蛋白酶、 胰蛋白酶和复合酶酶解产物的相对分子质量分布情况, 发现碱性蛋白酶酶解产物和胰蛋白酶酶解产物的相对分子质量主要分布在1~3 ku之间, 而复合酶酶解产物则主要分布在1 ku以下, 占50%, 这表明使用复合酶酶解可以有效地制备更多小分子的活性肽. 采用超滤方法对复合酶酶解产物进行分离, 得到不同相对分子质量范围的3个组分.使用5种体外抗氧化测定方法评价3个组分的抗氧化效果, 其中MW<1 ku的肽段具有较好的抗氧化活性.通过测定3个组分的ACE活性抑制效果, 发现MW<1 ku组分的降血压活性最强, IC50为(17.58±1.86)μg·mL-1.3 结语

