经导管肝动脉化疗栓塞术联合鸦胆子油乳液静脉滴注对原发性肝癌的疗效及VEGF水平的影响
董智刚,马丽丽,张占红,贾绍华,佟克杰,杨丽英,李亚娟
(1.河北省唐山市丰南区医院 肝胆外科,河北 唐山 063300;2.河北省唐山市人民医院消化内科,河北 唐山 063000;3.河北省唐山市丰南区医院 护理部,河北 唐山 063300)
经导管肝动脉栓塞化疗术(transcatheter arterial chemoembolization, TACE)已成为治疗中晚期肝癌的有效方法,而TACE术后患者血浆中的内毒素及血管内皮生长因子(vascular endothelial growth factor, VEGF)水平明显升高[1-2],且患者肝功能损害较重。体外研究表明,肿瘤血管结构的形成过程与VEGF密切相关,肿瘤的转移复发过程可被VEGF激活[3-5]。因此,降低肝癌患者血浆内毒素及VEGF的水平,对改善患者的肝功、减少肝癌的转移复发及延长患者的生存期有重要意义。鸦胆子油为传统中药,可直接杀伤癌细胞[6-7],目前被广泛应用于各类癌症的辅助治疗,但是关于其对肝癌患者疗效的相关报道较少。本研究中选取本院原发性肝癌患者88例,采用鸦胆子油乳液静脉滴注联合TACE治疗,观察临床治疗效果及VEGF水平的影响。
1 资料与方法
1.1 一般资料
选取2012年3月-2014年3月本院肝胆科收治的原发性肝癌患者88例。纳入标准[8-9]:①均符合中华医学会肝胆病学分会颁布的关于原发性肝癌的诊断标准;②无肝外转移;③肝功能分级为A~B级;④患者具备TACE手术适应证;⑤血常规显示血小板浓度>50×109个/L;⑥预计生存期>3个月。排除标准[10]:①伴有心脑血管疾病;②合并门静脉主干癌栓或梗阻性黄疸;③既往有肝硬化引起的食管静脉曲张出血。采用随机数字法将患者分为研究组及对照组,每组各44例。其中,男性50例,女性38例;年龄39~76岁,平均(42.75±6.42)岁;肝功能Child-Pugh分级:A级52例,B级36例;血清甲胎蛋白(alpha fetoprotein, AFP):<400 μg/L 54 例≥ 400 μg/L 34 例;病灶数目:多发32例、单发56例;肿瘤直径(多病灶者为全部肿瘤直径之和)<5 cm 63例≥5 cm 25例。两组患者的性别、年龄、肿瘤直径、血清AFP浓度及肝功分级等一般资料比较,差异无统计学意义(P>0.05),具有可比性。本研究经院内伦理委员会审核批准。
1.2 治疗方法
两组患者均行TACE治疗,其治疗间隔为4周。在数字减影心血管造影术(DSA)造影设备实时监测下,导管经右侧股动脉插管进入肠系膜上动脉,造影后根据观察组患者病灶大小在肿瘤供血动脉内多次交替注射丝裂霉素10~15 mg、吡柔比星20~40 mg、5-氟尿嘧啶500~1 000 mg,最后注入明胶海绵及吡柔比星10 mg与碘化油混乳液栓塞肿瘤动脉。每次TACE术后行7 d的常规保肝(还原性谷胱甘肽等)治疗,并于术后第2天静脉滴注鸦胆子油乳液,30 ml/次,1次/d,治疗15 d。对照组患者除不予以鸦胆子油乳液静脉滴注外,其余治疗药物及治疗方法同观察组。
1.3 观察指标
观察两组患者治疗后的临床疗效、不良反应发生率、肿瘤进展时间(time to progress, TTP)及总生存期,同时对比两组治疗前后氨基亮氨酸转移酶(aminoleucine transferase, ALT)、天冬氨酸转氨酶(aspartate aminotransferase, AST)、总胆红素(total bilirubin, TBIL)、血浆内毒素及VEGF的水平。
1.4 疗效判定及检测方法
根据治疗3次后病灶大小变化情况判定其疗效,参照改良实体肿瘤疗效评价标准(mRECIST)标准[11],分为:①痊愈(complete remission, CR):病灶被完全清除且4周内不复发;②有效(partial remission,PR):病灶大小<治疗前大小×50%,且28 d内无新病灶出现;③稳定(stable disease, SD):治疗前大小×50%≤病灶大小<治疗前大小×125%,且28 d内无新病灶出现;④恶化(progressive disease,PD):病灶大小≥治疗前大小×125%,或出现新病灶。总有效率=(CR+PR)/总例数×100%。在术前及术后第7天抽取患者空腹时的外周静脉血液5 ml,行肝功能、血浆内毒素及VEGF水平的检测。使用自动生化分析仪检测肝功能指标。采用BET-24A内毒素检测仪检测血清内毒素水平,试剂由河北利平生物科技有限公司生产,批号:38220090。使用ELISA对血浆VEGF水平进行检测,试剂盒由上海西唐生物科技有限公司提供,批号:2060511。所有检测流程均严格按照使用说明书进行操作。
1.5 随访
前一次治疗完成28 d内对患者进行CT扫描。对于随访结果为CR或PR者,进行1个月的追加CT随访;若随访结果为SD或PD,对其行追加治疗。总生存率为死亡例数/总例数。TTP即肿瘤进展时间为患者首次出现随访结果为PD的时间间隔。随访6~37个月,整个研究过程中无失访病例。
1.6 统计学方法
数据分析采用SPSS 19.0统计软件,计量资料以均数±标准差(±s)表示,采用t检验,计数资料以例(%)表示,组间比较做χ2检验,等级资料的比较采用秩和检验,生存率的比较采用Log-Rank χ2检验,P<0.05差异有统计学意义。
2 结果
2.1 两组治疗情况
研究组44例患者共行TACE术239次,人均5.43次;对照组44例患者行TACE术243次,人均5.52次,TACE术后对满足射频治疗适应证的患者行射频消融治疗。两组的治疗次数及后续治疗比较,差异无统计学意义(P>0.05)。
2.2 两组疗效比较
观察组治疗后的总有效率高于对照组(Z=9.394,P=0.002),见表1。
2.3 治疗前后两组血浆内毒素含量及VEGF水平的比较
治疗前两组血浆内毒素含量及VEGF水平相比差异无统计学意义(P>0.05)。治疗后,观察组血浆内毒素含量及VEGF水平低于对照组(P<0.05),见表2。
2.4 治疗前后两组肝功能指标的比较
治疗前两组肝功能指标水平差异不大(P>0.05);治疗后,观察组ALT、AST、TBIL的水平均低于对照组(P<0.01),见表3。
2.5 两组不良反应情况的比较
治疗后,观察组的不良发生率(29.55%)低于对照组(59.09%),组间比较差异有统计学意义(χ2=7.78,P=0.01)。见表4。
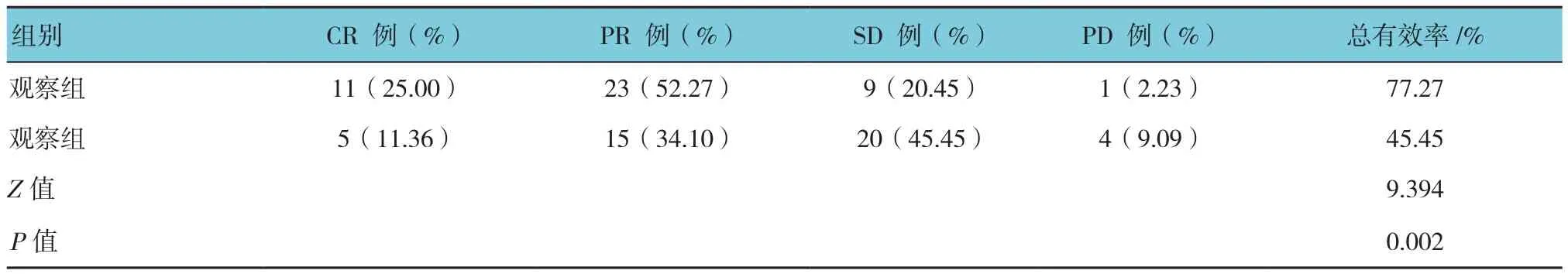
表1 两组疗效的比较
表2 治疗前后两组血浆内毒素含量及VEGF水平的比较 (n=44,±s)
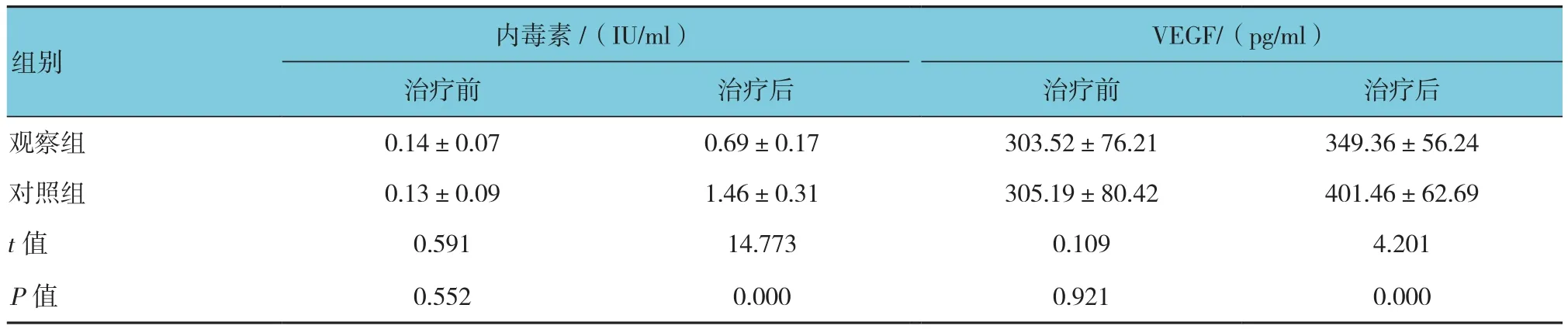
表2 治疗前后两组血浆内毒素含量及VEGF水平的比较 (n=44,±s)
内毒素 /(IU/ml) VEGF/(pg/ml)治疗前 治疗后 治疗前 治疗后观察组 0.14±0.07 0.69±0.17 303.52±76.21 349.36±56.24对照组 0.13±0.09 1.46±0.31 305.19±80.42 401.46±62.69t值 0.591 14.773 0.109 4.201P值 0.552 0.000 0.921 0.000组别
表3 治疗前后两组肝功能指标的比较 (n=44,±s)
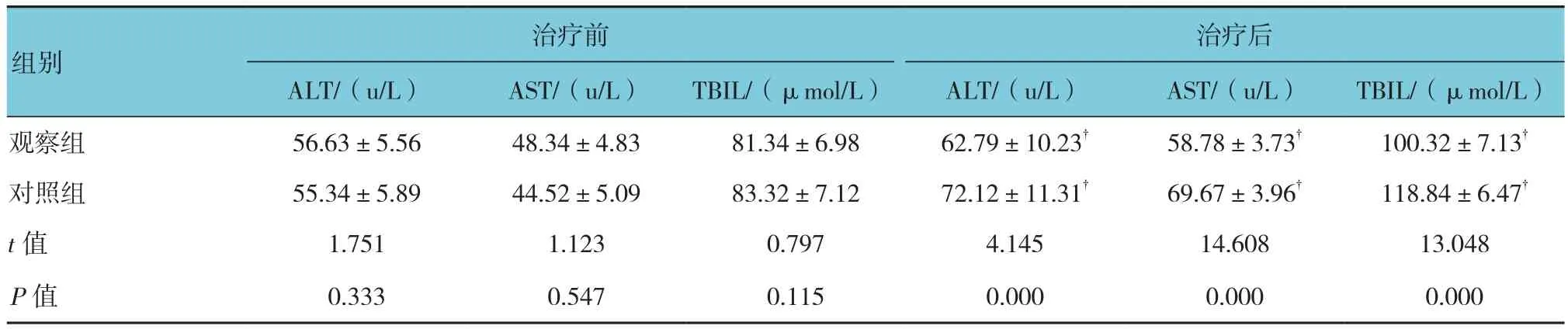
表3 治疗前后两组肝功能指标的比较 (n=44,±s)
注:†与治疗前比较,P<0.01
治疗后ALT/(u/L) AST/(u/L) TBIL/(μmol/L) ALT/(u/L) AST/(u/L) TBIL/(μmol/L)观察组 56.63±5.56 48.34±4.83 81.34±6.98 62.79±10.23†58.78±3.73†100.32±7.13†对照组 55.34±5.89 44.52±5.09 83.32±7.12 72.12±11.31†69.67±3.96†118.84±6.47†t值 1.751 1.123 0.797 4.145 14.608 13.048P值 0.333 0.547 0.115 0.000 0.000 0.000治疗前组别
2.6 两组中位TTP及总生存期的比较
观察组及对照组的中位TTP分别为(11.23±2.73)及(8.91±2.69)个月,差异有统计学意义(t=4.110,P=0.000);观察组及对照组的1、2及3年总生存率分别为95.47%、63.68%、25.59%和93.56%、64.23%及24.34%,差异无统计学意义(P>0.05)。
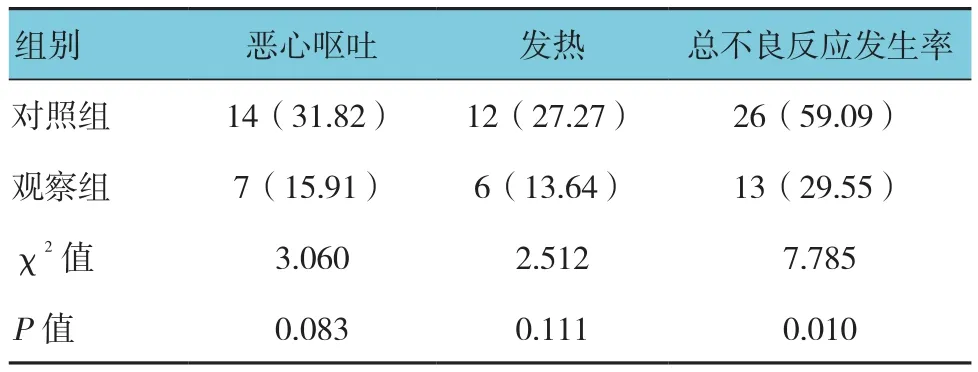
表4 两组不良反应情况的比较 [n=44,例(%)]
3 讨论
TACE目前已被广泛用于治疗无法手术的中晚期肝癌患者。研究发现,TACE通过局部栓塞化疗药物能使肿瘤完全坏死率达到15%~20%,对肝癌患者疗效确切,但其严重影响患者的肝功且单纯TACE对延长肝癌患者生存期效果不佳[12-13]。相关研究证实TACE术后肝脏的缺血坏死可使血浆内毒素及VEGF水平升高[14]。作为一种促进肿瘤血管结构形成的特异性因子,VEGF在肝癌细胞中高表达,其对肝癌的复发转移具有重要促进作用。GUADAGNI等发现,肿瘤细胞VEGF的表达可受多种因素影响,其中缺氧诱导因子1(hypoxia inducible factor-1, HIF-1)具有重要作用,在细胞缺氧时产生的HIF-1诱导下,VEGF mRNA合成增多,进而增加血浆VEGF的水平,且恶性程度越高的肿瘤细胞增殖越快,细胞缺氧越重进而产生越多的HIF-1[15]。内毒素是一种由肠道菌群代谢产生的毒性物质,正常肝组织中可通过库否细胞分解内毒素,TACE术后肝癌患者由于癌细胞的扩散加之术中创伤性操作可直接导致库否细胞受损,进而降低了肝脏的解毒功能,同时内毒素可通过肝脏微循环诱导炎症因子介导的肝损伤,使肝脏微循环受阻引发组织细胞缺氧。由此可见肝癌患者预后与血浆内毒素及VEGF水平联系密切。
鸦胆子最早见于《本草纲目》,具有腐蚀赘疣、消坚散结、清肝明目的作用。以丙三醇为原料、天然豆磷脂为乳化剂制成的鸦胆子油乳剂,为我国首创的抗癌药物,因其对肿瘤细胞膜的亲和性可直接进入并杀伤肿瘤细胞,目前被广泛用于癌症的辅助治疗,其中的主要活性成分为亚油酸和油酸。大量体外研究表明,鸦胆子油乳剂可通过与细胞膜融合,其有效活性成分可进入并杀伤肿瘤细胞,同时可上调抑癌基因的表达水平,干扰癌细胞DNA的合成[16-18]。此外STANZANI等发现,鸦胆子油乳剂可上调突变细胞中TIP基因相关蛋白的表达,而TIP相关蛋白可通过与HIF-1结合抑制其对VEGF mRNA的激活作用,进而减少VEGF的合成,对降低肝癌的复发转移率具有重要作用[19-20]。研究发现,鸦胆子油乳液中的主要活性成分与细胞膜亲和性较强,且可抑制在肿瘤中高表达的拓扑异构酶(TOPOⅡ)活性,阻断肿瘤细胞的增殖,保护正常肝细胞,降低血浆内毒素水平[21]。本研究结果显示,观察组患者在治疗后其中位TTP、肝功能指标、血浆内毒素及VEGF水平均低于对照组,印证上述两项研究。肝癌细胞对化疗药物的抗拒为目前化疗方案疗效不佳的原因之一,NAKATAKE等通过体外研究发现,鸦胆子可逆转肝癌细胞株的耐药性,提升癌细胞对化疗药物的敏感性,使药物疗效更明显[22]。本研究结果显示,两组的治疗总有效率比较,观察组高于对照组,同时观察组发热、恶心呕吐等不良反应发生率低于照组,提示鸦胆子油乳液联合TACE提升体内肝癌细胞对化疗药物敏感度,促进肿瘤细胞的凋亡,且安全性更高,与目前报道相符[23-24]。
综上所述,鸦胆子油乳液辅助TACE治疗肝癌可改善患者的近期疗效和肝功能,延长TPP时间,降低血浆内毒素、VEGF的水平,对预防肝癌的复发转移具有一定疗效,是治疗肝癌安全有效的方法。

