鸦胆子素D对人胰腺癌细胞株Panc-1体外增殖的抑制作用
王飞达 王兆洪 张跃 童洪飞 王向昱 王继生
●论 著
鸦胆子素D对人胰腺癌细胞株Panc-1体外增殖的抑制作用
王飞达 王兆洪 张跃 童洪飞 王向昱 王继生
目的钼探讨鸦胆子素D对人胰腺癌细胞株Panc-1体外增殖的影响。方法钼人胰腺癌细胞株Panc-1经不同浓度(0、5、10、20、40、60μmol/L)鸦胆子素D分别作用24、48、72 h后,应用CCK-8法检测鸦胆子素D对Panc-1细胞的增殖抑制作用;流式细胞术检测Panc-1细胞凋亡情况;Western b lot检测Panc-1细胞经0、5、10、20、30、60μmol/L的鸦胆子素D处理24h后以及20μmol/L的鸦胆子素D处理24、48、72 h后,细胞中Bax及Bc l-2的表达。结果 鸦胆子素D对Panc-1细胞的增殖抑制作用呈明显浓度和时间依赖性,60μmol/L时对Panc-1作用24、48、72 h后细胞存活率分别为54.44%、33.00%、21.63%,凋亡率分别为47.29%、63.80%、72.16%;0、5、10、20、30、60μmol/L的鸦胆子素D作用于Panc-1细胞72h后的细胞存活率是100%、71.60%、60.37%、46.78%、39.98%、21.63%,凋亡率分别为0、26.63%、45.62%、56.18%、62.21%、72.16%;随着鸦胆子素D作用时间的延长或浓度的增加Bax蛋白的表达升高,Bc l-2蛋白的表达降低。结论 鸦胆子素D可显著抑制人胰腺癌Panc-1细胞生长,并促进其凋亡,在一定的浓度和时间范围内,其作用呈明显浓度和时间依赖性,其作用机制可能是通过促进Bax的表达,降低Bc l-2的表达实现的。
鸦胆子素D胰腺癌 增殖 Bax Bc l-2
胰腺癌由于位置深,起病隐匿,发现时已多属晚期,且病情发展迅速,治疗效果较差。目前以吉西他滨为基础的化疗是治疗胰腺癌最主要的内科治疗手段[1],国内外有许多关于吉西他滨联合用药治疗晚期胰腺癌的试验,如吉西他滨联合顺铂、靶向药物等治疗胰腺癌,在一定程度上能改善胰腺癌的治疗效果[2]。近年来中医药抗癌研究取得了重大进展,国内外已有研究报道大黄素、姜黄素等能显著抑制胰腺癌细胞的增殖[3-4]。有报道表明,鸦胆子素对肝癌、肺癌、乳腺癌等众多肿瘤细胞的增殖有抑制作用[5],但其作用机制尚未完全明确。故我们通过研究不同浓度的鸦胆子素D对胰腺癌细胞生长的影响,探讨其可能的作用及其机制,现报道如下。
1 材料和方法
1.1 主要药品和试剂 鸦胆子素D(纯度>98%),产品批号:Y0001196(美国Sigma公司),用二甲基亚砜(DMSO)配制成0.2m mol/L(DMSO的终浓度<0.05%);胎牛血清、胰酶、RPMI-1640培养基(美国Gibco公司);CCK-8试剂盒,批号C0038(中国碧云天生物技术研究所);Annexin V-FITC细胞凋亡检测试剂盒批号TY4681(中国南京凯基生物发展有限公司);Bax抗体,批号:1063-1、Bcl-2抗体,批号:1017-1和β-actin抗体,批号:1854-1(Epitomics公司,美国)。
1.2 细胞培养 人胰腺癌细胞Panc-1(购于美国模式培养物集存库,ATCC)培养于含10%胎牛血清、100μ/ml青霉素和100μg/ml链霉素的RPMI1640培养液中,置于含5%CO2,37℃细胞培养箱中培养,每3d换液1次。细胞单层贴壁生长,约80%融合时胰蛋白酶消化传代。
1.3 CCK-8法检测细胞存活率 收集处于对数生长期的Panc-1胰腺癌细胞,接种到96孔板,4×103个/孔,细胞贴壁后,分别加入不同浓度鸦胆子素D(0、5、10、20、30、60μmol/L)分别作用24、48、72h,每组重复5孔。同时设置空白调零组(不加细胞加入等量的PBS)。药物作用结束前1h,各孔加入0.01ml CCK-8,继续培养1h,酶标仪(Bio-Tek,ELX800美国宝特)测定波长450nm处的吸光度值测(A值),实验重复3次。细胞存活率=(实验组A值-空白调零A值)/(对照组A值-空白调零A值)×100%。
1.4 流式细胞术检测细胞凋亡 采用Annexin V-FITC/ PI双染流式细胞术检测细胞凋亡。将4×105个处于对数生长期的Panc-1细胞接种在6孔培养板中,生长至90%融合时,分别加入不同浓度鸦胆子素D(0、5、10、20、30、60μmol/L)分别作用24、48、72h后,胰蛋白酶消化,1 000r/min离心5min。冷PBS洗2次,按Annexin V-FITC/ PI凋亡检测试剂盒说明用500μl Binging Buffer重悬细胞,加入5μl Annexin V-FITC和5μl PI混匀,室温避光作用15min上机检测,检测细胞数为1×104/组。激发波长488nm,发射波长530nm。Cellquest软件分析。
1.5 Western blot检测Panc-1胰腺癌细胞蛋白Bax和Bcl-2的表达 收集处于对数生长期的Panc-1胰腺癌细胞经30μmol/L鸦胆子素D作用24、48、72h后,RIPA裂解液裂解,提取上清液,测量蛋白浓度。取等量蛋白质样品(20μg/孔),8%SDS-PAGE电泳,半干转膜仪转膜,5%脱脂奶粉封闭后滴加兔抗人Bax或者Bcl-2抗体为第一抗体,HRP标记的羊抗兔IgG为第二抗体,ECL显色,X线胶片曝光。
1.6 统计学处理 采用SPSS 18.0统计软件,测得计量资料采用表示,组间比较采用单因素方差分析。
2 结果
2.1 鸦胆子素D对Panc-1胰腺癌细胞增殖的影响 0、5、10、20、30、60μmol/L鸦胆子素D分别作用24h后细胞的存活率是100%、92.84%、86.50%、80.16%、75.39%、 54.44%;作用48h后细胞的存活率是100%、76.86%、68.71%、60.87%、50.24%、33.00%;作用72h后细胞的存活率是 100%、71.60%、60.37%、46.78%、39.98%、21.63%。相同的作用时间,随着鸦胆子素D浓度的提高细胞的存活率逐渐降低(P<0.05);相同浓度的鸦胆子素D随时间的延长细胞的存活率逐渐降低(P<0.05)。详见图1。
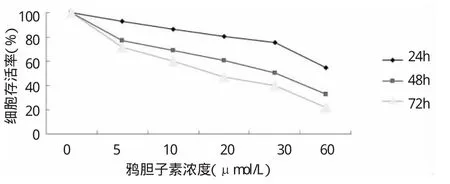
图1 鸦胆子素D对Panc-1胰腺癌细胞增殖的影响
2.2 鸦胆子素D对Panc-1胰腺癌细胞凋亡的影响 0、5、10、20、30、60μmol/L鸦胆子素D分别作用24h后细胞的凋亡率是0、11.02%、17.13%、26.51%、35.37%、47.29%;作用48h后细胞的凋亡率是0、18.13%、29.56%、43.56%、50.26%、63.80%;作用72h后细胞的凋亡率是0、26.63%、45.62%、56.18%、62.21%、72.16%。相同的作用时间,随着鸦胆子素D浓度的提高细胞的凋亡率逐渐升高(P<0.05);相同浓度的鸦胆子素D,随时间的延长细胞的凋亡率逐渐升高(P<0.05)。详见图2。

图2 鸦胆子素D对Panc-1胰腺癌细胞凋亡的影响
2.3 Western blot检测Panc-1胰腺癌细胞Bax和Bcl-2蛋白的表达 30μmol/L鸦胆子素D对Panc-1胰腺癌细胞作用0、24、48、72h后,Bax蛋白表达随鸦胆子素D作用时间延长而上调,Bcl-2蛋白的表达则随作用时间延长而下调(见图3)。0、5、10、20、30、60μmol/L鸦胆子素D对Panc-1胰腺癌细胞作用24h后,Bax蛋白表达随鸦胆子素D浓度增加而上调,Bcl-2蛋白的表达则随浓度增加而下调(见图4)。
3 讨论
鸦胆子,别名老鸦胆、苦参子,为苦木科植物鸦胆子的干燥成熟果实。临床上将10%鸦胆子油乳剂用于治疗消化系统肿瘤,如胃癌、食管癌、原发性肝癌、大肠癌、胰腺癌等,效果显著。有研究发现,鸦胆子中的一种单体鸦胆子素D能够诱导胰腺癌细胞的凋亡[6-7]。本实验中胆子素D既能抑制胰腺癌Panc-1细胞增殖,也能够诱导胰腺癌细胞的凋亡。相同的作用时间,随着鸦胆子素D浓度的提高细胞的存活率降低,凋亡率逐渐升高(P<0.05);相同浓度的鸦胆子素D,随时间的延长存活率降低,凋亡率逐渐升高(P<0.05)。即鸦胆子素D对胰腺癌的抑制作用有时间和浓度依赖性。
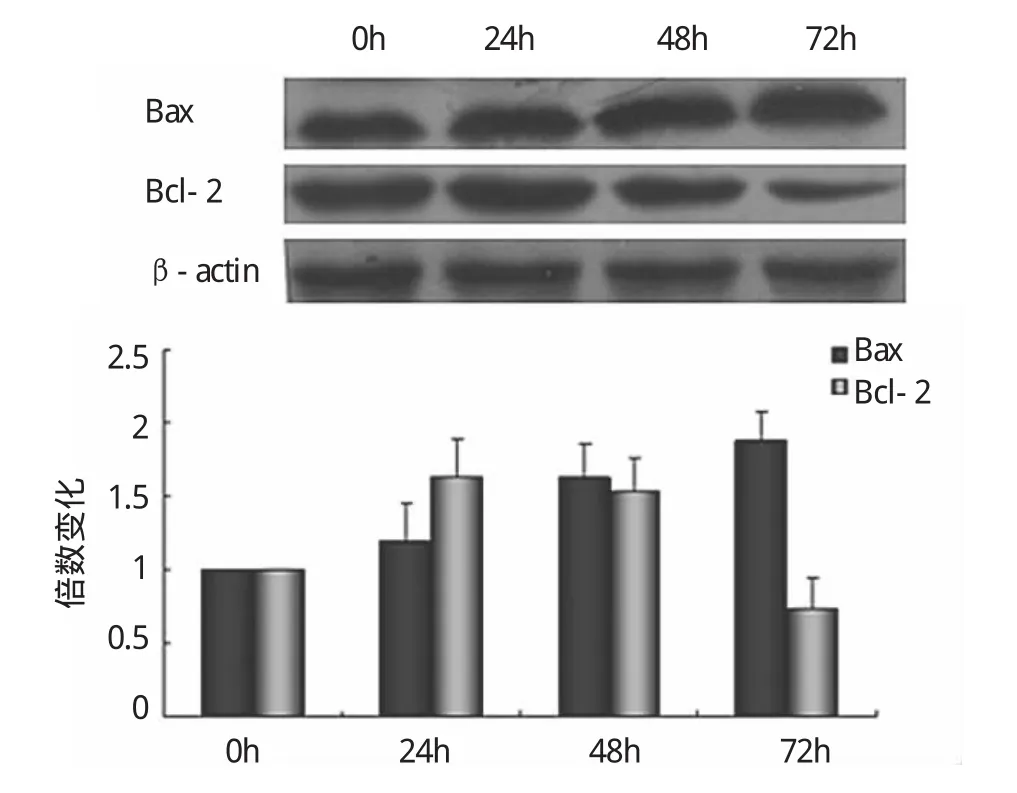
图3 30μmol/L鸦胆子素D作用Panc-1细胞后Bax及Bcl-2蛋白的表达情况

图4 0、5、10、20、30、60μmol/L鸦胆子素D对Panc-1胰腺癌细胞作用24 h后,Bax蛋白表达情况
细胞的凋亡受多种基因的调节,Bcl-2和Bax是Bcl-2家族重要的凋亡调控基因,通常情况下是以异源二聚体的形式存在的,Bcl-2和Bax与多种肿瘤和非肿瘤病变的发生、发展有关。研究表明,Bcl-2/Bax比例是决定细胞对凋亡的调节有重要作用。当比例增高时,细胞凋亡受到抑制,反之,细胞易于发生凋亡。有实验证明,鸦胆子对胃癌细胞增殖有显著的抑制作用,其可能的机制是Bcl-2蛋白表达水平下降,而Bax蛋白表达水平升高诱导凋亡的发生[8]。鸦胆子素D是鸦胆子的主要成分,本实验结果显示Panc-1胰腺癌细胞受鸦胆子素D作用后Bcl-2蛋白的表达降低,而Bax蛋白的表达升高。在本实验的浓度范围内随着鸦胆子素D浓度的增高及时间的延长,Bcl-2蛋白表达也相应的降低,Bax蛋白的表达升高。
本实验初步证实鸦胆子素D能够抑制胰腺癌细胞的增殖并促进其凋亡,其机制可能是通过改变Bcl-2/ Bax异源二聚体而实现的抗凋亡的。鸦胆子素D对胰腺癌影响的具体机制有待进一步研究。
[1]Vincent A,Herm an J,Schulick R,et al.Pancreatic cancer[J]. Lancet,2011,378(9791):607-620.
[2]Philip PA,BenedettiJ,Corless C L,ela l.PhaseⅢstudy comparing gem citab ine p lus cetuxim ab versus gem citabine in patients with advanced pancreatic adenocarcinoma:Southwest Ontology Group-d irected interg roup trialS0205[J].Journalof ClinicalOncology,2010,28(22):3605-3610.
[3]谢丽微,刘岸,赵志光,等.大黄素联合吉西他滨对胰腺癌细胞生长的影响[J].浙江医学,2011,33(3):328-330.
[4]Shadan Ali,Aam ir Ahm ad,Sanjeev Banerjee,et al.Gem citabine Sensitivity Can Be Induced in Panc reatic Cancer Cells through Modulation ofm iR-200 and m iR-21 Exp ression by Curcum in or Its Analogue CDF[J].CancerRes,2010,70(9):3606-3617.
[5]Hua Gao,Julie Lam usta,Wei-Fang Zhang,et al.Tum or CellSelective Cytotoxicity and Apop tosis Induction by an HerbalPreparation from Brucea javanica[J].N Am JMed Sci(Boston),2011,4 (2):62-66.
[6]Zhao M,Lau ST,Leung PS,etal.Seven quassinoids from Fructus Bruceae with cytotoxic effects on pancreatic adenocarc inoma cell lines[J].Phytotherapy Research,2011,25(12):1796-1800.
[7]Lau S T,Lin Z X,Leung P S.Role of reactive oxygen species in b rucein D-m ed iated p38-m itogen-activated p rotein kinase and nuc lear fac tor-kappaB signalling pathways in hum an pancreatic adenocarcinoma cells[J].Br JCancer,2010,102(3):583-593.
[8]范临夏,曲强,刘华,等.苦参碱调节Bax和Bc l-2蛋白表达诱导肺腺癌A54细胞凋亡的机制[J].中华中医药杂志,2012,27(1):231-233.
Brucein D inhibits proliferation and induces apoptosis of PANC-1 pancreatic adenocarcinoma cell line
WANG Feida,WANG Zhao-hong,ZHANG Yue,et al.Department of Internal Chinese Medicine,Tongde Hospital of Zhejiang Province,Hangzhou 310012, China
Objective To investigate the effec t of b rucein D(BD)on p roliferation and apop tosis of pancreatic adenocarcinoma cells.Methods Human pancreatic cancer PANC-1 cells were treated with 0,5,10,20,30 and 60μmol/LBD for 24, 48 and 72h.The cellp roliferation was detected by cellcounting kit-8(CCK-8)assay,cellapop tosis was detec ted using Annexin V-FITC/PI.The p rotein exp ressions of Bax and Bc l-2 were detected using Western b lot.Results BD significantly inhibited p roliferation of PANC-1 cells,up-regulated Bax p rotein exp ression and down-regulated Bc l-2 exp ression in a dose-and time-dependentmanner(P<0.05).Conclusion BD can significantly inhibit the p roliferation and induce apop tosis of PANC-1 cells in vitro,which is associated w ith up-regulation the exp ression of Bax and down-regulation the exp ression of Bc l-2.
Brucein D Pancreatic carcinoma Proliferation Bax Bc l-2
2015-03-05)
(本文编辑:沈昱平)
浙江省温州市科技局计划项目(Y20130099)
310012杭州,浙江省立同德医院中医内科(王飞达);温州医科大学附属第二医院肝胆外科(王兆洪、张跃、童洪飞、王向昱、王继生)
王兆洪,E-mail:wangzhaohong55@163.com

