烟曲霉对肺微血管内皮细胞通透性的影响及可能机制
宋 珺, 韩 菁, 孙 越, 施伟民
(上海交通大学附属第一人民医院皮肤科,上海 200080)
侵袭性肺曲霉病(invasive pulmonary aspergillosis, IPA)是烟曲霉菌(Aspergillusfumigatus, AF)侵入免疫受损宿主所导致的一种高致死率的严重感染性疾病[1-3]。该病的病理表现为急性广泛出血性坏死性肺炎、脓肿或由上皮细胞和巨噬细胞组成的肉芽肿,还表现为曲霉菌在肺组织内增殖并侵入血管,导致坏死性血管炎、血栓和菌栓性出血,并可经血行播散,甚至全身多器官受累,预后极差[1-3]。
烟曲霉是一种通过空气传播的腐生条件致病真菌,广泛存在于自然界,其孢子直径很小,可被动吸入呼吸道进入人体从而引起肺部感染,引起炎症因子释放激发免疫反应,进而引发IPA[4-7]。呼吸道黏膜通常是由气道上皮细胞、间质成纤维细胞和肺微血管内皮细胞(pulmonary microvascular endothelial cells, PMVECs)组成一个功能单位,参与疾病的病理生理过程。PMVECs是肺脏内含量最为丰富的细胞之一,其通过细胞间的相互作用以及与细胞外基质连接构成肺微循环交换血管的最内层,具备代谢活跃和功能复杂的特点[8-10]。PMVECs参与肺内多种生理功能的调节,如微血管紧张性的维持、宿主自身防御反应以及血管生成等,其功能和结构的完整性对于维持正常肺生理功能至关重要[8-10]。在肺部炎症反应过程中,PMVECs是病毒、细菌、真菌、炎症因子等首先攻击的效应细胞之一,其维持的结构和功能屏障被破坏以及由此造成的细胞通透性增加为肺部多种疾病的病理基础之一[8-10]。
目前,尚未有研究报导烟曲霉对PMVECs通透性的影响。本研究考察了烟曲霉对PMVECs通透性的影响,并对其可能机制进行了探讨。
1 材料与方法
1.1 材料
人PMVECs(HPMVECs)购于美国加利福尼亚州圣地亚哥ScienCell研究实验室;烟曲霉菌株(AF 293)购于中国普通微生物菌种保藏管理中心;吐温80购自生工生物工程(上海)股份有限公司;胎牛血清、DMEM、胰蛋白酶等细胞培养试剂购自赛默飞世尔公司;激光共聚焦扫描显微镜(Leica TCS SP5)购自Leica公司;跨膜电阻仪购自Millipore公司。
1.2 烟曲霉菌孢子悬液制备
取AF293烟曲霉菌菌株接种于马铃薯葡萄糖琼脂培养基上,37℃培养箱培养3d,0.1%吐温80的生理盐水10mL冲洗培养基表面,收集烟曲霉菌孢子悬液,8层无菌纱布(高压灭菌)过滤,含0.1%吐温80的PBS液清洗,后转入离心管中,1000r/min,离心10min,弃去上清液,烟曲霉孢子重悬于含0.1%吐温80的PBS液中,计数孢子数量,再将烟曲霉孢子悬液离心(1000r/min)10min,孢子重悬于PBS中,调整孢子浓度为5×107cfu/mL,备用。
1.3 细胞培养
HPMVECs的培养参照以前的研究[11],培养液为专用内皮细胞培养液。HPMVECs达90%培养皿底壁后,弃旧培养液,适量PBS清洗,加入适度预热的胰酶,置于37℃培养箱消化,加入培养液终止消化,移液器轻轻吹打,待细胞全部吹打下来后,收集HPMVECs悬液,于15mL离心管中离心5min(离心半径30cm,1000r/min),培养液调整细胞密度后置于孵箱(37℃、5% CO2饱和湿度)中进行传代培养。于传代培养第5代(细胞达90%底壁)后,HPMVECs被给予烟曲霉菌孢子处理。
1.4 细胞处理以及激光共聚焦扫描显微镜检测
HPMVECs被胰酶消化后,培养液重悬,取细胞悬液滴到的细胞爬片(铺于培养孔板中)上,30min后,添加培养液,置于孵箱(37℃、5% CO2饱和湿度)中培养6h,然后用烟曲霉菌孢子刺激HPMVECs,PBS清洗,多聚甲醛(4%)于室温固定1.5h,PBS清洗,与罗丹明-鬼笔环肽孵育(室温)30min,取出细胞爬片,PBS漂洗,用4′,6-二脒基-2-苯基吲哚染色,PBS漂洗,后封片剂封片(有细胞一面对着载玻片),用激光共聚焦扫描显微镜观察并拍照。使用Image J测量荧光强度。
1.5 细胞跨膜电阻测定
细胞跨膜电阻值(transepithelial electrical resist-ance, TER)反映溶质离子电流的强弱,与细胞通透性呈反比,可用于反映细胞通透性。将HPMVECs接种于基质胶包被的Transwell小室,上、下室分别加入250、750μL培养液,HPMVECs达单层融合后,设置空白对照组(Con)、AF处理组(AF,MOI: 1∶8)、TNF-α(20ng/mL)处理组(TNF-α)、AF+SB203580(20μmol/L)处理组(AF+SB203580)、AF+Y27632(20μmol/L)处理组(AF+Y27632)以及AF+LY317615(10μmol/L)处理组(AF+LY317615),其中TNF-α组为阳性对照组。将跨膜电阻测定仪调至欧姆档,2个电极分别于置于Transwell小室表面和下室固定位置,于4、8、16、24h测量各组电阻,并测未接种HPMVECs的小室的电阻,每室重复3次,计算公式为TER=(测得电阻值-空白电阻值)×Transwell小室的底面积,单位为: Ωcm2。
1.6 统计学处理
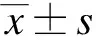
2 结 果
2.1 激光共聚焦扫描显微镜观检测HPMVECs
罗丹明-鬼笔环肽与胞质内肌动蛋白(F-actin)结合而发红光,DAPI与细胞核结合发蓝光。激光共聚焦扫描显微镜显示,HPMVECs与烟曲霉共培养至8h,与对照组相比较,烟曲霉组HPMVECs数量减少,细胞F-actin明显减少,应力纤维排列紊乱或部分消失,细胞间的连接缝隙增大或中断,见图1。细胞F-actin反映细胞骨架的改变,进而反映细胞的通透性,对F-actin染色荧光强度的统计学分析显示,AF处理后F-actin染色的荧光强度显著下降(P<0.01),表明AF处理后引起HPMVECs的通透性增加,见图2。

图1 激光共聚焦扫描显微镜检测HPMVECsFig.1 Detection of human pulmonary microvascular endothelial cells with confocal laser scanning microscopy
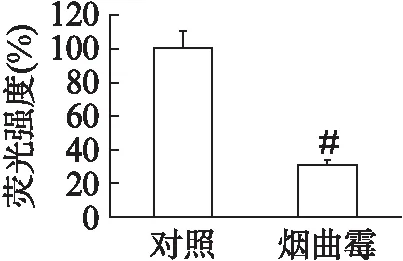
图2 烟曲霉处理对HPMVECs F-actin表达的影响Fig.2 Effect of Aspergillus fumigatus on F-actin in human pulmonary microvascular endothelial cells与对照组比较,#P<0.01
2.2 细胞跨膜电阻的检测
在4h时,空白对照组、AF组、TNF-α阳性对照组、AF+SB203580组、AF+Y27632组以及AF+LY317615组各组间跨膜电阻值差异无统计学意义(P>0.05);8h时,与空白对照组比较,AF组和TNF-α组的跨膜电阻值均出现显著下降(P<0.01),与AF组比较,AF+SB203580组、AF+Y27632组以及AF+LY317615组的跨膜电阻值均显著上升(P<0.05),上述改变一直持续到24h,见图3。
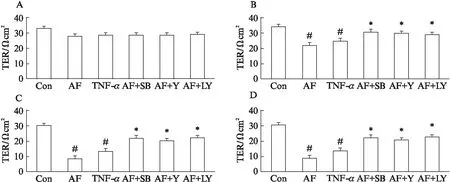
图3 HPMVECs跨膜电阻的检测Fig.3 Detection of transepithelial electrical resistance in human pulmonary microvascular endothelial cells与对照组比较,#P<0.01,;与烟曲霉组比较,*P<0.05;Con: 对照,SB: SB203580,Y: Y27632,LY: LY317615,AF: 烟曲霉,TER: 内皮细胞细胞跨膜电阻;A、B、C、D分别为试验后4、8、16、24h
3 讨 论
细胞骨架在维持细胞的形态和结构的完整性方面起着重要作用,负责执行和协助完成多种细胞功能。微丝是细胞骨架的组成成分,微丝主要由F-actin等组成,具可收缩性的特点。当细胞受到异常刺激时,F-actin会发生重组和再分布,细胞中央出现大量呈束状密集排列的应力纤维,导致细胞中心张力增高,加速细胞收缩,引起凋亡坏死,最终导致细胞通透性增高。TER是评价紧密连接蛋白完整性的指标之一,常用于反映细胞通透性。一般而言,微血管内皮细胞的通透性与细胞跨膜电阻的变化成反比,即细胞跨膜电阻升高则细胞通透性降低,细胞跨膜电阻降低则细胞通透性升高。因此,TER的测量可反映微血管内皮细胞的通透性。本研究观察到,烟曲霉处理后PMVECs F-actin染色的荧光强度显著下降(P<0.01),烟曲霉处理组也出现细胞跨膜电阻值的显著下降(P<0.01)。以上结果表明,烟曲霉感染PMVECs导致其通透性升高。
本研究进一步探讨了烟曲霉致PMVECs通透性升高的机制。与单独烟曲霉处理组比较,SB203580(20μmol/L, p38 MAPK抑制剂)干预组、Y27632(20μmol/L, ROCK抑制剂)干预组以及LY317615(10μmol/L,蛋白激酶C抑制剂)干预组的跨膜电阻值均显著上升(P<0.05)。有丝分裂原激活的蛋白激酶(mitogen activated protein kinases, MAPK)信号通路是真核细胞内最普遍的信号调节机制之一。MAPK信号通路参与调节细胞骨架的聚合及稳定性,并且影响相关的细胞活动,如细胞分裂、细胞黏附、迁移等。迄今为止,在哺乳动物内已发现多种MAPK家族亚群,如细胞外信号调节蛋白激酶(extracellular signal-regulated protein kinase, ERK)通路、c-jun氨基末端激酶(c-jun N-terminal kinase, JNK)通路,p38 MAPK通路等。有研究[12]表明,p38 MAPK通路激活后引起微丝重排及相关细胞形态的改变,p38 MAPK激酶还可通过影响微丝的完整性及稳定性调节细胞的凋亡或再分化等[13]。本研究结果表明,p38 MAPK信号通路可能参与烟曲霉致PMVECs通透性的改变,也提示p38 MAPK有可能成为烟曲霉感染的潜在治疗靶点之一。ROCK属于丝氨酸/苏氨酸蛋白激酶家族成员,是小G蛋白家族成员Rho A的下游靶效应分子。Rho A/ROCK信号通路是体内普遍存在的一条信号通路,此通路可能通过一个复杂的磷酸化/脱磷酸化级联反应调节微丝骨架的聚合,控制微血管内皮细胞的诸多生物学行为,是内皮功能调节的重要信号分子[14-15]。本研究结果也表明,ROCK信号通路可能参与烟曲霉致PMVECs通透性的改变,据此推测,ROCK信号通路可能是烟曲霉感染介导的PMVECs功能损伤的重要调控靶位之一。本研究还表明,PKC信号通路可能参与烟曲霉致PMVECs通透性的改变。蛋白激酶C(PKC)也属于丝氨酸/苏氨酸蛋白激酶家族,是细胞内的重要信号转导分子,它的激活是导致内皮细胞功能紊乱的关键因素之一[16-17]。关于血管内皮屏障功能障碍的研究显示,肌球蛋白轻链(myosin light chain, MLC)磷酸化可引起细胞骨架重组。肌球蛋白轻链激酶(myosin light chain kinase, MLCK)和Rho激酶对MLC磷酸化水平的调节作用在细胞骨架重组起重要作用,而PKC也是MLCK的上游激活分子之一。据此推测,PKC通路通过维持MLC磷酸化水平,从而促发肌动-肌球蛋白丝收缩,进而引起内皮细胞骨架结构和收缩状态的改变,最终导致内皮细胞通透性的改变。因此,PKC通路可能是介导烟曲霉改变HPMVECs通透性的信号途径之一。
综上所述,本研究结果显示,烟曲霉处理致PMVECs通透性增加,其机制可能涉及p38 MAPK、ROCK激酶以及蛋白激酶C通路,有必要开展进一步的深入研究以揭示更加精确的机制。

