磷脂酶D1对胰腺癌细胞增殖的影响
饶倩雯, 王 菲, 宋美怡, 杨长青
(同济大学附属同济医院消化内科,上海 200065)
胰腺癌是一种复杂的、具有遗传倾向性、致死率很高的疾病。手术是胰腺癌治疗的最佳选择,但诊断明确时,大部分已经为晚期,丧失手术机会;因此,胰腺癌的5年生存率不足8%。目前,胰腺癌仍旧缺乏有效的治疗措施,迫切需要深入探索其分子发病机制[1-3]。磷脂酶D(phospholipase D, PLD)能水解磷脂酰胆碱生成磷脂酸和胆碱。磷脂酰胆碱是细胞膜的主要脂类成分。磷脂酸可以影响多种生理功能,包括细胞增殖[4-6]、迁移和侵袭[7-10]等。目前人类已经发现并克隆出2种PLD同工酶,即PLD1和PLD2。研究发现,抑制PLD1能抑制肝癌细胞的增殖、细胞周期进展、迁移和侵袭[11]。但是PLD1在胰腺癌中的作用尚不清楚,因此本研究拟探索PLD1在胰腺癌中的作用。
1 材料和方法
1.1 试剂
RPMI-1640培养基购自Corning公司;胎牛血清购自HyClone公司;0.25%胰蛋白酶购自Gibco公司;PBS购自凯基生物技术股份有限公司;PLD抑制剂FIPI(3600/10)、PLD1抑制剂VU 0155069(3575/10)、PLD2抑制剂VU0364739(4171/10)购自Tocris公司;PI购自Sigma公司;PLD1过表达质粒(#45268)购自Addgene公司;PLD1 siRNA、对照siRNA、EdU染色试剂盒购自广州锐博公司;CCK-8试剂盒购自同仁化学研究所;反转录试剂盒、SBYR Green Mix购自TaKaRa公司,PCR引物购自生工生物工程(上海)股份有限公司;无水乙醇购自国药集团;LipofectamineTM2000购自Invitrogen公司。
1.2 细胞培养
胰腺癌细胞(Capan-2)购自中国科学院细胞库。Capan-2细胞用含10%胎牛血清和1%的青霉素-链霉素的1640培养基培养,培养箱(Thermo)条件为37℃、5% CO2,细胞经检测无支原体污染。
1.3 细胞加药处理
将Capan-2细胞按需接种在6孔板或96孔板中。用DMSO配置PLD抑制剂FIPI、PLD1抑制剂VU 0155069、PLD2抑制剂VU0364739储存液,浓度分别为500、100、100μmol/L,用不含血清的培养液稀释3种储液至终浓度分别为500、100、100nmol/L的药液,对照组加入等浓度的DMSO,继续培养24h后进行后续实验。
1.4 PLD1过表达质粒和PLD1 siRNA转染
使用LipofectamineTM2000向Capan-2细胞转染PLD1过表达质粒或PLD1 siRNA。PLD1过表达质粒转染浓度为1.6μg/mL。PLD1 siRNA转染浓度为100nmol/L。在37℃、5% CO2培养箱中培养6h后换液,转染48h后收细胞。
1.5 细胞增殖活力检测(CCK-8法)
取Capan-2细胞1.5×105个/mL,接种在96孔板中,细胞处理终点每孔加入10μL CCK-8试剂,轻轻摇匀后放入培养箱继续培养2h。之后用酶标仪(Bio-Rad)检测,读取波长为450nm处的吸光度值(A450),计算细胞活力。
1.6 细胞增殖检测(EdU荧光染色法)
取对数生长期Capan-2细胞,以1.5×105个/mL的密度将细胞接种在96孔板中,进行相应处理,实验终点前6h加入5-乙炔基-2-脱氧尿苷(5-ethynyl-2′-deoxyuridine, EdU)孵育,结束后用4%多聚甲醛固定30min,甘氨酸中和多聚甲醛后用0.5% Triton X-100破膜15min。之后每孔加入配制好的1×Apollo染色反应液,室温避光孵育30min,PBS清洗后每孔加入1×Hoechst33342反应液30min,PBS清洗后于倒置荧光显微镜下观察并采集图像。使用软件Image J统计EdU阳性细胞数量和DAPI标记的细胞数量,两者比值即为增殖率。
1.7 细胞周期的测定(流式细胞仪)
Capan-2细胞以1.5×105个/mL的密度将细胞接种在6孔板中,进行相应处理,实验终点弃培养基后胰酶消化收集细胞悬液,离心半径3cm,1200r/min,离心5min,用PBS轻轻吹打重悬细胞,逐滴滴入预冷的无水乙醇,边滴边轻轻震荡,之后置于-20℃冰箱固定过夜。次日取出细胞,加入培养基后,离心半径3cm,1000r/min,离心5min后取细胞沉淀,PBS清洗后根据细胞量每管加适量染液(1ml 染液由2μL Triton X-100、20μg PI和200μg RNaseA配制而成),避光15min后使用流式细胞仪(Beckman)进行周期检测,每个样品收集检测10000个细胞,采用Flow Jo软件进行统计。
1.8 荧光定量PCR
使用TRIzol法提取细胞中总RNA。之后再用Bio-Rad cDNA合成试剂盒合成cDNA。荧光定量PCR反应体系为SYBR®Green 4.5μL,PCR正向引物(5nmol/L)1μL,PCR反向引物(5nmol/L) 1μL,去核酸酶水2.5μL,反转录产物1μL。反应条件为95℃ 3min预变性,95℃ 15s,60℃ 30s,72℃ 30s,经历40个循环,使用荧光定量PCR仪进行检测。运用2-ΔΔCt进行计算相对表达量。内参GAPDH正向引物为5′-GGGGCTCTC-CAGAACATCATCC-3′,反向引物为5′-ACGCCTG-CTTCACCACCTCTT-3′;PLD1正向引物为5′-GAGCCACGGGTAAATACCT-CT-3′,反向引物为5′-CCGCGTGTCCAGATTTTCT-ATG-3′。
1.9 统计学处理

2 结 果
2.1 抑制PLD1活性对胰腺癌细胞增殖的影响
CCK-8法结果显示,PLD抑制剂组和PLD1抑制组Capan-2细胞活力均明显下降(P值分别为0.004、0.044),而PLD2抑制剂组细胞活力没有显著变化(P=0.945);并且PLD抑制剂组和PLD1抑制剂组细胞活力没有显著性差异(P=0.072),见图1。推测抑制PLD活性可以降低胰腺癌细胞活力,该作用主要是通过抑制PLD1,而不是抑制PLD2。

图1 PLD、PLD1、PLD2抑制剂处理后Capan-2细胞活力Fig.1 The cell viability of Capan-2 cells treated with the PLD, PLD1 and PLD2 inhibitor与对照组相比,*P<0.05,**P<0.01;n=9
EdU荧光染色法结果显示,PLD抑制剂组和PLD1抑制剂组的EdU阳性细胞比例均显著减少(P值分别为0.002、0.017),即细胞增殖率均显著降低;并且PLD抑制剂组和PLD1抑制剂组没有显著差异(P=0.98),见图2。这说明抑制PLD1的活性可以显著降低胰腺癌细胞的增殖能力。
流式细胞术检测结果显示,PLD抑制剂和PLD1抑制剂处理后处于S期的细胞比例均显著减少(P值分别为0.0001、0.0009),但这2组G1期的细胞都明显增多(P值分别为0.00001、0.0004),见图3。这说明PLD抑制剂和PLD1抑制剂可以使Capan-2细胞更多地停滞在G1期,阻止其进入S期,即DNA合成期,从而影响细胞增殖。
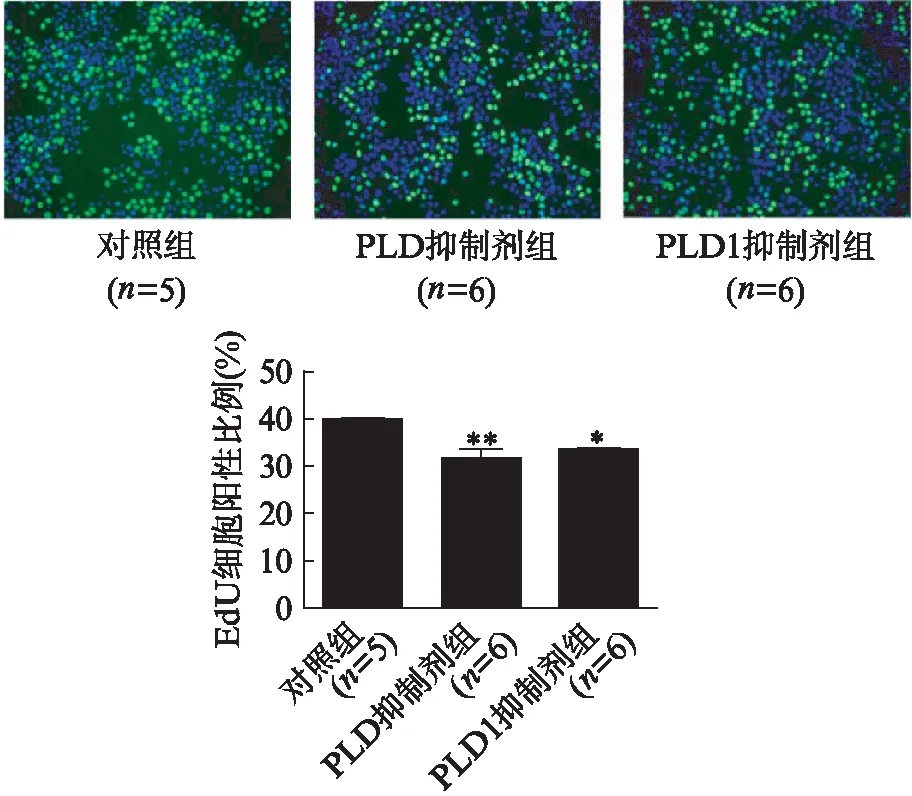
图2 PLD、PLD1抑制剂处理后Capan-2细胞增殖情况Fig.2 The proliferation of Capan-2 cells treated with PLD and PLD1 inhibitor与对照组相比,*P<0.05,**P<0.01
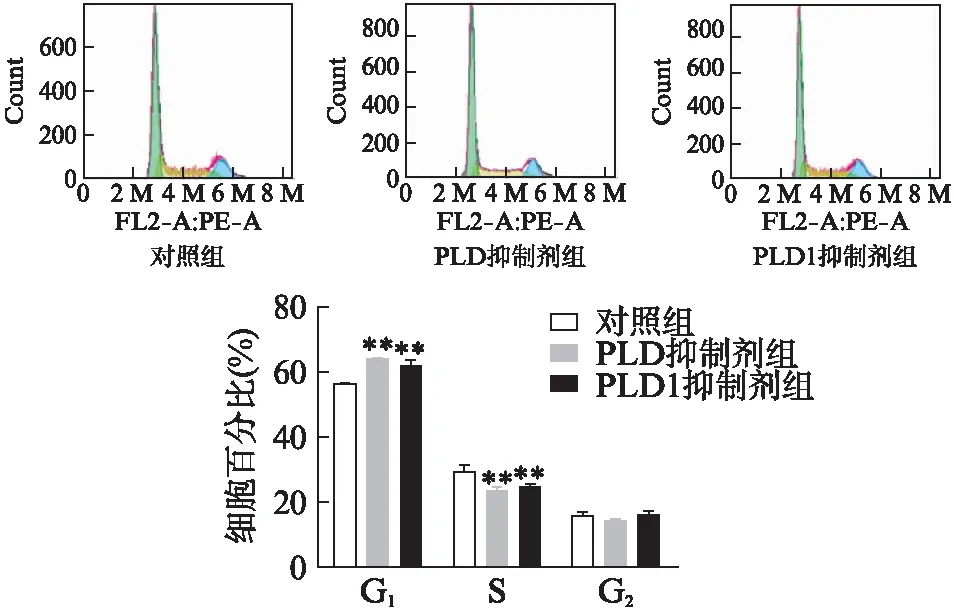
图3 PLD、PLD1抑制剂处理Capan-2细胞周期变化Fig.3 The change of cell cycle of Capan-2 cells treated with PLD and PLD1 inhibitor与对照组相比,*P<0.05,**P<0.01;n=5
2.2 抑制PLD1表达对胰腺癌细胞增殖的影响
荧光定量PCR证实,转染PLD1 siRNA后,PLD1的mRNA表达量显著降低(P=0.016),见图4;CCK-8法检测结果显示,敲低PLD1后细胞活力降低(P=0.000),见图5;EdU荧光染色发现,PLD1-siRNA组的EdU阳性细胞比例与对照组相比显著降低(P=0.002),见图6;流式细胞术检测结果显示,抑制PLD1组G1期细胞明显增多(P=0.004),S期细胞显著减少(P=0.002),见图7。

图4 转染PLD1 siRNA后PLD1 mRNA相对表达量Fig.4 The relative quantitative expression of PLD1 mRNA in Capan-2 cells transfected with PLD1 siRNA与对照组相比,*P<0.05;n=4

图5 PLD1 siRNA处理后Capan-2细胞活力Fig.5 The cell viability of Capan-2 cells treated with PLD1 siRNA与对照组相比,**P<0.01;n=7

图6 PLD1 siRNA处理后Capan-2细胞增殖情况Fig.6 The proliferation of Capan-2 cells treated with PLD1 siRNA与对照组相比,**P<0.01;n=6
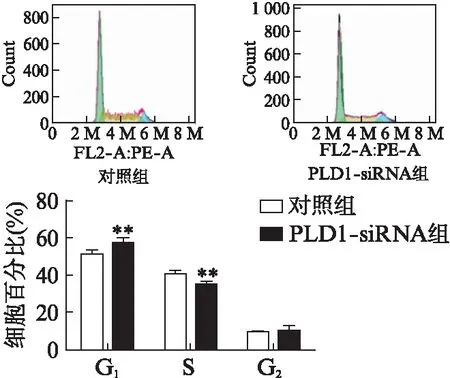
图7 PLD1 siRNA处理后Capan-2细胞周期变化Fig.7 The change of cell cycle of Capan-2 cells treated with PLD1 siRNA与对照组相比,**P<0.01;n=5
2.3 过表达PLD1对胰腺癌细胞增殖的影响
荧光定量PCR证实,转染PLD1过表达质粒后,PLD1的表达量显著上调(P=0.0014),见图8;CCK-8法检测发现,PLD1过表达组细胞活力明显增强(P=0.004),见图9;EdU荧光染色法显示,过表达PLD1后EdU阳性细胞比例增加(P=0.002),见图10;流式细胞术检测提示,PLD1过表达组G1期细胞明显减少(P=0.0004),而S期细胞显著增多(P=0.035);PLD1过表达能促进细胞从G1进入S期,进而影响胰腺癌细胞的增殖,见图11。

图8 转染PLD1过表达质粒后PLD1 mRNA相对表达量Fig.8 The relative quantitative expression of PLD1 mRNA in Capan-2 cells transfected with PLD1 plasmid与对照组相比,**P<0.01;n=6

图9 转染PLD1过表达质粒后Capan-2细胞活力Fig.9 The cell viability of Capan-2 cells after transfected with the PLD1 plasmid与对照组相比,**P<0.01;n=7
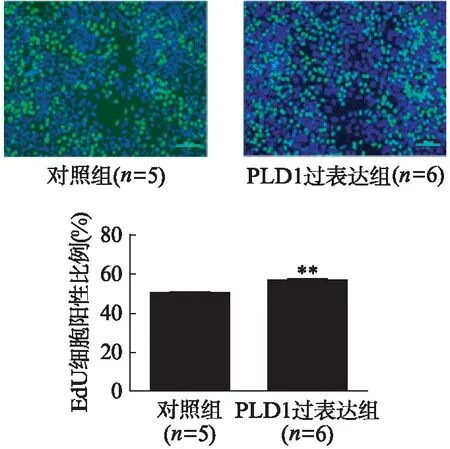
图10 转染PLD1过表达质粒后Capan-2细胞增殖情况Fig.10 The proliferation of Capan-2 cells after transfected with the PLD1 plasmid与对照组相比,**P<0.01

图11 转染PLD1过表达质粒后Capan-2细胞周期变化Fig.11 The change of cell cycle of Capan-2 cells after transfected with the PLD1 plasmid与对照组相比,*P<0.05,**P<0.01;n=5
3 讨 论
近年来,胰腺癌发病率明显升高。目前,胰腺癌治疗的主要措施是手术及术后放、化疗,但早期的诊断及手术切除率均较低。据统计,只有20%的患者适合手术切除治疗,且即使病灶切除,患者仍多死于肿瘤的复发或转移,预后极差。因此,新的治疗靶点的揭示已经成为当务之急[3,12]。
研究[13-14]发现,作为一类磷酸二酯酶,PLD广泛分布在哺乳动物多种组织中,包括大脑、小脑、心脏、肺、肝、脾、胃、胰腺、肠等。PLD及其代谢产物磷脂酸可以调控细胞内许多生理生化活动,比如PLD激活磷酯酰肌醇二磷酸PIP2、ARF和Rho,GTP酶是肌动蛋白重组和膜运输的重要调节因子,并且Rho和ARF亚家族成员在PLD激活中起着关键作用。PLD作为ARF的下游效应物,介导高尔基体囊泡的出芽,从内质网到高尔基体膜的转导,并从跨高尔基体网络释放新生分泌囊泡。同时,PLD也被证明是脂肪细胞、肥大细胞、血小板和胰腺β细胞胞吐途径的重要组成部分[15]。
PLD在肿瘤等疾病的发病中也发挥着重要作用,并且其在肿瘤中的作用及分子机制的研究已非常广泛,已证实PLD在肝癌[11],胃癌[16],肾癌[17-18],前列腺癌[19],乳腺癌[20]等肿瘤中发挥着关键的作用。研究[21-24]发现,持续的PLD激活可以导致mTOR及其下游靶基因的活化,包括和细胞生长、迁移和侵袭相关的重要信号分子S6激酶1(S6K1)或真核起始因子4E结合蛋白-1(4E-BP1)等。研究[25-26]也表明PLD能够激活Akt达到控制胶质母细胞瘤细胞生存信号以及控制EL4淋巴瘤细胞的迁移和侵袭的作用。另外前期研究发现PLD1对肝癌的调控作用是通过其下游靶基因AKT/mTOR实现的[11]。有学者指出瑞巴派特诱导的PLD的下调能够抑制胃癌细胞的炎症反应和细胞增殖,雷公藤内酯可以通过抑制PLD的表达,达到抑制乳腺癌细胞的增殖。但是PLD在胰腺癌中的作用目前尚未完全阐明。
本研究同时抑制PLD1和PLD2,发现抑制PLD对于胰腺癌细胞增殖的作用主要是通过其同工酶中的PLD1产生的,而不是PLD2。随后外源性的增加/抑制PLD1的表达,明确了PLD1参与胰腺癌细胞的增殖,同时敲低PLD1的表达对于胰腺癌细胞的增殖具有抑制作用。说明PLD1可以促进胰腺癌细胞的增殖,而干扰PLD1的表达可以作为胰腺癌的潜在治疗策略。但仍然需要进一步在细胞水平进行增殖、迁移和侵袭以及其分子机制的研究,以进一步明确PLD1与胰腺癌的关系;需要在动物体内研究PLD1对于胰腺癌的治疗价值,深入挖掘其价值,对于改善胰腺癌患者的治疗方案及预后具有重要意义。

