血清hsa-miR-486-5p在乳腺癌早期诊断中的价值
安学凤, 李姝君, 俞作仁, 韩 晶
(1. 同济大学附属东方医院乳腺外科,上海 200120; 2. 同济大学附属东方医院医学转化研究中心,上海 200120;3. 大连医科大学,大连 116023)
乳腺癌是全球女性癌症死亡的主要原因之一。2012年,调查发现乳腺癌占所有癌症病例数的25%,且15%的女性死于乳腺癌[1]。乳腺癌的早期诊断可以使患者获得更好的手术和治疗的时机,并有效延长患者的生命[2]。近年来,研究发现microRNA(miRNA)与肿瘤的发展、转移、浸润、复发以及对放化疗药物的抗性具有密切关系[3-4],其在乳腺癌患者血液中的差异性表达还可以成为早期乳腺癌检测的生物标志物[5]。但目前大多数相关研究均局限于正常人群和乳腺癌人群,并没有将两者的中间阶段(非典型增生人群)纳入研究。本研究对乳腺正常、非典型增生、原位癌、浸润癌4个阶段患者的组织和血液样本分别进行miRNA高通量测序和RT-qPCR实时定量检测,以得到与乳腺癌发生发展相关的特异性miRNA,并对其诊断早期乳腺癌的可行性进行分析研究,从而得到更能准确诊断早期乳腺癌的特异性血清miRNA。
1 材料与方法
1.1 一般资料
收集2016年11月至2017年7月,在同济大学附属东方医院治疗的4例乳腺组织样本和96例血液样本。其中正常组织取自乳腺良性病变周围组织。乳腺组织样本(1cm×1cm)均经过病理活检确诊,分别是: 乳腺正常组织、乳腺非典型增生组织、乳腺原位癌组织和乳腺浸润性癌组织。组织样本收取后立即放入EP管置于-80℃冰箱冻存直至送出进行miRNA高通量测序。
本研究中96例血液样本,包括从东方医院健康体检中心招募的24例30岁以上女性志愿者的正常对照血液样本、10例非典型增生患者血液样本、22例原位癌患者血液样本、40例浸润癌患者血液样本。本研究收集的血液标本患者年龄均在30岁以上且乳腺肿瘤淋巴结转移分期(TNM)为早期,包括乳腺原位癌、乳腺浸润性癌I、II期。术前获得乳腺疾病患者的血液样本,排除具有以下特征的患者: (1) 收集血清前接受化疗和(或)放疗;(2) 同时(或)先前诊断具有其他癌症者。控制健康志愿者的标准包括过去半年内无任何癌症或住院史。本研究由我院伦理委员会批准。
将患者的静脉血收集到含有EDTA的Vacuette血清凝块活化剂无凝胶管中,将其在冰上保存15~30min,随后在4℃离心(离心半径16cm,3000r/min,离心5min)沉淀血细胞,后将上清液分装在不含RNA的2mL试管中,各500μL,储存于-80℃直至进一步使用。
1.2 RNA的提取与反转录
根据实验方案,使用TRIzol LS试剂(英杰生命科技有限公司)从200μL血清中提取RNA,溶解于10μL焦碳酸二乙酯(DEPC)处理的水中,用于反转录反应。通过NanoDrop 2000(赛默飞世尔科技有限公司)对RNA浓度进行定量检测。RNA反转录反应如下进行: 在8μL DEPC水中溶解500ng RNA,在室温下用DNase和DNase缓冲液(默金斯生物技术有限公司)纯化15min,进而加DNase 反应终止剂(默金斯生物技术有限公司)置于70℃水浴箱中5min,终止前面反应。然后添加至终体积为14μL转录混合物,进行下列操作: 37℃水浴箱90min和95℃水浴箱5min。合成的cDNA保存在-80℃冰箱中。
1.3 目标miRNA的选择
根据乳腺癌发生发展的过程: 正常(H1)、非典型增生(H10)、原位癌(H17)、浸润癌(H18),收集了各阶段1例患者的乳腺组织。将收集4个阶段组织的EP管放入干冰盒中,送到基因测序公司进行miRNA高通量测序。
1.4 实验内参选择的理论依据
研究[6-7]证明,miR-16在乳腺癌病变组织及病变周围正常组织中表达差异无统计学意义(P>0.05),正常对照组血液样本及乳腺癌患者血液样本中均稳定表达且差异无统计学意义(P>0.05),可以成为相关研究的内参。
1.5 RT-qPCR的实时定量检测方法
使用SYBR Green荧光染料(默金斯生物技术有限公司)进行RT-qPCR定量检测miRNA,在Quant Studio 6 Flex实时定量分析PCR系统上进行分析。在含有1μL cDNA,0.5mmol/L引物和1× SYBR Green的终体积为10μL中进行反应。PCR条件如下: 首先在95℃变性10min,随后是95℃ 15s和60℃ 60s各40个循环,在此期间获得荧光。熔解曲线从60~95℃获得。使用以下公式计算倍数变化: RQ=2-ΔΔCt,其中ΔΔCt=(CtmiRNA-CtmiR16)疾病组-(CtmiRNA-CtmiR16)对照组平均值。Ct值>38则认为是不可能的扩增并弃掉。
1.6 目标miRNA在血清分析时的分组
由于高通量测序的组织样本较少且来自不同个体,所得结果具有一定的不准确性和个体差异性的偏倚可能,因此应用大量血清样本进行目标miRNA在乳腺癌发生发展中变化趋势的验证,以得到较为准确的结果。应用公式计算出目标miRNA的RQ值。每种目标miRNA的RQ值分为正常组、非典型增生组、原位癌组和浸润癌组,进行独立样本Kruskal-Wallist检验。
对在组织和血清中变化趋势相似的miRNA的RQ值进一步分组,正常组和早期乳腺癌组(原位癌,Ⅰ期、Ⅱ期浸润癌)并进行Mann-WhitneyU检验。
1.7 统计学处理
统计学分析使用SPSS 20.0软件,进行独立样本t检验、Mann-WhitneyU检验和Kruskal-Wallist检验。P<0.05为差异有统计学意义。
2 结 果
2.1 miR-16作为内参的实验验证
miR-16在正常对照组、非典型增生组、原位癌组和浸润癌组中的Ct值的中位数(范围)分别是: 23.78(21.98~25.95)、24.1(21.79~26.25)、23.21(21.81~26.14)和23.4(21.58~26.25),Kruskal-Wallist检验分析结果显示各组之间差异无统计学意义(P>0.05),见图1。因此,miR-16可以作为本研究的内参。
2.2 目标miRNA的选择确定
将乳腺癌发生发展的4个阶段组织送去基因测序公司进行miRNA高通量测序,并对测序结果进行分析,得到随疾病进展呈明显递减表达的6种miRNAs(hsa-miR-144-5p、hsa-miR-451a、hsa-miR-486-5p、mir-132-x、mir-486-x、mir-6510-y),见图2。其中mir-132-x、mir-486-x、mir-6510-y为鼠源性miRNA,因此不纳入研究。最终确定研究目标为hsa-miR-144-5p(miR-144)、hsa-miR-451a(miR-451a)和hsa-miR-486-5p(miR-486)。

图1 miR-16在4组中的Ct值Fig.1 The value of miR-16 in healthy control,atypical hyperplasia, carcinoma in situ and invasive breast cancer groups

图2 miRNA高通量测序分析结果热图Fig.2 The heat map of miRNA high-throughput sequencing analysisH1为乳腺正常组织,H10为乳腺非典型增生组织,H17为乳腺原位癌组织,H18为乳腺浸润性癌组织
2.3 目标miRNA在血清中的表达
将高通量测序所得的目标miRNA(miR-144、miR-451a和miR-486)进行血清RT-qPCR的检测分析。统计学分析结果显示miR-144和miR-451a差异均无统计学意义且表达趋势无规律(P>0.05),仅miR-486差异有统计学意义(P<0.05)。miR-486在4个阶段患者血清中的表达不仅有统计学差异,同时其表达的趋势与高通量测序结果相近即随疾病的进展逐渐降低,见图3。因此,miR-486与乳腺癌的发生发展具有密切相关性。

图3 血清miR-486在4组中的表达Fig.3 Comparison of miR-486 expression levels in four groups
2.4 血清miR-486诊断早期乳腺癌的可行性分析
与正常对照组相比,早期乳腺癌组血清miR-486的检测分析结果差异有统计学意义(P<0.01),见图4A。绘制ROC曲线检验所得统计学差异性结果的准确性,分析结果显示: cut-off值为0.528,AUC值为81.2%,95%CI为0.707~0.917,灵敏度和特异度分别为62.5%和90.3%,见图4B。以上结果显示,血清miR-486可以准确地诊断早期乳腺癌并具有较高的灵敏度和特异度。

图4 血清miR-486诊断早期乳腺癌的可行性Fig.4 The feasibility of serum miR-486 in diagnosing early-stage breast cancerA: 血清miR-486在健康组与早期乳腺癌组中的表达; B: 诊断早期乳腺癌的ROC曲线图
2.5 miR-486在乳腺癌不同亚型中的表达
临床上根据雌激素受体(estrogen receptor, ER)、孕激素受体(progesterone receptor, PR)、人表皮生长因子受体2(human epidermal growth factor receptor 2, Her2)、人表皮生长因子受体(epithelial growth factor receptor, EGFR)以及Ki67将乳腺癌分为4个亚型,见表1。本研究将miR-486的RQ值分为Luminal A组、Luminal B组、Her2过表达组以及基底型组并进行统计学分析,以便检测miR-486与乳腺癌亚型之间的关系,结果显示各组之间并无统计学差异(P>0.05),见图5。
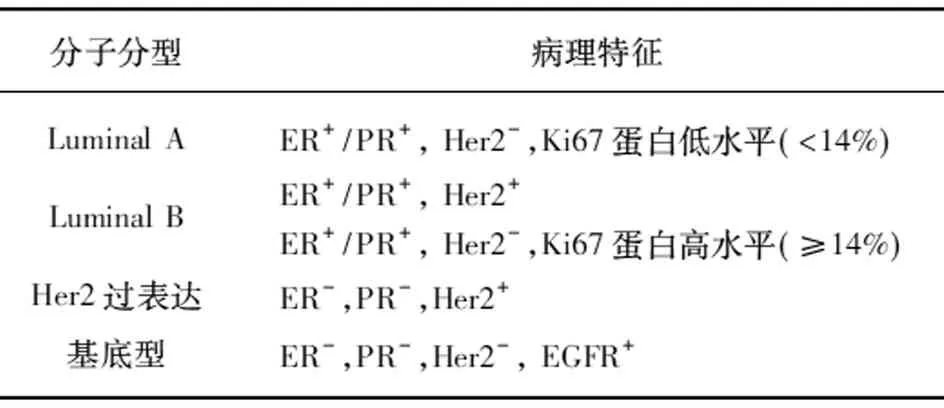
表1 乳腺癌临床分子分型

图5 血清miR-486在乳腺癌4种亚型中的表达Fig.5 The expression of serum miR-486 in different breast cancer subtypes patients
3 讨 论
乳腺癌目前公认的发病机制为“多阶段发展模式学说”,即乳腺癌的发生发展过程是: 乳腺正常组织、乳腺非典型增生、乳腺原位癌、乳腺浸润性癌[8],而此发展过程的机制目前尚不明确。虽然乳腺非典型增生是从正常组织到恶性改变的中间阶段,是由量变到质变的关键点,但从治疗上来说,非典型增生只需要局部手术、术后随访即可;早期乳腺癌和中晚期乳腺癌患者在治疗上也存在较大的差异性,前者的手术范围更小且可以根据患者情况选择性进行保乳手术,并且总生存期和无进展生存期延长,患者的生活质量更高。因此,乳腺癌早期甚至其癌前病变的诊断具有重要的临床意义。
miRNA是一种与肿瘤特异性表达相关的非编码小RNA,有19~25个核苷酸序列,通过靶向mRNA的3′非翻译区(3′UTR)导致mRNA降解或抑制其翻译来调节基因表达。研究发现,某些特定的miRNA可以从癌症组织中释放进入血液循环系统,并且在目前尚未明确的机制下被保护免于内源性RNA酶水解,进而在血液中可以稳定地表达,是诊断癌症的潜在生物标志物[9]。近年研究发现,多种血清miRNAs在正常人群与乳腺癌患者血清或组织中表达存在差异性,可作为诊断早期乳腺癌的生物标志物[10-12]。然而,目前几乎所有与血清miRNA诊断早期乳腺癌相关的研究均局限于正常人群和乳腺癌人群,并没有将血清miRNA与乳腺癌发生发展过程紧密相连而进行研究。因此,实验所得的早期乳腺癌诊断相关的血清miRNA较为广泛,不具有特异性。
本试是首个将乳腺癌发生发展的4个阶段(正常、非典型增生、原位癌、浸润癌)均纳入为研究对象的研究。其中,由于乳腺非典型增生的发病率低(3%~4%)[13],影像学诊断无法与乳腺良性肿瘤区分,造成多数患者在就诊时已发展到乳腺癌阶段;因此,临床样本的收集较困难,仅获得10例血液样本。通过对4个阶段组织进行miRNA高通量测序和对24例正常、10例非典型增生、22例原位癌以及40例早期乳腺癌患者血清进行RT-qPCR检测分析,最后获得miR-486与乳腺癌的发生发展最为密切的证据。虽然RT-qPCR的分析结果显示,血清miR-486在正常对照组与其在乳腺非典型增生组的表达差异无统计学意义(P>0.05),但仍可以看出其在组织和血液中均随疾病进展呈明显下降变化趋势。此外,对miR-486在正常人群和早期乳腺癌患者(原位癌Ⅰ、Ⅱ期)血清表达量的统计学分析结果显示,其在早期乳腺癌患者血清中呈显著低表达并与正常对照差异有统计学意义(P<0.01),而在不同分子分型乳腺癌中的差异无统计学意义(P>0.05);ROC曲线分析结果显示,AUC值为81.2%(95%CI=0.707~0.917),以及其诊断早期乳腺癌的灵敏度和特异度分别高达62.5%和90.3%。过表达的miR-486可通过靶向癌基因PIM-1显著抑制乳腺癌细胞的增殖,诱导G0/G1停滞并促进癌细胞凋亡[14]。在MCF-7乳腺癌细胞中,miR-486的高表达可以有效调节Smad2,抑制上皮间充质转化(epithelial-mesenchymal transition, EMT)的发生,进而达到降低乳腺癌细胞转移和侵袭的能力[15]。因此推断,miR-486在乳腺癌中可能发挥着抑癌基因的作用,不仅可以作为诊断早期乳腺癌的生物标志物,还可能成为治疗乳腺癌的一个新靶点。
关于miR-486在其他肿瘤的功能,研究[16]表明: miR-486通过靶向胰岛素生长因子(insulin growth factor, IGF)信号转导的成分,包括IGF1、IGF1受体(IGF1R)和磷酸肌醇-3-激酶,调节亚基1(alpha)等,在非小细胞肺癌中发挥着抑癌基因的作用;同时ANK1的甲基化可以降低miR-486在非小细胞肺癌中的表达[17],其在血清中的低表达可以作为非小细胞肺癌的诊断标志物[18];过表达的miR-486可以通过靶向PIK3R1和刺激磷脂酰肌醇3-激酶-AKT活化抑制肝细胞癌的进展[19],并增加肝细胞癌对于化疗药物的敏感性[20];同样,miR-486也可以抑制结直肠癌[21]、骨癌[22-23]和食管癌[24]细胞的增殖、迁移和浸润。值得注意的是: miR-486在慢性粒细胞白血病中却呈上调状态,通过抑制miR-486的表达可以有效减缓慢性粒细胞白血病祖细胞的生长和促进癌细胞的凋亡[25];在前列腺癌中,miR-486通过直接靶向多种负调控因子(PTEN/P13K/Akt/,FOXO)驱动肿瘤的发展[26]。由此可见,miR-486在不同肿瘤中发挥着差异性的作用(抑癌作用或促癌作用),可以为癌症的特异性诊断和治疗提供新思路。
本研究还具有一定的不足之处: 组织及血液样本的收集还需要进一步的完善,并应加强乳腺非典型增生样本量的收集。接下来的研究则会收集大量组织及血液样本进行RT-qPCR,以进一步验证分析结果,并对miR-486在乳腺癌发生发展过程中的作用机制进行研究。
综上所述,miR-486在乳腺癌发生发展的过程中呈逐渐下调趋势,并且其在早期乳腺癌患者的血清中呈显著的低表达,可以作为特异性诊断早期乳腺癌的生物标志物。

