高温干旱双重胁迫下水稻灌浆结实期的光合生理变化
高焕晔,宗学凤,吕 俊,徐 宇,何秀娟,董玉锋,张 燕,王三根*
(1.贵州大学 烟草学院,贵阳 550025;2.西南大学 农学与生物科技学院/三峡库区生态农业与可持续发展研究重点实验室,重庆 400716)
绿色植物有机物90%以上来自光合作用,因此作物的产量特别是生育后期的产量与其光合特性关系极其密切。非生物逆境,尤其是高温和干旱是影响作物优质高产低耗的重要限制因素,高温伏旱是造成我国南方各地水稻(Oryza sativaL.)品质下降和减产的重要灾害[1-2]。
有关单一温度与水分胁迫对水稻的影响已有很多研究。但水稻灌浆结实期经常遭遇高温伏旱并非单一的高温或干旱胁迫,而是高温与干旱的复合胁迫。然而,由于多重胁迫试验因素的增多,试验条件控制的难度增大以及试验规模的扩大,导致开展植物多重胁迫研究的难度相对较大,相关报道很少。高温和干旱复合胁迫对作物生长发育和产量品质的影响,已有部分研究者在少数几个作物上开展了相关研究。如Kaur等[3],戴廷波等[4]研究了高温和水分逆境复合胁迫对小麦生长与生理特性的影响。而水稻在这方面的研究罕见。在植物众多的生理过程中,光合作用是对环境高温和干旱的响应最为敏感的过程之一,在高温和干旱引起的其他胁迫症状尚未出现时,光合作用就可能已经受到抑制[5]。进行高温干旱胁迫下水稻灌浆结实期的光合生理变化研究有重要意义。
由于重庆与三峡库区水稻灌浆结实期常常遭遇高温干旱双重胁迫,导致植株生理功能异常,叶片早衰,产量和品质下降,因此开展相关光合生理特性监测,可为制订水稻抗逆的遗传育种和栽培措施提供有价值的参考资料[6-7]。
1 材料与方法
1.1 试验材料与设计
本研究模拟高温干旱逆境条件,在人工气候室采用盆栽方法进行。土壤养分含量为有机质17.21 g/kg,全氮1.09 g/kg,全磷0.81 g/kg,全钾19.75 g/kg,碱解氮71 mg/kg,有效磷15 mg/kg,有效钾160 mg/kg。温度因子设高温(日均30℃±0.5℃)和适温(日均25℃±0.5℃)两个水平;水分因子设正常供水(盆钵土面保持水层3~5 cm)、中度干旱(盆钵土壤相对含水量为50%~60%)和严重干旱(盆钵土壤相对含水量为30%~40%)三个水平。高温与干旱胁迫从齐穗开始,胁迫时间设10 d,20 d,30 d,40 d四个水平。采用整体称重法进行盆钵土壤含水量的监测,实时补水调控至设定水平。当高温胁迫完成后,盆钵即刻移入适温温室;干旱胁迫结束后,立即对盆钵进行复水处理。试验材料为水稻品系H5,实验地点在西南大学。
以适温-正常供水[Optimal temperature,Wellwatered,OT-WW(CK)]为对照组;考查适温-中度 干旱 (Optimal temperature,Moderate drought,OT-MD);适温-重度干旱(Optimal temperature,Severe drought,OT-SD);高温-正常供水(High temperature,Well-watered,HT-WW);高温-中度干旱 (High temperature,Moderate drought,HTMD);高温-重度干旱(High temperature,Severe drought,HT-SD)这五种处理条件下的变化。
1.2 测定方法
叶绿素含量测定:将所测定叶片洗净,去掉较粗主脉,剪成4~8 mm小叶条,混匀,称取0.1 g放入20 mL具塞试管,加入10 mL 95%乙醇直接浸提叶绿体色素8~12 h,其间振荡2~3次,直至小叶条全部变白为止。摇匀提取液,吸取1 mL于光径1 cm的比色杯中,加入2 mL 95%乙醇稀释,摇匀后立即进行比色,读取665 nm、649 nm、470 nm下的吸光度。以95%乙醇为空白调零。计算光合色素含量[8]。
光合指标测定:从灌浆结实期高温干旱双重胁迫的当天开始,根据试验设计的胁迫天数,选取各处理剑叶的中部位置进行测量,重复测定3~4次。测定仪器为LI-6400便携式光合作用测量系统(LI-COR Inc,USA),叶室为红蓝光源叶室,测定条件为CO2浓度400 µL/L,光强为1 200 µmol/(m2·s)。测定指标包括净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)以及胞间CO2浓度(Ci)[9]。
1.3 数据处理与分析
用Microsoft Office Excel进行数据整理,用DPS统计分析软件进行数据分析。
2 结果与分析
2.1 灌浆结实期高温与干旱胁迫对水稻叶绿素a含量的影响
图1表明,在适温-正常供水的情况下,水稻叶绿素a含量呈缓慢下降趋势。与OT-WW(CK)相比,灌浆结实期高温与干旱双重胁迫导致了水稻叶绿素a含量先上升后下降,特别是HT-MD胁迫10 d时上升到最高值,之后又急剧下降到最低值。叶绿素a含量总体上以OT-MD胁迫处理最高,以HT-WW处理最低。也就是说,在适温条件下,适当的干旱胁迫反而有利于叶绿素a含量的升高。方差分析结果见表1。
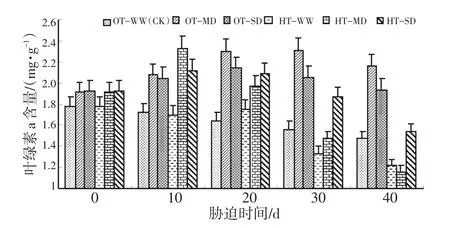
图1 灌浆结实期高温与干旱胁迫下水稻叶绿素a含量的动态变化Fig.1 Dynamic change of chlorophyll a content during grain filling stage of rice under high temperature and drought stress

表1 灌浆结实期高温与干旱胁迫对水稻叶绿素a含量的差异显著性Table 1 Significance of chlorophyll a content under high temperature and drought stress in grain filling stage of rice
表1的方差分析结果表明,灌浆结实期高温胁迫、干旱胁迫对水稻叶绿素a含量的影响达到显著和极显著水平。高温胁迫总体上会导致水稻叶绿素a含量的降低,与适温处理相比,高温处理的叶绿素a含量的平均值降低了0.2 mg/g。与正常供水处理相比,中度干旱胁迫能导致叶绿素a的增加,增加幅度为0.36 mg/g,重度干旱胁迫下的叶绿素a含量与中度干旱下的接近。
2.2 灌浆结实期高温与干旱胁迫对水稻叶绿素b含量的影响
图2表明,在OT-WW的情况下,水稻叶绿素b含量呈先缓慢上升后下降趋势。与对照组相比,灌浆结实期高温与干旱在初期有刺激叶绿素b升高的效应,但随着处理时间延长,叶绿素b含量开始下降,特别是OT-SD胁迫下水稻叶绿素b含量急剧下降到最低值。值得注意的是,适温和正常供水其叶绿素b含量在试验后期(40 d)大大高于其他处理。方差分析结果见表2。
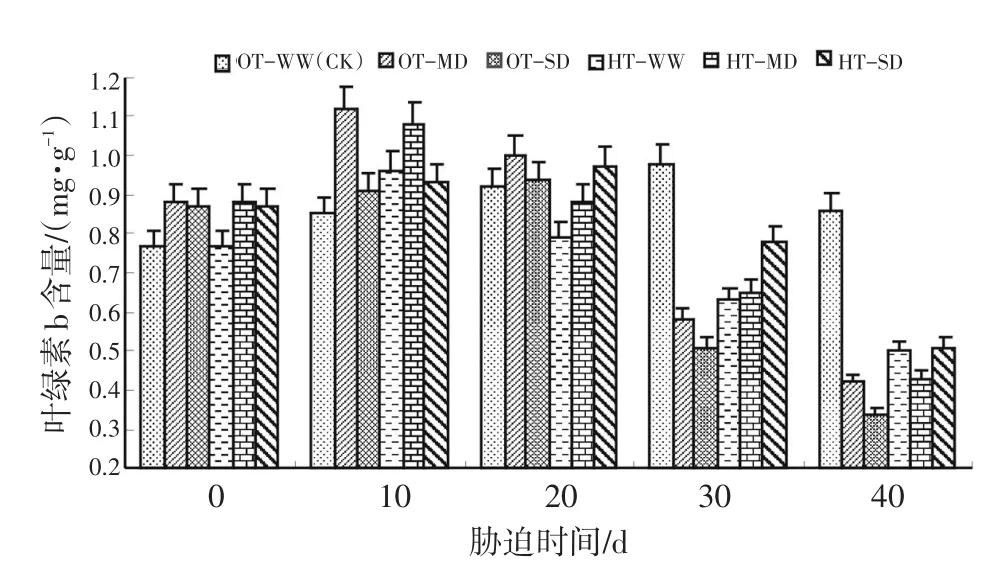
图2 灌浆结实期高温与干旱胁迫下水稻叶绿素b含量的动态变化Fig.2 Dynamic change of chlorophyll b content during grain filling stage of rice under high temperature and drought stress
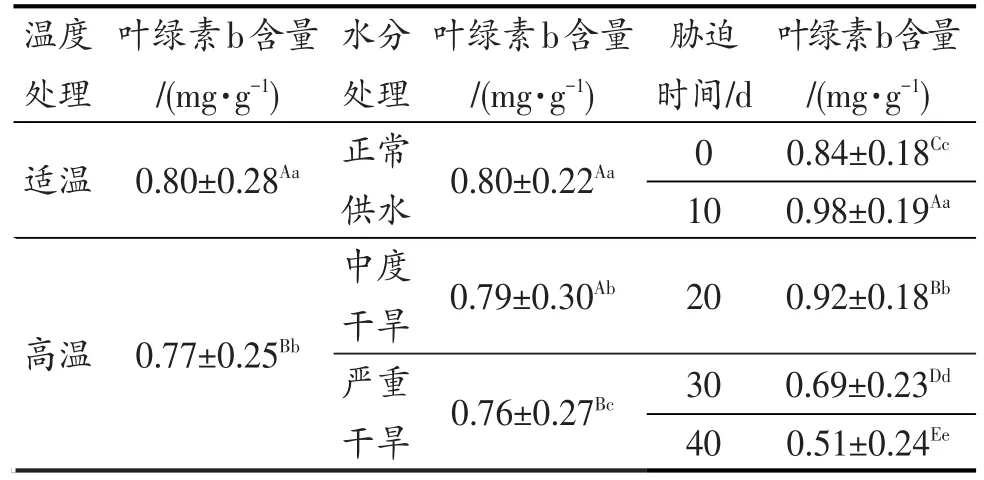
表2 灌浆结实期高温与干旱胁迫对水稻叶绿素b含量的差异显著性Table 2 Significance of chlorophyll b content under high temperature and drought stress in grain filling stage of rice
表2的方差分析结果表明,灌浆结实期高温胁迫、干旱胁迫对水稻剑叶叶绿素b含量的影响达到显著和极显著水平。且随着胁迫时间延长,这种差异更为显著。
2.3 灌浆结实期高温与干旱胁迫对水稻类胡萝卜素含量的影响
图3表明,在OT-WW的情况下,水稻类胡萝卜素含量在试验初期开始增加,但随着时间的延长,其含量呈缓慢下降趋势。与OT-WW相比,灌浆结实期高温与中度干旱双重胁迫导致了水稻类胡萝卜素含量在10 d时上升到最高值后又急剧下降。OT-SD和HT-SD胁迫下水稻类胡萝卜素含量变化较特别,在10 d时下降,在20 d时又缓慢下降。同时值得关注的是,高温与重度干旱胁迫下类胡萝卜素含量在试验后期(30~40 d)明显高于其他处理。方差分析结果见表3。
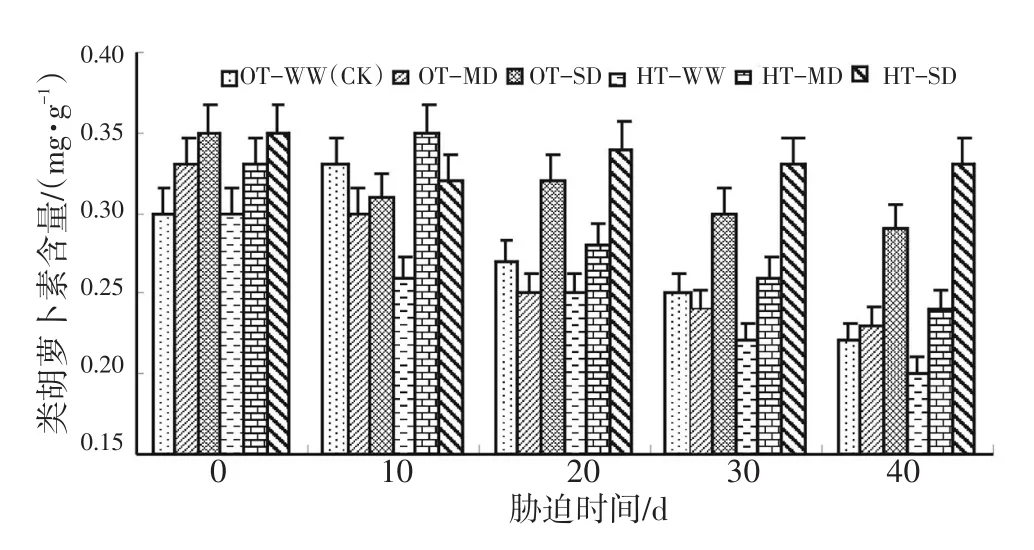
图3 灌浆结实期高温与干旱胁迫下水稻类胡萝卜素含量的动态变化Fig.3 Dynamic change of carotenoid content during grain filling stage of rice under high temperature and drought stress
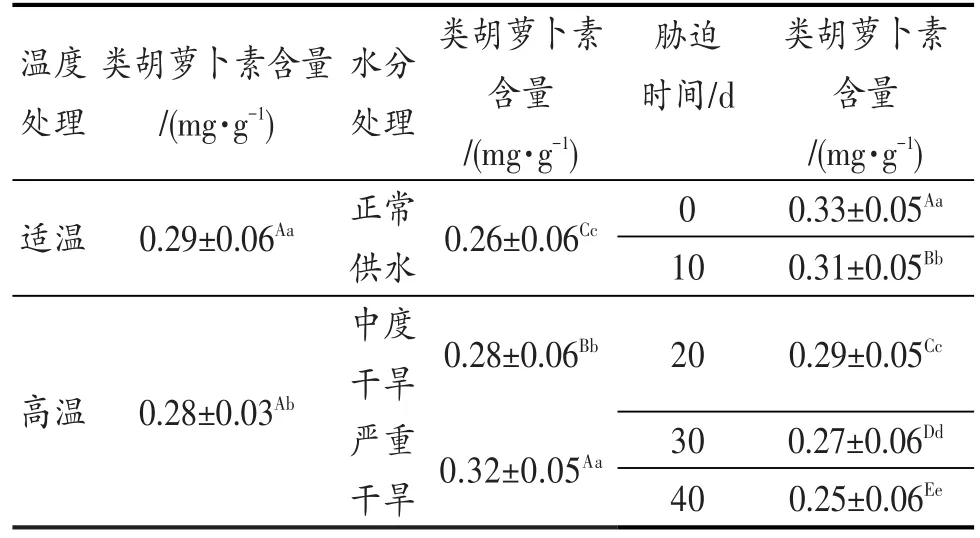
表3 灌浆结实期高温与干旱胁迫对水稻类胡萝卜素含量的差异显著性Table 3 Significance of carotenoid content under high temperature and drought stress in grain filling stage of rice
表3的方差分析结果表明,灌浆结实期高温胁迫、干旱胁迫对水稻类胡萝卜素含量的影响达到显著和极显著水平,这种变化在干旱胁迫的处理中尤为突出,并且随着胁迫时间延长,差异更甚。
2.4 灌浆结实期高温与干旱胁迫对水稻叶绿素a与叶绿素b比值的影响
图4表明,在OT-WW处理下,水稻叶绿素a/b在前10 d呈缓慢下降,10~20 d上升不明显,20 d以后急剧上升。与之相比,灌浆结实期中度干旱胁迫、高温胁迫均导致了水稻叶绿素a/b在10 d前下降,10 d后上升。特别是在中度干旱与重度干旱胁迫下,叶绿素a/b在30 d后急剧上升到较高水平。HT-MD和HT-SD双重胁迫下,水稻叶绿素a/b也有变化,但在前30 d时较平稳,在30 d后缓慢上升。图4还表明,在试验后期(30~40 d)叶绿素a/b可分为两组,其中适温处理组明显高于高温处理组。
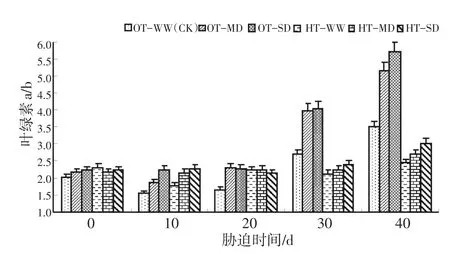
图4 灌浆结实期高温与干旱胁迫下水稻叶绿素a/b的动态变化Fig.4 Dynamic change of chlorophyll a/b during grain filling stage of rice under high temperature and drought stress
2.5 灌浆结实期高温与干旱胁迫对水稻叶绿素a+b的影响
图5表明,在OT-WW处理情况下,水稻叶绿素a+b(总叶绿素)的含量总体上是下降的。
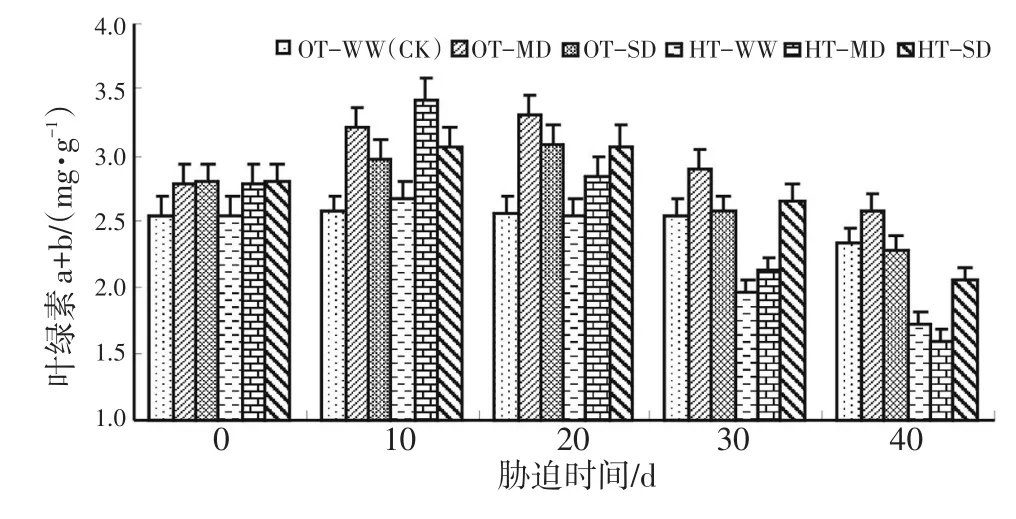
图5 灌浆结实期高温与干旱胁迫下水稻叶绿素a+b的动态变化Fig.5 Dynamic change of chlorophyll a+b content during grain fillingstageofriceunderhightemperatureanddroughtstress
HT-MD在10 d时水稻叶绿素a+b的含量上升到最高,但之后急剧下降至最低值。在中度干旱、重度干旱胁迫的前20 d水稻叶绿素a+b的含量略有上升,但在胁迫20 d后呈下降趋势,40 d时下降到最低值。
2.6 灌浆结实期高温与干旱胁迫对水稻净光合速率的影响
图6表明,在OT-WW的情况下,水稻叶片净光合速率(Pn)在胁迫的0~10 d为上升趋势,10d后则缓慢下降。HT-WW、HT-MD及HT-SD,还有OT-MD、OT-SD在胁迫0~10 d时的Pn均呈上升趋势,10~20 d急剧下降,20~30 d继续下降但幅度减小,30~40 d OT-MD、OT-SD胁迫下的Pn继续平缓下降,但HT-WW、HT-MD胁迫下的Pn则突然急剧上升。HT-SD胁迫40 d的Pn由于胁迫强度较大而未能正常测出,故柱形图上未予标出。方差分析结果见表4。
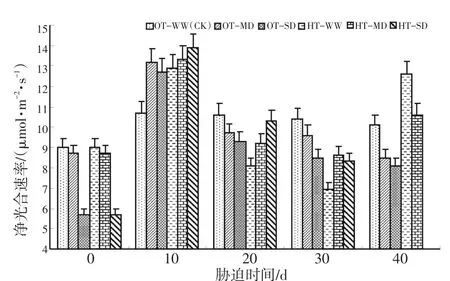
图6 灌浆结实期高温与干旱胁迫下水稻净光合速率(Pn)的动态变化Fig.6 Dynamicchangeofnetphotosyntheticrate(Pn)during grainfillingstageofriceunderhightemperatureanddroughtstress
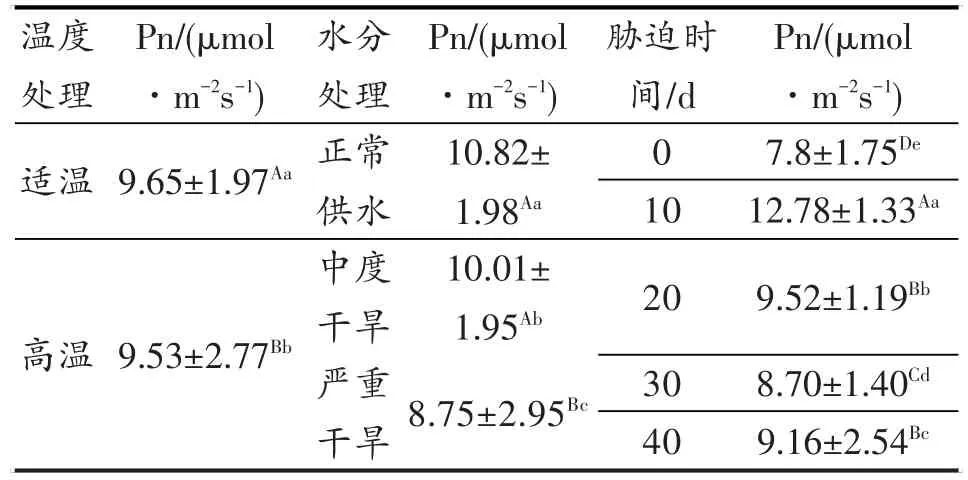
表4 灌浆结实期高温与干旱胁迫对水稻Pn的差异显著性Table 4 Significance of Pn under high temperature and drought stress in grain filling stage of rice
表4的方差分析结果表明,灌浆结实期高温胁迫、干旱胁迫对水稻叶片净光合速率(Pn)的影响达显著和极显著水平。从表4还可以看出,中度干旱对Pn的影响较小,但是在严重干旱下水稻叶片的Pn大幅度下降。
2.7 灌浆结实期高温与干旱胁迫对水稻胞间CO2浓度的影响
图7表明,包括OT-WW的对照组在内,所有处理的水稻叶片胞间CO2浓度(Ci)随着胁迫时间的延长呈下降趋势,胁迫20 d时达最低点;20~30 d时又都急剧上升,30~40 d期间,HT-WW、HT-MD继续较快上升,OT-SD平缓上升;但OT-WW、OT-MD处理的水稻叶片Ci呈下降趋势。高温与重度干旱的双重胁迫在胁迫40 d时参数因胁迫强度过大而未能正常测出,故Ci在柱形图上未予显示。方差分析结果见表5。
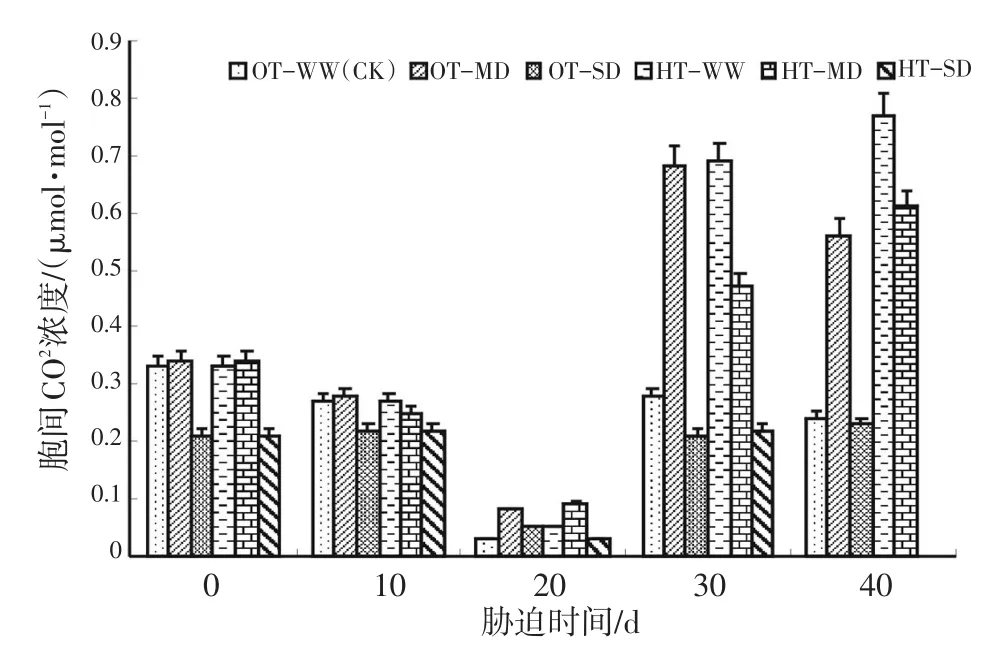
图7 灌浆结实期高温与干旱胁迫下水稻胞间CO2浓度(Ci)的动态变化Fig.7 Dynamic change of CO2concentration inside leaf(Ci)during grain filling stage of rice under high temperature and drought stress
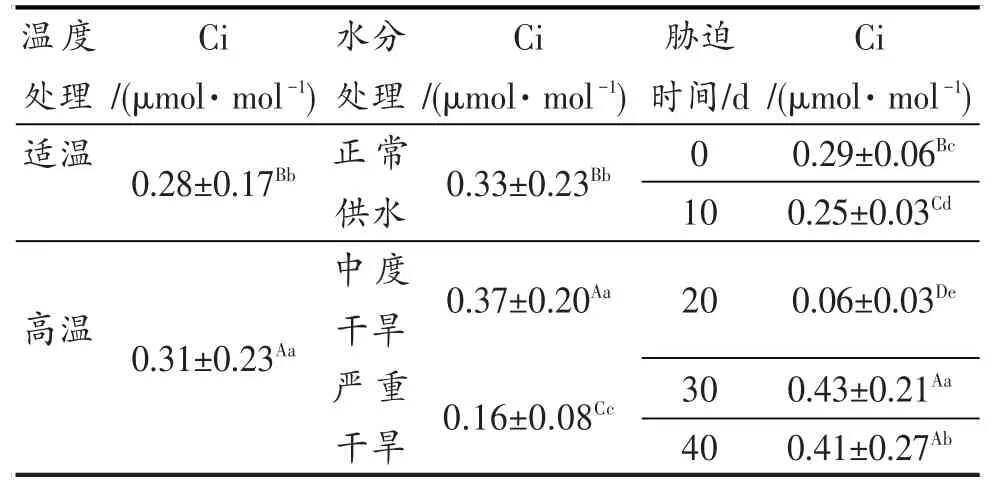
表5 灌浆结实期高温与干旱胁迫对水稻Ci的差异显著性Table 5 Significance of Ci under high temperature and drought stress in grain filling stage of rice
表5的方差分析结果表明,灌浆结实期高温胁迫、干旱胁迫对水稻叶片Ci的影响达显著和极显著水平。与OT-WW相比,高温胁迫、中度干旱胁迫总体上导致Ci上升,但重度干旱胁迫则导致Ci的大幅度下降。
2.8 灌浆结实期高温与干旱胁迫对水稻气孔导度(Gs)的影响
图8表明,OT-WW、高温、干旱及其双重胁迫处理,随着胁迫时间的延长,其水稻叶片气孔导度(Gs)都呈下降趋势,胁迫20 d时达到最低点;20 d以后又上升,尤其在20~30 d时上升最快。在胁迫20 d后,各处理间以重度干旱胁迫的气孔导度最低。高温与严重干旱的双重胁迫在胁迫40 d时的参数因胁迫强度过大而未能正常测出,故Gs在柱形图上未予显示。方差分析结果见表6。
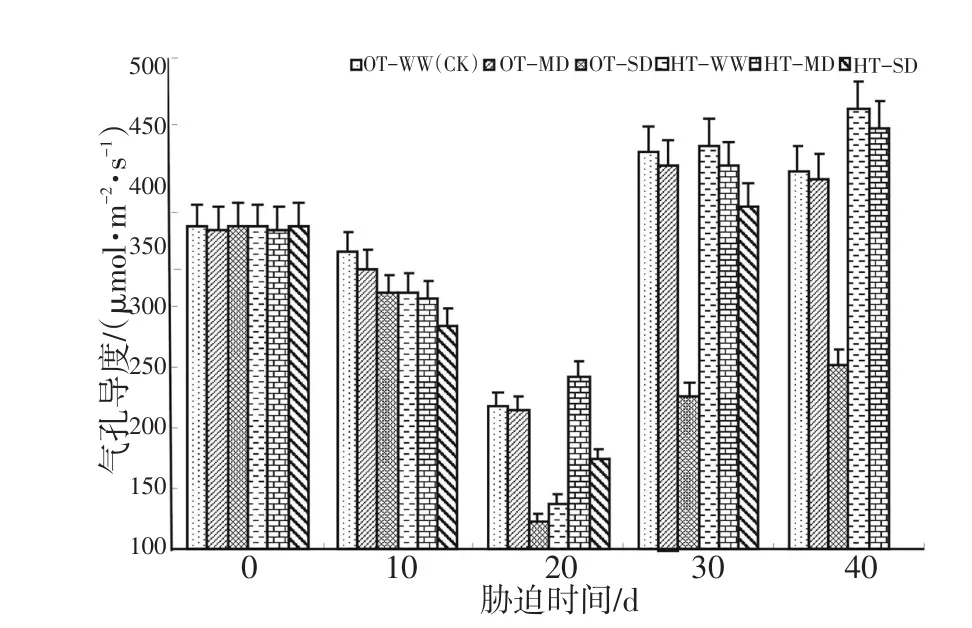
图8 灌浆结实期高温与干旱胁迫下水稻气孔导度的动态变化Fig.8 Dynamicchangeofstomatalconductance(Gs)duringgrain fillingstageofriceunderhightemperatureanddroughtstress
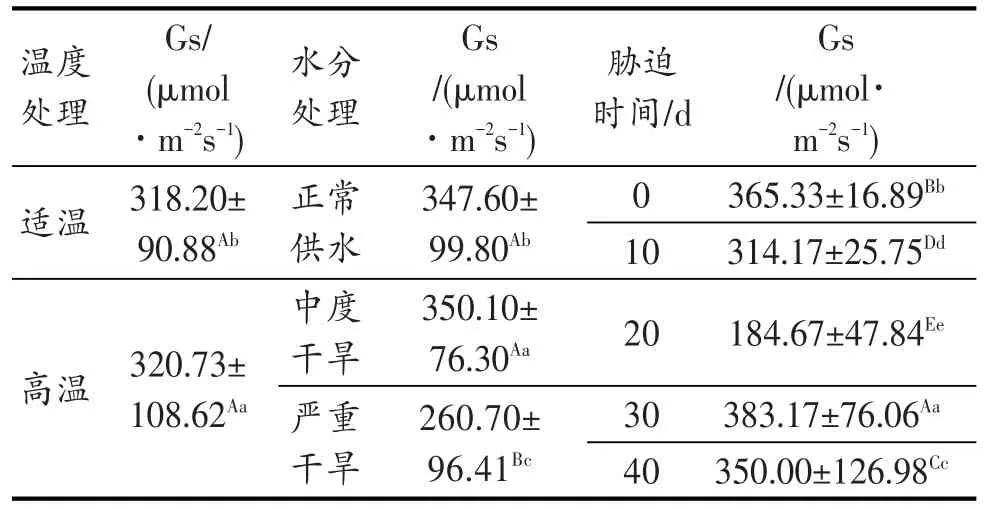
表6 灌浆结实期高温与干旱胁迫下水稻Gs的差异显著性Table 6 Significance of Gs under high temperature and drought stress in grain filling stage of rice
表6的方差分析结果表明,灌浆结实期高温胁迫、干旱胁迫对水稻剑叶气孔导度(Gs)的影响达显著和极显著水平。特别值得一提的是,在中度干旱下水稻叶片的Gs略有升高,而在严重干旱下水稻叶片的Gs又大幅度下降。
2.9 灌浆结实期高温与干旱胁迫对水稻蒸腾速率的影响
图9表明,OT-WW处理以及高温、干旱及其双重胁迫处理叶片蒸腾速率(Tr),随胁迫时间的延长均呈下降趋势,胁迫20 d时降到最低点;20~30 d急剧上升,30 d后,OT-WW与高温胁迫的Tr趋于平缓;但中度干旱胁迫、高温-中度干旱的双重胁迫则导致Tr的急速下降,重度干旱胁迫下Tr则急剧上升。高温与重度干旱的双重胁迫在胁迫40 d时的参数因胁迫强度过大而未能正常测出,故Tr在柱形图上未予显示。方差分析结果见表7。
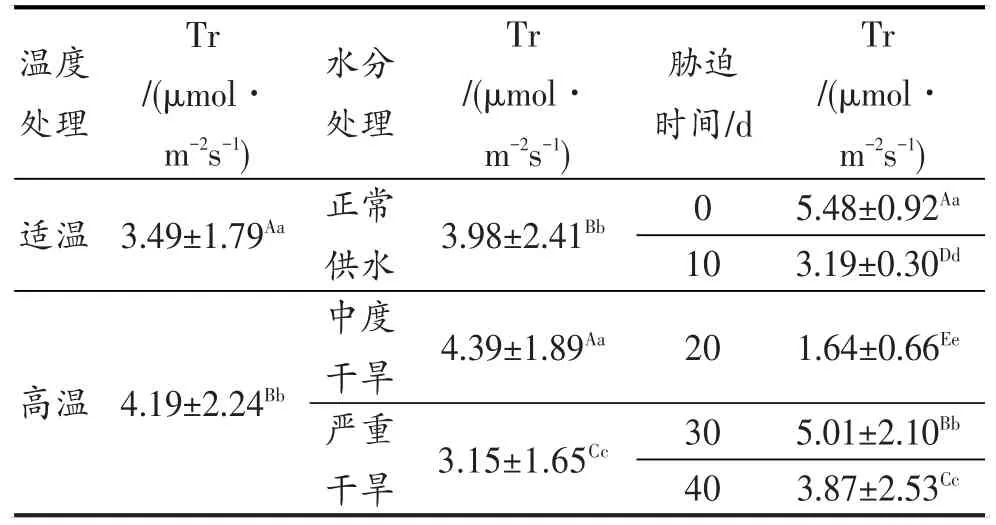
表7 灌浆结实期高温与干旱胁迫对水稻Tr的差异显著性Table 7 Significance of Tr under high temperature and drought stress in grain filling stage of rice
表7的方差分析结果表明,灌浆结实期高温胁迫、干旱胁迫对水稻剑叶蒸腾速率(Tr)的影响达到显著和极显著水平。同时可以看出,高温胁迫对水稻剑叶的Tr影响更为显著;中度干旱可适度提高其Tr,而严重干旱下水稻剑叶的Tr又极显著降低。
3 讨论和结论
高温和干旱的单一胁迫对水稻生理代谢、基因表达有重要影响,相关方面国内外学者已经有较多的研究[5-6,10-14]。而我国南方许多地方,特别是重庆与三峡库区水稻灌浆结实期常常遭遇的是高温干旱双重胁迫,但是,采用同一材料同时比较研究高温、干旱以及高温干旱双重胁迫对水稻产量品质、生理代谢的影响涉及得不多[2,7],赵凤云等[15]研究了干旱高温复合胁迫下转基因水稻苗期的光合与抗氧化生理变化。高温干旱双重胁迫对水稻生育后期光合生理特性影响的研究难觅,我们实验室[16]就高温干旱双重胁迫对水稻剑叶光合特性、膜脂过氧化作用的影响做了初步研究,但没有系统地比较高温、干旱的单一胁迫与双重胁迫间的光合生理差异。有研究者在其他作物上进行了高温干旱双重胁迫的试验。如戴廷波等[4]研究了花后高温及温度和水分互作对小麦的作用,区分了两个逆境因素对相关指标的影响。Grigorova等[17-18]分析了干旱与高温互作对小麦热激蛋白的效应,并进一步揭示了这种互作对小麦叶绿体和线粒体超微结构的影响。Prasad等[19]研究了小麦灌浆期高温与干旱单一与双重胁迫对其产量和叶绿体的影响。我们的试验首次系统地比较研究了水稻在高温、干旱的单一胁迫与双重胁迫间的叶绿素a、叶绿素b、类胡萝卜素含量、Pn、Ci、Gs、Tr等影响光合作用的重要生理指标,比较分析了其灌浆结实期的表现,可为水稻栽培育种提供重要参考。
水稻在高温胁迫下,会发生叶绿体结构受损,光合色素降解,光合相关酶活性降低,光合速率显著下降[20-21]。李稳香等[22]研究表明,杂交中稻组合叶片的总叶绿素含量、类胡萝卜素含量在自然高温以及人工高温胁迫下均显著下降,而后者的变化量与结实率显著相关。曹云英等[23]的研究表明,水稻开花期高温胁迫处理降低了水稻叶面积指数,剑叶叶绿素含量和光合速率下降,植株干物质生产减少。王泽港等[24]的试验结果表明水分胁迫处理会引起水稻的叶绿素含量和Pn下降。文汉等[25]研究也表明,抽穗后期的干旱逆境能导致水稻旗叶叶绿素含量迅速下降,抽穗后30 d水稻剑叶的叶绿素含量,在正常供水下仅比抽穗后2 d下降了31.07%,而同期干旱胁迫处理则下降了42.23%。本研究表明水稻在灌浆结实期高温干旱胁迫下,不同色素对高温与干旱胁迫的响应存在差异。与OT-WW的对照相比,水稻在高温正常供水处理中,叶绿素a含量下降,但在中度干旱、重度干旱以及高温与中度干旱、高温与重度干旱的双重胁迫下,叶绿素a相对含量比对照有所增加,以OT-MD下的叶绿素a含量最高;叶绿素b含量总体均比对照低,但变幅不大;类胡萝卜素含量也在重度干旱、高温与中度干旱、高温与重度干旱的双重胁迫处理中表现出比OT-WW组更高的含量。观察发现,随着高温与干旱胁迫的加剧,水稻植株从下部叶片开始逐渐发黄,但在植株绿叶数逐渐减少的情况下,叶片几种光合色素含量表现有差别,并非都呈下降趋势,这种现象背后的机制值得深入研究。我们的试验证明,几种光合色素对高温与干旱双重胁迫的响应不一致,如适当的干旱胁迫有利于叶绿素a含量的升高(图1),适温和正常供水其叶绿素b含量在试验后期(40 d)大大高于其他处理(图2),高温与重度干旱胁迫下类胡萝卜素含量在试验后期(30~40 d)明显高于其他处理。其中部分叶绿素a是反应中心色素分子,其他光合色素属于聚光色素分子。这些结果提示在水稻育种与栽培实践中,可以利用光合色素的不同表现,调控其代谢过程,监测其变化趋势,以最大限度地提高光能利用效率。
本文关于水稻光合特性的研究表明,在本试验条件下定期监测补水,维持一定含水量的高温-干旱胁迫,总体上看,水稻植株Pn,Ci,Gs,Tr等光合指标仅在HT-SD胁迫下相比对照出现了较大幅度的下降,并且与其他各处理间的差距较大。如中度干旱对植株Pn的影响较小,但在严重干旱下水稻叶片的Pn大幅度下降(表4);水稻叶片Gs在胁迫20 d时达到最低点,20 d以后又上升,尤其在20~30 d时上升最快(图8)。这些结果表明水稻对高温-干旱胁迫有一定的适应能力,这种现象可为制订水稻抗逆的遗传育种和栽培措施提供有价值的参考,如利用Gs的变化规律来调控光合速率的变化。CO2是植物进行光合作用的原料,其吸收是光合作用对高温最敏感的过程之一。在C3植物中,CO2的光合吸收包括从大气扩散到Rubisco酶活性位点一般要包括边界层、气孔传导和叶肉传导三个过程。由于气孔导度的影响而引起的光合速率降低现象称为气孔限制[26]。高温胁迫下是否会导致气孔限制,与伴随高温的环境水分状况有关。高温已经导致环境水分下降甚至引起干旱时,气孔内外环境的蒸汽压差增大,植物为了减少蒸腾而关闭气孔,便会形成气孔限制。如果高温没有形成环境水分的下降,Gs则会随叶温增加而增加,甚至在光合系统遭到破坏的情况下,气孔仍然是开放的[27]。参与光合作用的CO2在进入气孔后,还必须从胞间扩散并溶解到胞内叶绿体基质中才能进行羧化。CO2从胞间向胞内的扩散受碳酸酐酶和水孔蛋白的调控,高温会影响这两种蛋白质的热稳定性而使扩散受阻[28]。滕中华等[29]的试验结果表明,高温胁迫下水稻叶片叶绿素含量降低;温度钝感水稻的Pn比适温处理的对照组高,而温度敏感型水稻在灌浆前期与适温处理的差异不明显,灌浆后期则高温胁迫处理的Pn下降。张桂莲等[30]的研究表明灌浆结实期高温对水稻剑叶光合生理特性的影响和稻米品质有关。戴新宾等[31]研究表明,如果干旱程度并不十分严重,水稻Gs等光合参数会表现出相应的下降,而碳酸酐酶(CA)活性却因为逆境诱导而有较大幅度的上升,从而促使叶肉导度上升和CO2有效供给增加,在一定程度上弥补由于气孔关闭导致的光合速率的下降。胡继超等[32]研究表明,水稻叶片水势在干旱胁迫处理后明显低于对照,凌晨叶片水势的临界值与叶片的Pn密切相关。何海兵等[33]研究了干旱区控制灌溉下水稻光合特性与蒸腾效率。我们的试验则系统地比较了水稻在高温、干旱的单一胁迫与双重胁迫间的光合生理差异,特别是在高温干旱双重胁迫下水稻Ci、Gs、Tr的变化以及由此表现出的Pn的变化。但是在高温、干旱的单一胁迫与双重胁迫下影响光合作用的气孔限制与非气孔限制的比重如何,需要进一步的比较研究。
在本研究中,总体上看,光合色素含量以及光合生理指标均以高温干旱的双重胁迫处理最低,表明了灌浆结实期高温与干旱的双重胁迫对水稻光合系统的伤害远远大于单一的高温胁迫或干旱胁迫。高温干旱双重胁迫对水稻生产的严重不利影响应该引起栽培学家及育种学家的高度重视,也需要从机理上深入探究。在重庆与三峡库区水稻灌浆结实期,因为经常遭遇到高温干旱双重胁迫,可从培养抗逆品种、调控栽培措施入手,防止植株叶片早衰,保障光合色素含量,提高光合效率,进而稳定产量和品质。此外,由于叶绿体除了进行光合作用外,还参与许多生物化学过程,如淀粉的合成和转运、亚硝酸盐还原、硫酸盐还原、蛋白质与氨基酸的合成、DNA与RNA的合成、酯类、萜类和酚类的合成、四吡咯的合成以及这几大类物质的降解,因此,在高温干旱双重逆境研究中,还应该加大上述系列物质合成与降解代谢紊乱对水稻生理的伤害研究。
[1]徐富贤,郑家奎,朱永川,等.川东南高温伏旱区杂交中稻品种库源结构对稻米整精米率与垩白粒率的影响[J].作物学报,2004,30(5):432-437.
[2]高焕晔,王三根,宗学凤,等.灌浆结实期高温干旱复合胁迫对稻米直链淀粉及蛋白质含量的影响[J].中国生态农业学报,2012,20(1):40-47.
[3]KAUR V,BEHL R K.Grain yield in wheat as affected by short periods of high temperature,drought and their interaction during pre-and post-anthesis stages[J].Cereal Research Communications,2010,38(4):514-520.
[4]戴廷波,赵辉,荆奇.灌浆期高温和水分逆境对冬小麦籽粒蛋白质和淀粉含量的影响[J].生态学报,2006,26(11):3670-3676.
[5]MUTHURAJAN R,SHOBBAR Z S,JAGADISH S V K,et al.Physiological and proteomic responses of rice peduncles to drought stress[J].Molecular Biotechnology,2011,48(2):173-182.
[6]LEE S Y,GAXIOLA R,YANG G,et al.Overexpressing CBP and AVP1 confers drought tolerance in rice(Oryza sativa)[J].In Vitro Cellular&Developmental Biology,2012,48(1):42-43.
[7]高焕晔,宗学凤,吕俊,等.灌浆结实期水稻对高温干旱胁迫的抗性生理响应[J].三峡生态环境监测,2017,2(1):11-20,27.
[8]WELLBURN A R.The spectral determination of chlorophylls a and b,as well as total carotenoids,using various solvents with spectrophotometers of different resolution[J].Journal of Plant Physiology,1994,144(3):307-313.
[9]王通明,陈伟,潘文杰,等.有机肥和化肥对烟叶气体交换、叶绿素荧光特性及叶绿体超微结构的影响[J].植物营养与肥料学报,2015,21(2):517-526.
[10]HADIARTO T,TRAN L S.Progress studies of droughtresponsive genes in rice[J].Plant Cell Reports,2010,30(3):297-310.
[11]HAKATA M,KURODA M,MIYASHIYA T,et al.Suppression of α-amylase genes improves quality of rice grain ripened under high temperature[J].Plant Biotechnology Journal,2012,10(9):1110-1117.
[12]ASHRAFE,BIYM,KOSALAR,etal.TheRiceR2R3-MYB transcription factor OsMYB55 is involved in the tolerance tohightemperatureandmodulatesaminoacidmetabolism[J].Plos One,2012,7(12):1-16.
[13]WEI K S,YANG W L,JILANI G,et al.Effect of high temperature on the enzymatic activities and transcriptional expression of starch debranching enzyme(dbe)mutiple isoforms in developing rice endosperms[J].Journal of Animal&Plant Sciences,2012,22(1):97-107.
[14]ZONG W,ZHONG X C,YOU J,et al.Genome-wide profiling of histone H3K4-tri-methylation and gene expression in rice under drought stress[J].Plant Molecular Biology,2012,81(1/2):175-188.
[15]赵凤云,徐忠俊.干旱高温胁迫下转基因水稻的生理变化[J].西北植物学报,2009,29(2):240-248.
[16]刘照,高焕晔,王三根.高温干旱双重胁迫对水稻剑叶光合特性的影响[J].西南师范大学学报(自然科学版),2011,36(3):161-165.
[17]GRIGOROVA B,VASEVA I,DEMIREVSKA K,et al.Combined drought and heat stress in wheat:Changes in some heat shock proteins[J].Biologia Plantarum,2011,55(1):105-111.
[18]GRIGOROVA B,VASSILEVA V,KLIMCHUK D,et al.Drought,high temperature,and their combination affect ultrastructure of chloroplasts and mitochondria in wheat(Triticum aestivumL.)leaves[J].Journal of Plant Interactions,2012,7(3):204-213.
[19]PRASAD P V V,PISIPATI S R,MOMČILOVIĆ I,et al.Independent and combined effects of high temperature and drought stress during grain filling on plant yield and chloroplast EF-Tu expression in spring wheat[J].Journal of Agronomy and Crop Science,2011,197(6):430-441.
[20]郑小林,董任瑞.水稻热激反应的研究II.高温对晚稻幼苗叶片叶绿体的Hill反应及超微结构的影响[J].湖南农业大学学报,1998,24(5):351-354.
[21]黄英金,张宏玉,郭进耀,等.水稻耐高温逼热的生理机制及育种应用研究初报[J].科学技术与工程,2004,4(8):655-658.
[22]李稳香,陈立云,雷东阳,等.高温条件下杂交中稻结实率与生理生化特性变化的相关性研究[J].种子,2006,25(5):12-16.
[23]曹云英,段骅,杨立年,等.抽穗和灌浆早期高温对耐热性不同籼稻品种产量的影响及其生理原因[J].作物学报,2009,35(3):512-521.
[24]王泽港,梁建生,曹显祖,等.半根干旱胁迫处理对水稻叶片光合特性和糖代谢的影响[J].江苏农业研究,1999,20(3):21-26.
[25]文汉,聂凡.干旱对水稻抽穗后旗叶衰老和产量构成因子的影响[J].安徽农业大学学报,2000,27(2):135-137.
[26]罗祎,邓启云,常硕其,等.高温对水稻光合作用的影响研究进展[J].作物研究,2010,24(3):201-204.
[27]BERRY J,BJÖRKMAN O.Photosynthetic response and adaptation to temperature in higher plants[J].Annual Review of Plant Physiology,1980,31:441-543.
[28]YAMORI W,NOGUCHI K,HANBA Y T,et al.Effects of internal conductance on the temperature dependence of the photosynthetic rate in spinach leaves from contrasting growth temperatures[J].Plant&Cell Physiology,2006,47(8):1069-1080.
[29]滕中华,智丽,吕俊,等.灌浆期高温对水稻光合特性、内源激素和稻米品质的影响[J].生态学报,2010,30(23):6504-6511.
[30]张桂莲,廖斌,汤平,等.灌浆结实期高温对水稻剑叶生理特性和稻米品质的影响[J].中国农业气象,2014,35(6):650-655.
[31]戴新宾,翟虎渠,张红生,等.土壤干旱对水稻叶片光合速率和碳酸酐酶活性的影响[J].植物生理学报,2000,26(2):133-136.
[32]胡继超,姜东,曹卫星,等.短期干旱对水稻叶水势、光合作用及干物质分配的影响[J].应用生态学报,2004,15(1):63-67.
[33]何海兵,武立权,杨茹,等.干旱区控制灌溉下水稻光合特性与蒸腾效率研究[J].农业机械学报,2016,47(9):186-193.

