大肠杆菌质粒DNA提取方法的研究
李 恒
(宿州市环境监测站 安徽宿州 234000)
1 引言
目前常见的DNA的提取方法主要有煮沸法、碱裂解法等,并且通过去除蛋白质和RNA以达到纯化质粒DNA的目的,传统的实验室的方法是碱裂解法。
2 方法
2.1 煮沸法提取大肠杆菌质粒DNA
2.1.1 DNA提取方法
(1)在适当的含抗生素(比如:氯霉素等)的30mL LB培养基中接种单一的大肠杆菌菌落,振荡培养至对数生长晚期以250r/min培养12-16 h;(2)将10mL大肠杆菌培养液置入微量离心管中于4℃下以12000r/min离心9min,将未分离的菌液保存;(3)离心后的溶液弃去上清夜,倒置于吸水纸上,并用吸管除去培养液滴;(4)用 350μlSTET 重悬大肠杆菌沉淀;(5)加入 25μl新配制的溶菌酶溶液,盖上离心管盖,轻轻涡悬3s后,并置于沸水浴40s;(6)在室温下用微量离心机以12000r/min离心15 min,将上清夜倒于灭菌洁净试管中;(7)在上清液中加入40ul 2.5mol/L的乙酸钠(pH5.2)和420ul异丙醇,以沉淀核酸,振荡混匀溶液,并在室温下放置5min,在4℃下以10000r/min离心10min,回收沉淀的核酸;(8)倒置于纸巾上使其液体流尽,并用吸管除去液滴,之后用1ml 70%的乙醇漂洗核酸沉淀,离心除去上清液,并除去所有的乙醇液滴,敞口放置在室温下直到乙醇全部挥发,用50 μl含RNAseA的TE(pH8.0)溶解核酸,轻轻涡旋混匀。
2.1.2 琼脂糖凝胶电泳检测
上述的溶液与EB混合染色进行1%琼脂糖凝胶电泳,电泳后在紫外分析仪下观察,并且进行拍照检测。
2.2 碱裂解法提取大肠杆菌质粒DNA
2.2.1 DNA提取方法
(1)在适当的含抗生素的25mL LB培养基中接种单一的大肠杆菌菌落,振荡培养至对数生长晚期以250r/min培养12-16 h;(2)取4.5mL大肠杆菌菌液以12000r/min离心 9min,弃去上清夜,尽量弃去干净,可以用小的枪头移去;(3)再加入100 μl冰预冷溶液Ⅰ,利用涡悬振荡器振荡,从而使菌体充分,室温放置2min;(4)加入200μl新配置的溶液Ⅱ,轻轻将离心管上下颠倒5~7 次,混匀,室温放置下 2min;(5)加入 150 μl冰预冷的溶液Ⅲ,轻轻将离心管上下颠倒5~7次,直至白色的沉淀充分形成,冰上放置3分钟,以12000r/min离心5min;(6)转移上清,并加入两倍体积的95%乙醇,室温放置5min后,以12000r/min离心5min;弃去上清;用200μlTE溶解沉淀,加入150 μl 6mol/L NH4Ac(pH8.0),充分混匀后冰上放置3分钟,以12000r/min离心5min;(7)弃去上清,并加入两倍体积的95%乙醇,室温放置5min后,以12000r/min离心5min;(8)弃去上清,沉淀用70%的无水乙醇洗涤;(9)离心除去上清液,并除去所有的乙醇液滴,敞口放置在室温下直到乙醇全部挥发,用50 μl含RNAseA的TE(pH8.0)溶解核酸,轻轻涡旋混匀。
2.2.2 琼脂糖凝胶电泳检测
上述的溶液与EB混合染色进行琼脂糖凝胶电泳,电泳后在紫外分析仪下观察,并且进行拍照,检测。
3 结果与讨论
3.1 煮沸法提取的大肠杆菌质粒DNA电泳结果
此图是煮沸法提取的大肠杆菌质粒DNA琼脂糖凝胶电泳图,这张图没有经过RNA酶的处理,从图中我们可以明显看出电泳结果条带太暗,也由此说明质粒DNA提取的浓度很低,煮沸法提取质粒DNA效果并不是很好,因为在煮沸的过程中限制酶并不会完全消失,质粒DNA会降解。
3.2 碱裂解法提取大肠杆菌质粒DNA
此图是碱裂解法提取大肠杆菌质粒DNA琼脂糖凝胶电泳图,这张图未经过RNA酶的处理,这张图我们可以明显的看到电泳结果条带比较亮,条带也很清晰,此法提取质粒DNA的效果比较好。在裂解过程中,大肠杆菌的蛋白质、破裂的细胞壁和变性的染色体会缠绕成比较大的复合物,此后被十二烷基硫酸盐包盖,钾离子取代钠离子复合物沉淀,能够实现很好的分离。
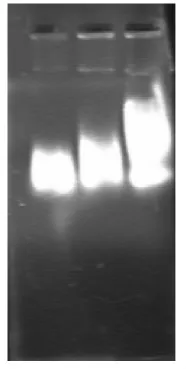
图3-1 煮沸法提取大肠杆菌质粒DNA琼脂糖凝胶电泳图
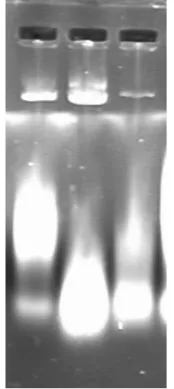
图3-2 碱裂解法提取大肠杆菌质粒DNA琼脂糖凝胶电泳图
结语
通过以上煮沸法,碱裂解法两种方法对大肠杆菌提取质粒DNA,进行跑电泳的结果看来碱裂解法提取大肠杆菌质粒DNA的亮带最为清晰,而煮沸法提取大肠杆菌质粒DNA的条带最暗。
[1]皱湘辉,庄东红,钟名其等.大肠杆菌质粒DNA不同提取方法的比较 [J].汕头大学学报,2003.5,18(2):20-21.
[2]朱玉贤,李毅.现代分子生物学.北京:高等教育出版社[M],1997.

