甜瓜叶片光合产物输出能力对弱光的响应
杨柳燕,陈菁菁,陈年来
甜瓜叶片光合产物输出能力对弱光的响应
杨柳燕,陈菁菁,陈年来
(甘肃农业大学园艺学院,兰州 730070)
【目的】研究甜瓜果实发育期坐果节位叶片光合能力、蔗糖合成能力和水苏糖装载能力对遮光的响应,分析不同耐弱光性甜瓜品种同化物输出能力的差异,为进一步研究甜瓜耐弱光品种果实糖分卸载与积累机理奠定基础。【方法】以耐弱光甜瓜品种‘玉金香’和不耐弱光品种‘钰雪三号’为试材,在日光温室条件下于授粉后进行遮光处理,每5 d取样一次,取坐果节位叶片测定叶绿素含量、气体交换参数、葡萄糖、果糖、蔗糖、肌醇半乳糖苷、棉子糖、水苏糖和淀粉含量,同时测定叶片蔗糖磷酸合成酶(SPS)、蔗糖合成酶(SS)、中性转化酶(NI)、酸性转化酶(AI)、肌醇半乳糖苷合成酶(GS)和水苏糖合成酶(STS)活性。【结果】遮光处理后,两个甜瓜品种叶片叶绿素a/b、净光合速率(Pn)、葡萄糖、果糖和蔗糖含量均显著降低,淀粉含量升高,‘玉金香’叶绿素a/b降幅(10.0%)大于‘钰雪三号’(5.8%),而Pn、蔗糖含量降幅(分别为30.3%和30.9%)和淀粉含量增幅(3.6%)均显著小于‘钰雪三号’(分别为45.2%、60.6%和20.4%)。遮阴条件下,两个品种叶片蔗糖代谢相关酶SPS、SS、AI和NI活性均显著降低,‘玉金香’SPS和SS酶活性降幅(分别为16.5%和30.0%)显著小于‘钰雪三号’(31.6%和40.5%),而AI和NI降幅(分别为23.8%和12.7%)高于‘钰雪三号’。遮光后甜瓜叶片肌醇半乳糖苷含量和GS活性均显著降低,但品种间差异不显著。棉子糖、水苏糖和STS活性均显著降低,‘玉金香’棉子糖含量降幅(65.3%)显著高于‘钰雪三号’(35.0%),而水苏糖和STS活性降幅(分别为79.5%和23.8%)小于‘钰雪三号’。【结论】遮光条件下,耐弱光品种‘玉金香’叶片蔗糖合成能力和水苏糖装载能力下降较少,具有较强的同化物输出能力。
甜瓜;遮光;气体交换特性;蔗糖合成;水苏糖装载;同化物输出
0 引言
【研究意义】甜瓜反季节设施栽培中经常遇到弱光逆境,弱光下甜瓜果实糖分积累受到抑制主要是因为叶片同化物供给减少[1-3]。甜瓜等葫芦科作物韧皮部运输的碳水化合物主要为水苏糖,还有少量棉子糖和蔗糖[4-5]。相对于以蔗糖为主要运输物质的植物来说,葫芦科植物叶片同化物输出过程中增加了把蔗糖转化成棉子糖和水苏糖进行装载的步骤。有研究表明,葫芦科作物叶肉细胞中合成的蔗糖和肌醇半乳糖苷通过胞间连丝运输到中间细胞,在中间细胞进一步合成棉子糖和水苏糖[6],然后装载进入筛分子运输到库器官,因此葫芦科作物叶片光合产物输出由合成和装载共同决定。分析不同耐性品种同化物输出能力对弱光响应的差异,为进一步研究甜瓜耐弱光品种果实糖分卸载与积累机理奠定基础。【前人研究进展】温室反季节生产条件下日照时间短,光照强度弱,弱光胁迫成为影响甜瓜产量和品质的重要因素[7]。弱光胁迫下,叶片叶绿素含量升高,叶绿素a/b降低[1,8-10],碳同化速率和蔗糖合成相关酶活性下降[7-8,10-14],光合产物合成和输出减少[1-3,15-17],最终导致果实产量和品质降低[18-20]。【本研究切入点】目前对甜瓜弱光胁迫的研究主要集中在叶片光合能力和果实产量与品质上,对弱光胁迫下叶片同化物装载的研究尚未见报道。【拟解决的关键问题】通过对甜瓜叶片光合产物合成能力和装载能力研究,分析不同耐性品种同化物输出能力对弱光响应的差异。
1 材料与方法
试验于2016年在甘肃省农业科学院日光温室和甘肃农业大学园艺学院实验室进行。
1.1 试验材料及取样
材料为耐弱光品种‘玉金香’,不耐弱光品种‘钰雪三号’。2016年1月28日催芽播种,穴盘育苗,搭架栽培,单蔓整枝,授粉结束后用双层遮阳网遮光,实测光照强度为温室自然光照强度的52%,以自然光强为对照。遮光后第5天开始,取坐果节位叶片进行糖分和酶活性测定,每隔5 d取样一次,每次3个重复,至授粉后35 d结束,共取样7次。叶样采集后迅速转移到液氮内,-80℃低温冰箱保存。
1.2 气体交换特性和叶绿素含量测定
叶片气体交换特性于授粉后晴天上午9:30—11:00用CIRAS-2便携式光合仪测定,同步记录坐果节位叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci),重复3次。
光合色素含量测定采用95%乙醇浸提法[10]。
1.3 糖分含量测定
1.3.1 样品处理 糖分组成和含量测定依据Hu等[5]的方法,并加以改进。取样品3 g在研钵中充分研磨后加入5 mL 80%乙醇,再研磨3 min,置于10 mL离心管中,80℃水浴保温30 min,取出冷却至室温,离心后收集上清液,残渣在80℃水浴中反复再抽提两次,合并3次抽提液,转入旋转蒸干仪中,在45℃低温蒸干,用1 mL超纯水溶解,转入1.5 mL离心管中,12 000 r/min离心20 min,0.45 μm水相滤膜过滤,4℃保存备用。
1.3.2 测定方法及色谱条件 Shodex Asahipak NH2P-50 4E色谱柱,柱温35℃,2410示差折光检测器,流动相比例为70%乙腈:30%超纯水,流速为1.0 mL∙min-1,糖分标准品均购自sigma公司。果糖、葡萄糖、蔗糖、肌醇半乳糖苷、棉籽糖、水苏糖标准品保留时间分别为:5.544、6.716、8.247、11.454、12.200和18.463 min。
1.3.3 淀粉含量测定方法 糖分用80%乙醇抽提后,剩余沉淀物用高氯酸水解法测定淀粉含量[21]。
1.4 酶活性测定
1.4.1 SS、SPS、AI和NI酶活性测定 粗酶液提取:取样品1 g,加入4 mL 50 mmol∙L-1HEPES-NaOH buffer(pH 7.5)充分研磨,抽提缓冲液包含:10 mmol∙L-1MgCl2,1 mmol∙L-1EDTA,2.5 mmol∙L-1DTT,0.1%(w/v)BSA和0.05%TritonX-100。12 000 r/min离心20 min,上清液在稀释10倍的缓冲液中透析16 h。
SS和SPS活性测定参照赵越等[22]的方法,AI和NI活性测定参照LOWELL等[23]的方法。
1.4.2 水苏糖合成酶(STS)活性测定 参照HUBER等[24]的方法。粗酶液提取:鲜样0.5 g,在冷冻研钵里充分研磨,加入2 mL预冷的抽提液,抽提液含50 mmol∙L-1HEPES-NaOH buffer(pH 7.0)和20 mmol∙L-12-硫基乙醇。12 000 r/min 离心10 min,取上清液在缓冲液中透析16 h,缓冲液含25 mmol∙L-1HEPES- NaOH buffer(pH 7.0)和20 mmol∙L-12-硫基乙醇。
酶活性测定:100 μL反应体系包含25 mmol∙L-1HEPES-NaOH buffer(pH 7.0),20 mmol∙L-12-硫基乙醇,10 mmol∙L-1肌醇半乳糖苷,40mmol∙L-1棉籽糖,加入100 μL透析液,25℃水浴中孵育90 min,加入0.1 mol∙L-1NaOH终止反应,将离心管置于沸水浴中30 s,冷却至25℃。
肌醇生成量测定:1.0 mL反应体系中包含2 mmol∙L-1NAD、0.1 U肌醇脱氢酶、50 mmol∙L-1Na2CO3(pH 9.5),25℃水浴中孵育40 min,将NADH的生成量,即在340 nm处测定吸光值作为酶活性。
1.4.3 肌醇半乳糖苷酶(GS)活性测定 粗酶液提取:取0.5 g样品,加入2 mL抽提液充分研磨,抽提缓冲液包含50 mmol∙L-1HEPES-NaOH buffer(pH 7.0)和10 mmol∙L-1DTT。12 000 r/min离心30 min,上清液在稀释10倍的抽提液中透析脱盐16 h。
酶活性测定:参照SMITH等[25]的方法加以改进。55 μL反应体系包含50 mmol∙L-1HEPES-NaOH buffer(pH 7.5),5 mmol∙L-1MnCl2,3 mmol∙L-1DTT,20 mmol∙L-1肌醇和10 mmol∙L-1UDPG。混合物在30℃水浴中反应30 min,置沸水浴中5 min终止反应。冷却至室温,8 000r/min离心20 min,过45 μm滤膜后进液相(HPLC)测定,测定方法及色谱条件同1.3.2。以肌醇半乳糖苷生成量表示GS活性。
2 结果
2.1 弱光下甜瓜叶片叶绿素a/b和气体交换特性
授粉后‘玉金香’a/b值在5—15 d逐渐下降,之后相对较平稳;而‘钰雪三号’在5—10 d快速上升,之后逐渐降低,35 d时又略微上升(图1-A)。遮光处理后两个品种a/b均降低(<0.05),平均降幅为10.0%(‘玉金香’)、5.8%(‘钰雪三号’),‘玉金香’在授粉后10—20 d显著低于‘钰雪三号’。
叶片净光合速率(Pn)和气孔导度(Gs)授粉后均先升高后降低(图1-B、C)。两个品种的Pn均在授粉后20 d时达到最高值,品种间差异不显著。遮光处理后,Pn最高值提前至授粉后15 d,‘玉金香’显著高于‘钰雪三号’。‘玉金香’和‘钰雪三号’的Pn与对照相对平均降幅为30.3%和45.2%(<0.01)。遮光处理后,‘玉金香’和‘钰雪三号’的Gs均下降(<0.01),分别为22.6%和33.5%。两个品种胞间CO2浓度(Ci)在遮光后均高于对照(图1-D)。
2.2 弱光下甜瓜叶片可溶性糖和淀粉含量
叶片果糖和葡萄糖含量均先升高后降低,果糖的含量明显高于葡萄糖(图2-A、B)。正常光照下,两个品种叶片果糖和葡萄糖含量均在授粉后10 d时达到最高值,之后逐渐降低。遮光处理后果糖和葡萄糖含量均降低(<0.05),平均降幅为24.6%和18.3%(‘玉金香’)、17.4%和24.2%(‘钰雪三号’),葡萄糖含量峰值出现时间推迟至授粉后15 d,品种间差异不显著。
授粉后15 d内,‘钰雪三号’叶片蔗糖含量显著高于‘玉金香’,之后差异很小(图2-C)。弱光下两个品种叶片的蔗糖含量均降低(<0.01),平均降幅为:30.9%(‘玉金香’)、60.6%(‘钰雪三号’),‘钰雪三号’降幅显著高于‘玉金香’。
叶片淀粉含量在授粉后25 d内相对平稳,之后迅速上升(图2-D)。遮光处理下叶片淀粉含量在25 d前略高于对照,至授粉后35 d显著低于对照。授粉后25 d内,对照中‘玉金香’淀粉含量略高于‘钰雪三号’,而遮光处理下则显著低于‘钰雪三号’。弱光下‘钰雪三号’叶片淀粉含量平均增幅(20.4%)显著高于‘玉金香’(3.6%)。
2.3 弱光下甜瓜叶片蔗糖代谢酶活性
叶片蔗糖磷酸合成酶(SPS)和蔗糖合成酶(SS)活性授粉后先升高后降低(图3-A、B)。对照中两个品种SPS酶活性均在授粉后20 d时达到最高值,之后逐渐降低。遮光处理后SPS酶活性降低(<0.01),‘钰雪三号’(31.6%)降幅显著高于‘玉金香’(16.5%)。对照中‘玉金香’叶片SS酶活性在授粉后第10—20天显著高于‘钰雪三号’,20 d后又显著低于‘钰雪三号’。遮光处理使两个品种SS酶活性均降低(<0.01),平均降幅为30.0%(‘玉金香’)和40.5%(‘钰雪三号’)。

图1 弱光下甜瓜叶片叶绿素a/b及光合特性
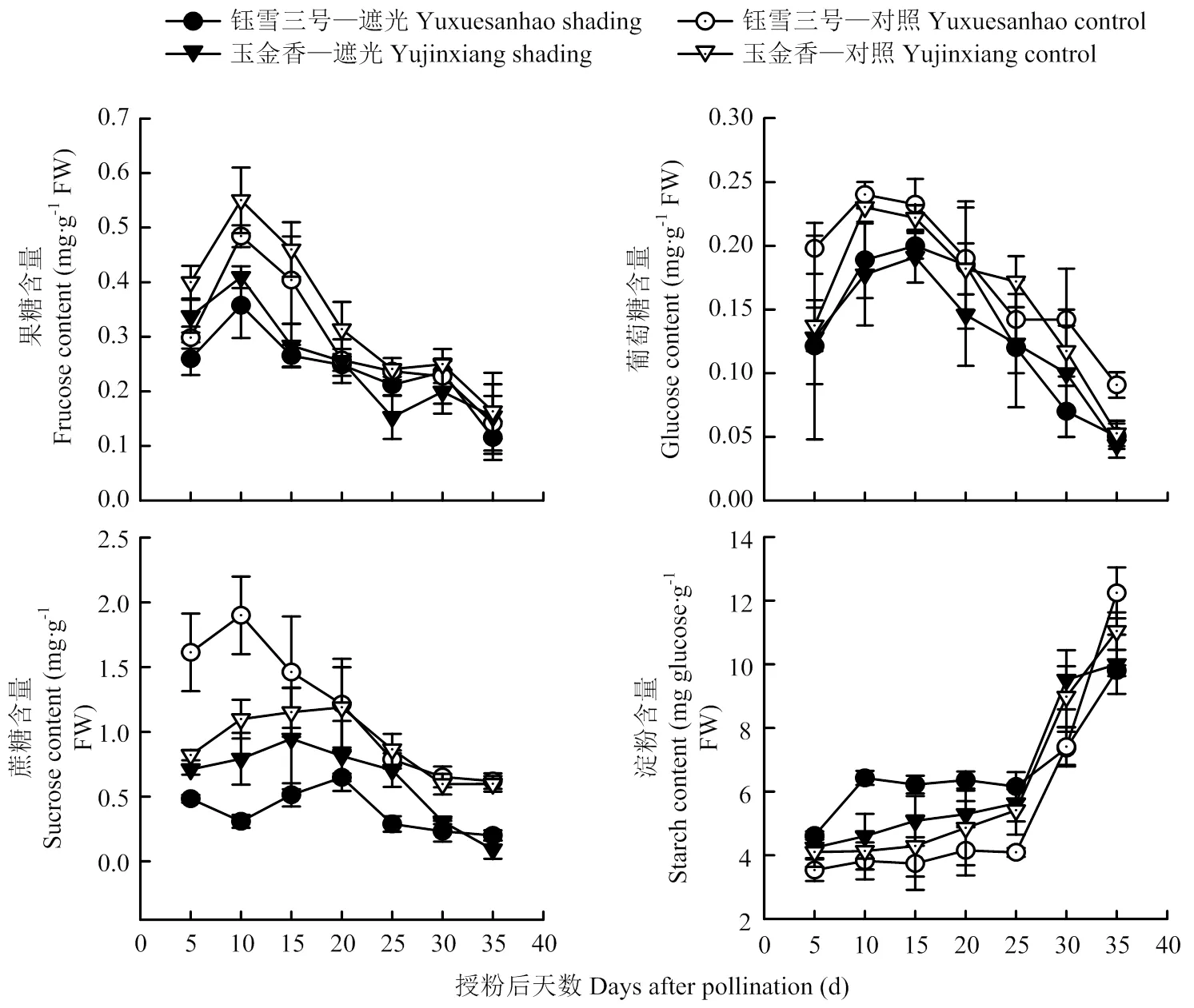
图2 弱光下甜瓜叶片可溶性糖和淀粉含量
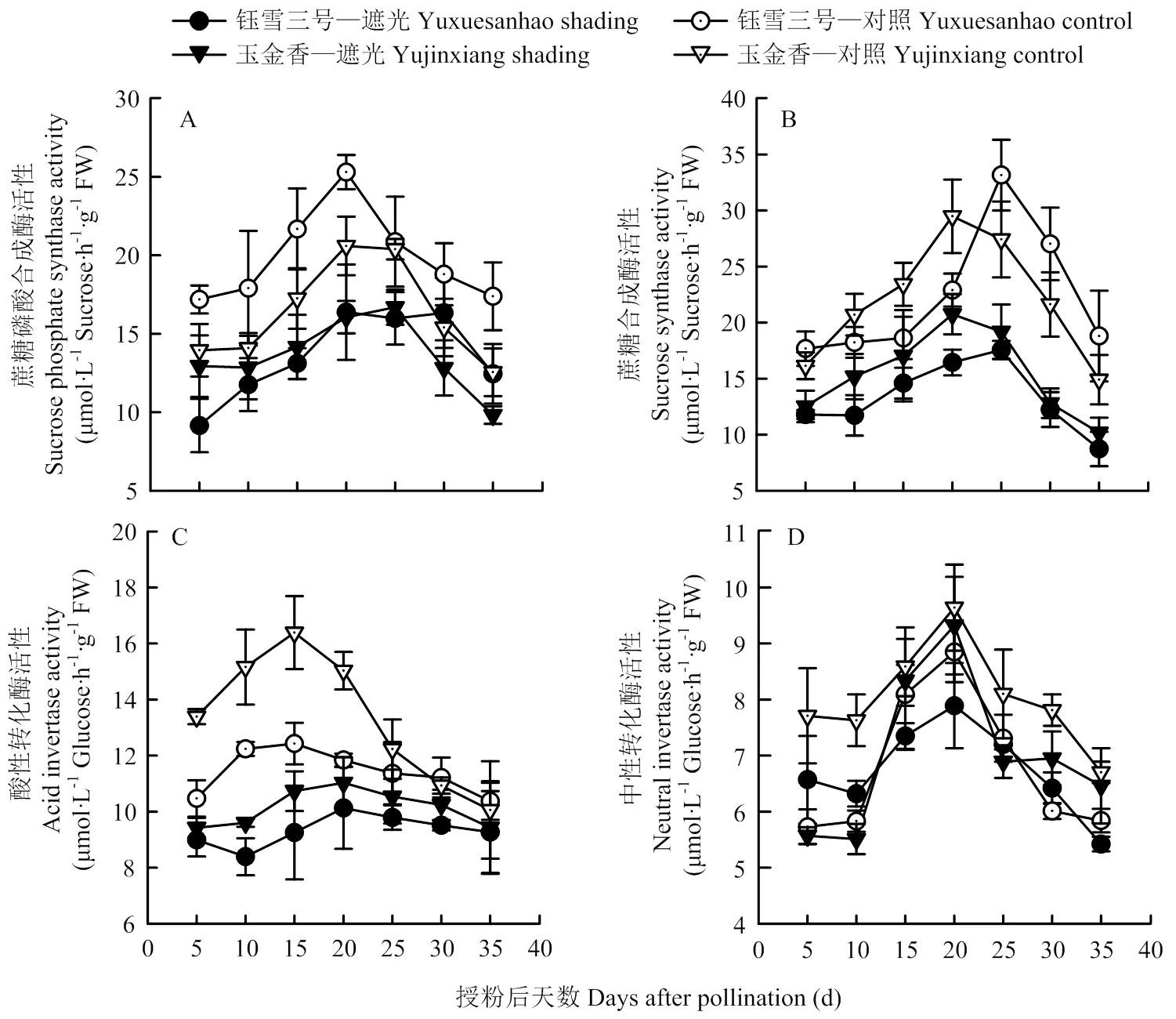
图3 弱光下甜瓜叶片蔗糖代谢酶活性
授粉后叶片酸性转化酶(AI)和中性转化酶(NI)活性均先升高后降低,AI酶活性略高于NI(图3—C、D)。对照中,‘玉金香’AI酶活性在授粉后前20 d显著高于‘钰雪三号’,之后差异不显著。遮光处理后两个品种AI酶活性均降低(<0.01),平均降幅为23.8%(‘玉金香’)和18.3%(‘钰雪三号’)。对照中,‘玉金香’的NI酶活性均显著高于‘钰雪三号’,遮光处理使‘玉金香’NI酶活性降低(<0.05),而‘钰雪三号’只在授粉后15—20 d时明显低于对照,平均降幅为12.7%(‘玉金香’)和1.8%(‘钰雪三号’)。
2.4 弱光下甜瓜叶片肌醇半乳糖苷、棉子糖和水苏糖含量
叶片肌醇半乳糖苷含量在授粉后30 d时降低,35 d时又迅速升高(图4-A)。遮光处理使两个品种叶片肌醇半乳糖苷含量均降低(<0.01),品种间差异不显著。
叶片棉子糖含量授粉后逐渐降低,对照中两个品种在30 d均有一个小幅的上升(图4-B)。正常光照下,‘玉金香’叶片棉子糖含量显著高于‘钰雪三号’。遮光后两个品种棉子糖含量均降低(<0.05),平均降幅为65.3%(‘玉金香’)和35.0%(‘钰雪三号’),品种间差异不明显。
对照中两个品种的水苏糖含量在授粉后5—15 d先降低再升高,之后逐渐降低(图4-C),‘玉金香’叶片水苏糖含量显著高于‘钰雪三号’。遮光处理后两个品种水苏糖含量均显著降低(<0.05),‘玉金香’略高于‘钰雪三号’。
2.5 弱光下甜瓜叶片中肌醇半乳糖苷合成酶(GS)和水苏糖合成酶(STS)活性
授粉后肌醇半乳糖苷合成酶(GS)和水苏糖合成酶(STS)活性均先升高后降低(图5)。正常光照下,两个品种的GS酶活性均在授粉后20 d时达到最高值,品种间差异不明显。遮光处理使两个品种GS酶活性均降低(<0.01),‘玉金香’在授粉后15—25 d略高于‘钰雪三号’,平均降幅为38.9%(‘玉金香’)和38.5%(‘钰雪三号’)。对照中,‘玉金香’叶片STS酶活性在授粉后15—25 d显著高于‘钰雪三号’,其余时间差异不明显。遮光处理后两个品种的STS酶活性均降低,‘玉金香’叶片酶活性显著高于‘钰雪三号’(<0.05)。
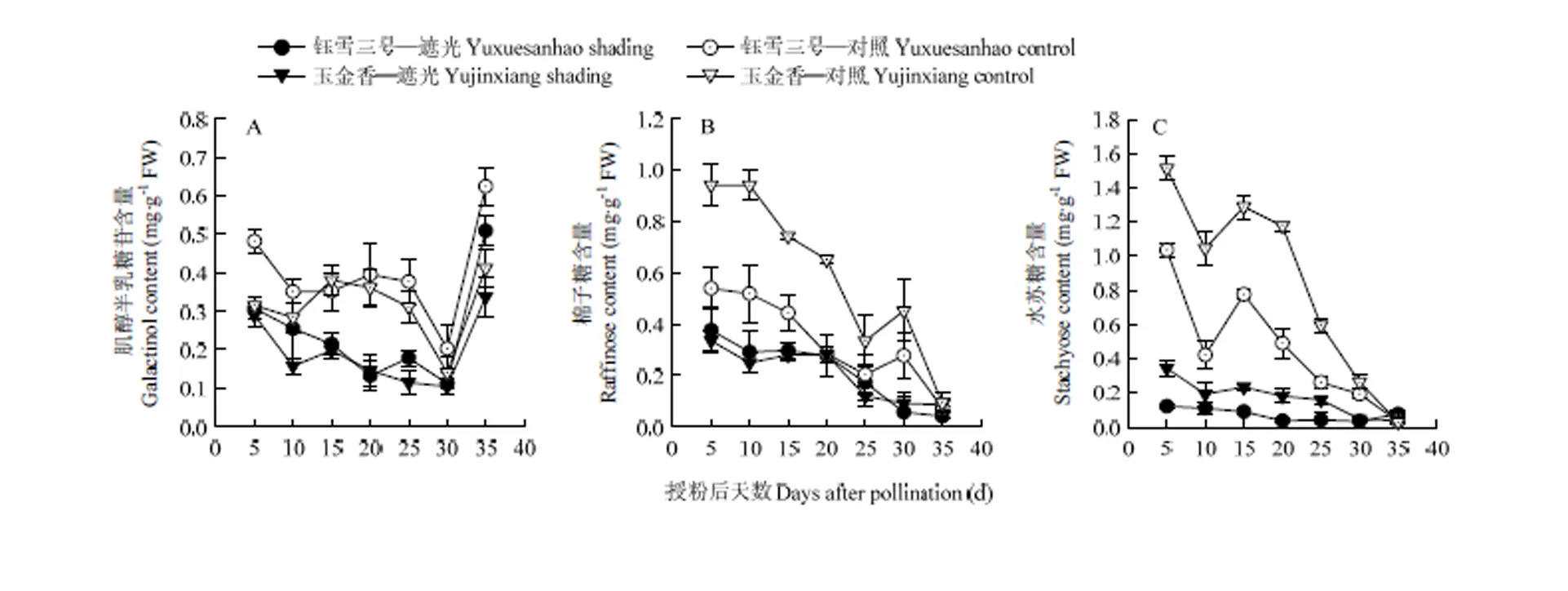
图4 弱光下甜瓜叶片肌醇半乳糖苷、棉子糖和水苏糖含量
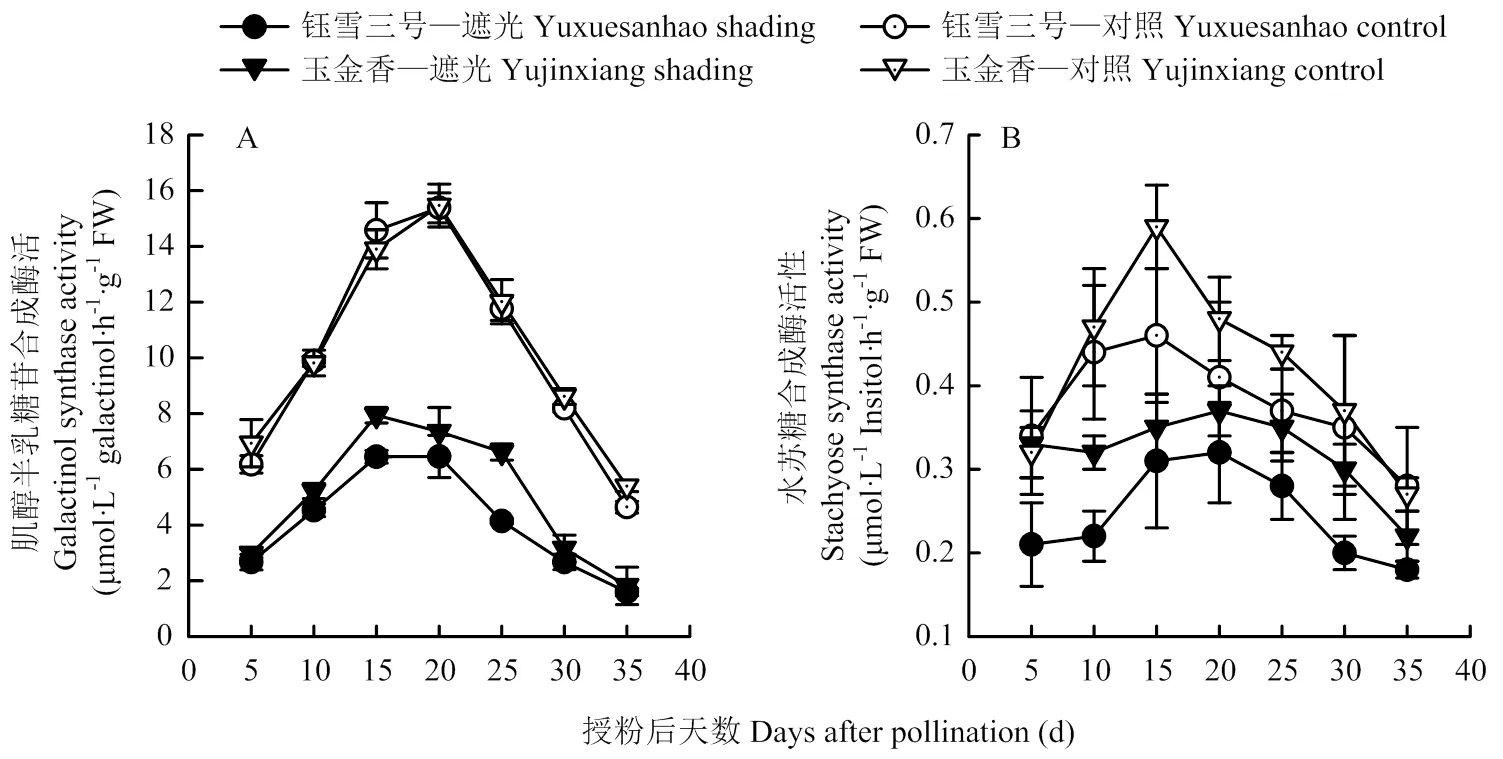
图5 弱光下甜瓜叶片肌醇半乳糖苷合成酶和水苏糖合成酶酶活性
3 讨论
3.1 不同耐性甜瓜品种同化物合成能力对弱光的响应
在弱光条件下,植物要正常生长发育就必须尽可能多地吸收和捕获光能,以利于CO2的固定和碳水化合物的积累,而光合作用参数是反映植物光能利用能力和效率的重要指标[7-9,14]。遮光处理下,甜瓜叶片叶绿素a/b下降,气孔导度Gs下降,净光合速率Pn降低,胞间CO2浓度Ci升高,说明光合速率下降的主要限制因素不是CO2浓度,而是光能的供应,是非气孔限制产生的结果。叶绿素a/b降低有利于植物吸收环境中的红光,维持光系统Ⅰ与光系统Ⅱ之间的能量平衡,增强植物对弱光环境的生态适应性[10]。弱光适应性较强的品系,在弱光条件下叶绿素a/b水平较低、Pn降幅较小[26-27],与‘玉金香’相符,说明耐弱光品种可以通过调整色素含量及比例来弥补光照不足,在弱光条件下仍然具有较强的光合能力。
蔗糖是光合作用最重要的产物,植物叶片的蔗糖含量取决于蔗糖合成酶(SPS、SS)和分解酶(AI、NI)的作用及用于合成棉子糖和水苏糖的量。只有叶片蔗糖合成酶的活性高于分解酶活性,才能积累足够的蔗糖用来合成棉子糖和水苏糖[5]。叶片光合能力降低的直接结果是碳水化合物合成减少,遮光处理后甜瓜叶片果糖、葡萄糖和蔗糖含量均降低,但葡萄糖和果糖的降幅均小于蔗糖。弱光降低油桃叶片中蔗糖含量,但对葡萄糖和果糖含量影响较小,葡萄糖和果糖与蔗糖的比值高于对照,有利于植物抵御弱光环境的胁迫[28]。‘玉金香’叶片蔗糖降幅显著低于‘钰雪三号’,说明遮光处理对耐弱光品种光合产物合成的影响较小,不耐弱光品种‘钰雪三号’蔗糖含量大幅下降对棉子糖和水苏糖装载及同化物输出不利。
遮光处理后,两个甜瓜品种叶片蔗糖磷酸合成酶SPS和蔗糖合成酶SS活性均明显下降,‘玉金香’降幅均显著低于‘钰雪三号’,说明弱光下耐弱光品种‘玉金香’仍然具有相对较强的蔗糖合成能力。弱光下蔗糖合成酶活性降低可以控制蔗糖合成和向外运输的数量,保持叶片糖分代谢的平衡。SPS还调控着碳源在蔗糖和淀粉之间的分配,蔗糖和淀粉的比值与SPS酶活性呈正相关,SPS是叶片乃至整个植株光合碳同化去向的一个重要决定因素[29-30]。遮光处理后,两个品种淀粉含量在授粉后25 d内均高于对照,不耐弱光品种‘钰雪三号’叶片蔗糖含量最低,而淀粉含量却最高,‘钰雪三号’叶片淀粉含量的增幅和SPS酶活性的降幅均显著高于‘玉金香’,说明叶片中蔗糖合成受阻之后,同化物主要在叶绿体中以淀粉形式积累起来。转化酶AI和NI催化蔗糖转化为葡萄糖和果糖,以满足植物对新陈代谢的能量需求,弱光降低转化酶活性[14,29],Pn较低时,较高的蔗糖降解状态会对植物的生长产生不利的影响[14]。
3.2 不同耐性甜瓜品种同化物装载能力对弱光的响应
肌醇半乳糖苷是目前所知唯一的半乳糖基供体,肌醇半乳糖苷合成酶(GS)是棉子糖和水苏糖合成的关键酶[25]。在大豆种子中,GS酶活性的迅速提高先于棉子糖和水苏糖的积累,GS在代谢中调控碳源在蔗糖和棉籽糖、水苏糖之间的分配[31-32]。遮光处理后,两个品种叶片肌醇半乳糖苷含量和GS酶活性均降低,品种间差异不显著,说明弱光下肌醇半乳糖苷的合成不是造成棉子糖和水苏糖装载存在品种间差异的关键因素。
正常光照下,叶片棉子糖和水苏糖含量降低可能与叶片同化物的输出有关,‘玉金香’叶片棉子糖和水苏糖含量均显著高于‘钰雪三号’,STS酶活性在15—25d也显著高于‘钰雪三号’,而‘钰雪三号’叶片内蔗糖和肌醇半乳糖苷含量在授粉后10d内却显著高于‘玉金香,推测是‘钰雪三号’叶片棉子糖和水苏糖装载受抑制使两种基质累积。遮光处理使两个甜瓜品种叶片棉子糖和水苏糖的含量均降低,然而在其他的逆境胁迫下,比如低温[33-34]、水分亏缺[35]、热冲击[36],叶片内的棉子糖和水苏糖含量却上升。HAO等[33]认为低温阻碍了叶片中共质体途径的装载,使棉子糖和水苏糖的输出受阻而积累,而弱光下棉子糖和水苏糖的含量降低与光合产物的合成减少有关。棉子糖合成酶活性不稳定,研究较少,所以用水苏糖合成酶活性来分析装载能力的高低。遮光处理后,‘钰雪三号’叶片STS酶活性降幅显著高于‘玉金香’,耐弱光品种‘玉金香’在遮光条件下仍然具有较强的水苏糖装载能力。水苏糖装载完成之后,由韧皮部迅速输出到库器官,为库器官生长发育提供物质保证。
4 结论
遮光处理后,‘玉金香’叶片净光合速率,蔗糖和水苏糖含量,蔗糖磷酸合成酶、蔗糖合成酶和水苏糖合成酶活性下降幅度均小于‘钰雪三号’,说明耐弱光品种‘玉金香’叶片具有较强的同化物合成和装载能力,在弱光胁迫下同化物输出能力强于不耐弱光品种。
[1] LANOUE J, LEONARDOS E D, GRODZINSKI. Effects of light quality and intensity on diurnal patterns and rates of photo-assimilate translocation and transpiration in tomato leaves., 2018, 9: 756-770.
[2] 刘婷, 刘卫国, 任梦露, 杜勇利, 邓榆川, 邹俊林, 方萍, 杨文钰. 遮荫程度对不同耐荫性大豆品种光合及抗倒程度的影响. 中国农业科学, 2016, 49(8): 1466-1475.
LIU T, LIU W G, REN M L, DU Y L, DENG Y C, ZOU J L, FANG P, YANG W Y. Effects of shade degrees on photosynthesis and lodging resistance degree of different shade tolerance soybean., 2016, 49(8): 14666-1475. (in chinese)
[3] 张诚君, 王磊, 段书延, 宋士任, 马超, 赵丽萍, 张才喜, 王世平, 许文平. ‘巨峰’葡萄盛花后弱光胁迫对叶片光合生理及光合酶基因表达的影响. 园艺学报, 2017, 44(8): 1450-1462.
Zhang C J, Wang L, Duan S Y, Song S R, Ma C, Zhao L P, Zhang C X, Wang S P, Xu W P. Effect of low light stress on photosynthetic physiology and gene expression in ‘Khoyo’ grapevine after blooming., 2017, 44(8): 1450-1462. (in chinese)
[4] OHKAWA W, KANAYAMA Y, DAIBO N, SATO T, NISHIYAMA M, KANAHAMA K. Metabolic process of the14C-sugars on the translocation pathways of cucumber plants., 2010, 124(1): 46-50.
[5] HU L P, MENG F Z, WANG S H, SUI X L, LI W, WEI Y X, SUN J L, ZHANG Z X. Changes in carbohydrate levels and their metabolic enzymes in leaves, phloem sap and mesocarp during cucumber (L) fruit development., 2009, 121(2): 131-137.
[6] TURGEON R, MEDVILLE R, NIXON K C. The evolution of minor vein phloem and phloem loading., 2001, 88(8): 1331-1339.
[7] 李伟, 眭晓蕾, 王绍辉, 关秋竹, 胡丽萍, 周明, 孟凡珍, 张振贤. 黄瓜幼苗不同叶位叶片光合特性对弱光的响应. 中国农业科学, 2008, 41(11): 3698-3707.
Li W, Sui X L, Wang S H, Guan Q Z, Hu L P, Zhou M, Meng F Z, Zhang Z X. Effects of low light on photosynthetic characteristics of different position leaves of cucumber seedlings., 2008, 41(11): 3698-3707. (in Chinese)
[8] 秦玉芝, 邢铮, 邹剑锋, 何长征, 李炎林, 熊兴耀. 持续弱光胁迫对马铃薯苗期生长和光合特性的影响. 中国农业科学,2014, 47(3): 537-545.
Qin Y Z, Xing Z, Zou J F, He C Z, Li Y L, Xiong X Y. Effects of sustained weak light on seedling growth and photosynthetic characteristics of potato seedlings., 2014, 47(3): 537-545. (in Chinese)
[9] STAGNARI F, DI MATTIA C, GALIENI A, SANTARELLI V, D'EGIDIO S, PAGNANI G, PISANTE M. Light quantity and quality supplies sharply affect growth, morphological, physiological and quality traits of basil., 2018, 122(5): 277-289.
[10] 张志刚, 尚庆茂. 低温、弱光及盐胁迫下辣椒叶片的光合特性. 中国农业科学, 2010, 43(1): 123-131.
ZHANG Z G, SHANG Q M. Photosynthetic characteristics of pepper leaves under low temperature, weak light and salt stress., 2010, 43(1): 123-131. (in Chinese)
[11] Liang W J, Wang M L, Ai X Z. The role of calcium in regulating photosynthesis and related physiological indexes of cucumber seedlings under low light intensity and suboptimal temperature stress., 2009, 123(1): 34-38.
[12] TROUWBORST G, OOSTERKAMP J, HOGEWONING S W, HARBINSON J, LEPEREN W V. The responses of light interception, photosynthesis and fruit yield of cucumber to LED-lighting within the canopy., 2010, 138(3): 289-300.
[13] Sui X L, Mao S L, Wang L H, Zhang B X, Zhang Z X. Effect of low light on characteristics of photosynthesis and chlorophyll a fluorescence during leaf development of sweet pepper., 2012, 11(10): 1633-1643.
[14] 米国全, 刘丽英, 金宝燕, 张振贤,任华中. 弱光对不同生态型黄瓜幼苗光合速率及蔗糖代谢相关酶活性的影响. 华北农学报, 2011, 26(1): 146-150.
Mi G Q, Liu L Y, Jin B Y, Zhang Z X, Ren H Z. Influence of low light on net photosynthesis rate and activities of enzymes related to sucrose metabolism in cucumber seedlings., 2011, 26(1): 146-150. (in Chinese)
[15] 徐心诚. 弱光对温室黄瓜叶片和茎中可溶性糖含量的影响. 江苏农业学报, 2015, 31(6): 1448-1450.
Xu X C. Soluble sugar contents in leaves and stems of greenhouse cucumber exposed to weak light., 2015, 31(6): 1448-1450. (in Chinese)
[16] 齐红岩, 李超. 两个品种番茄短期内对不同程度弱光胁迫的反应. 西南农业学报, 2011, 24(2): 523-528.
Qi H Y, Li C. Response to different levels of low light stress of two varieties or tomato.2011, 24(2): 523-528.(in Chinese)
[17] CORELLI GRAPPADELLI L, LAKSO A N, FLORE J A. Early season patterns of carbohydrate partitioning in exposed and shaded apple branches., 1994, 119(3): 596-603.
[18] 薛正平, 李军, 张皓, 赵胜荣, 辛跳儿, 高宇, 王继英. 遮光对大棚黄瓜生长、花果及产量影响试验. 上海交通大学学报(农业科学版), 2014, 32(4): 54-59.
Xue Z P, Li J, Zhang H, Zhao S R, Xin T E, Gao Y, Wang J Y. Effect of shadow condition on the growth, fruit and yield in greenhouse cucumber., 2014, 32(4): 54-59. (in Chinese)
[19] NISHIZAWA T, ITO A, MOTOMURA Y, ITO M, TOGASHI M. Changes in fruit quality as influenced by shading of netted melon plants (L. ‘Andesu’ and ‘Luster’ )., 2000, 69(5): 563-569.
[20] ARGADE M B, KADAM J H, GARANDE V K, PATGAONKAR D R, PATIL V S, SONAWANE P N. Effect of different shading intensities on growth and yield of cherry tomato., 2018, 10(1): 352-357.
[21] WANG F, SANZ A, BRENNER M L, SMITH A. Sucrose synthase, starch accumulation, and tomato fruit sink strength., 1993, 101(2): 321-327.
[22] 赵越, 魏自民, 马凤鸣. 铵态氮对甜菜蔗糖合成酶和蔗糖磷酸合成酶的影响. 中国糖料, 2003(3): 1-5.
Zhao Y, Wei Z M, Ma F M. Influence of ammoniacal nitrogen on sucrose synthase and sucrose phosphate synthase in sugar beet., 2003(3): 1-5. (in Chinese)
[23] LOWELL C A, TOMLINSON P T, KOCH K E. Sucrose-metabolizing enzymes in transport tissues and adjacent sink structures in developing citrus fruit., 1989, 90(4): 1394-1402.
[24] HUBER J L A, PHARR D M, HUBER S C. Partial purification and characterization of stachyose synthase in leaves ofand: Utilization of a rapid assay for myo-inositol., 1990, 69(2): 179-188.
[25] SMITH P T, KUO T M, CRAWFORD C G. Purification and characterization of galactinol synthase from mature zucchini squash leaves., 1991, 96(3): 693-698.
[26] 王学文, 王玉珏, 付秋实, 赵冰, 郭仰东. 弱光逆境对番茄幼苗形态、生理特征及叶片超微结构的影响. 华北农学报, 2009, 24(5): 144-149.
Wang X W, Wang Y J, Fu Q S, Zhao B, Guo Y D. Effects of low light stress on morphological trait, physiological characters and leaf ultrastructure of tomato (L.) seedlings., 2009, 24(5): 144-149. (in Chinese)
[27] 眭晓蕾, 张振贤, 张宝玺, 毛胜利, 王立浩, 李伟. 不同基因型辣椒光合及生长特性对弱光的响应. 应用生态学报, 2006, 17(10): 1877-1882.
Sui X L, Zhang Z X, Zhang B X, Mao S L, Wang L H, Li W. Photosynthetic and growth characteristics of different ecotype capsicum under weak light., 2006, 17(10): 1877-1882. (in Chinese)
[28] WANG X Q, HUANG W D, ZHAN J C. Effect of low light on the activity of sucrose synthase in leaves of nectarine., 2005, 80(3): 358-362.
[29] CALTIER N, FOYER C H, HUBER J, VOELKER T A, HUBER S C. Effects of elevated sucrose-phosphate synthase activity on photosynthesis, assimilate partitioning, and growth in tomato (var UC82B)., 1993, 101(2): 535-543.
[30] STEVEN C H, JOAN L H. Role of sucrose-phosphate synthase in sucrose metabolism in leaves., 1992, 99(4): 1275-1278.
[31] HANDLEY L W, PHARR D M, MCFEET ERS R F. Relationship between galactinol sy nthase activity and sugar composition of leaves and seeds of several crop species., 1983, 108(4): 600-605.
[32] SARAVITZ D M, PHARR D M, CARTER T E. Galactinol synthase activity and soluble sugars in developing seeds of four soybean genotypes., 1987, 83(1): 185-189.
[33] HAO J H, YANG R, FANG K F, WANG J L, ZHANG Q, SHEN Y Y, LI T L. Low night temperatures inhibit galactinol synthase gene expression and phloem loading in melon leaves during fruit development., 2014, 61(2): 178-187.
[34] MIAO M M, XU X F, CHEN X H, XUE C L, CAO B S. Cucumber carbohydrate metabolism and translocation under chilling night temperature., 2007, 164(5): 621-628.
[35] SHAUN P S G, MUNDREE J A, THOMSON J M, FARRANT J M. Protection mechanisms in the resurrection plant Xerophyta viscosa (Baker): Both sucrose and raffinose family oligosaccharides (RFOs) accumulate in leaves in response to water deficit., 2007, 58(8): 1947-1956.
[36] AYAKO N Y, YUKINORI Y, SHIGERU S. The contribution of carbohydrates including raffinose family oligosaccharides and sugar alcohols to protection of plant cells from oxidative damage., 2008, 3(11): 1016-1018.
(责任编辑 赵伶俐)
Responses of Leaf Assimilate Export to Lowlight Stress in Melon
YANG LiuYan, CHEN JingJing, CHEN NianLai
(College of Horticulture, Gansu Agricultural University, Lanzhou 730070)
【Objective】The objective of this study is to evaluate the responses of melon leaf photosynthesis, sucrose synthesis and stachyose loading to low light stress during fruit development stage, and the difference in assimilate export between lowlight tolerance and sensitive cultivars, to support the further analysis of sugar unloading and accumulation in fruits of the lowlight tolerant cultivars. 【Method】A low light-tolerant cultivar (Yujinxiang) and a low light-sensitive cultivar (Yuxuesanhao) of melon (L.) were used as materials. The melon plants were cultured in greenhouse and were shaded after pollination. And then the mature leaves from the fruit nodes were collected every five days for measurement. The leaf chlorophyll content, gas exchange parameters, levels of soluble sugars (fructose, glucose, sucrose, galactinol, raffinose, stachyose) and starch, activities of sucrose phosphate synthase (SPS), sucrose synthase (SS), acid invertase (AI), neutral invertase (NI), galactinol synthase (GS) and stachyose synthase (STS) were determined. 【Result】Under shading condition, leaf chlorophyll a/b, net photosynthetic rate (Pn), and contents of glucose, fructose and sucrose in the leaves of both cultivars decreased, but the starch level increased. The reduction of chlorophyll a/b in Yujinxiang leaves (10.0%) was larger than that in Yuxuesanhao leaves (5.8%), but the reduction of leaf Pn, sucrose content and increment of starch content were less in Yujinxiang (30.3%, 30.9% and 3.6%, respectively) than those of Yuxuesanhao (45.2%, 60.6% and 20.4%). Activities of sucrose metabolism enzymes (SPS, SS, AI and NI) decreased after shading, and the reduction of SPS and SS activities were significantly less in Yujinxiang (16.5% and 30.0%) than in Yuxuesanhao (31.6% and 40.5%), but the reduction of AI and NI activities was larger in Yujinxiang (23.8% and 12.7%) than in Yuxuesanhao (18.3% and 1.8%). Galactinol level and GS activity decreased after shading, but no significant genotypic difference was observed. Contents of raffinose and stachyose as well as the activity of STS all decreased after shading. The reduction of raffinose content was larger, the reduction of stachyose content and STS activity was less in Yujinxiang (65.3%, 79.5% and 23.8%, respectively) than those in Yuxuesanhao (35.0%, 83.3% and 32.4%). 【Conclusion】The reduction of leaf sucrose synthesis and stachyose loading after shading was less in Yujinxiang than in Yuxuesanhao, which indicates that the low light tolerant cultivar has stronger leaf assimilate export capacity than the sensitive cultivar under shading.
melon; shading; gas exchange parameters; sucrose synthesis; stachyose loading; assimilates export
2017-12-14;
2018-01-25
甘肃省农业生物技术研究与应用开发项目(GNSW-2015-17)
杨柳燕,E-mail:zyyangliuyan@163.com。
陈年来,E-mail:chennl@gsau.edu.cn
10.3864/j.issn.0578-1752.2018.13.011

