极小种群野生植物海南假韶子群落土壤特性研究
(三亚市林业科学研究院,海南 三亚 572000)
海南假韶子Paranephelium hainanensis为无患子科常绿乔木树种,为我国特有种。因植株数量极为稀少、分布区域狭小,被列为我国II级稀有濒危保护植物和国家重点保护野生植物(第一批)》[1],在IUCN濒危物种红色名录中被确定为极危种[2],目前仅分布于海南岛崖县[3]。
土壤是植物生长的重要物质基础,不仅为植物生长提供所必需的水分、矿质营养元素、有机质和微生物,其养分及含量影响着森林的结构及演替,也是生态系统中物质和能量交换的重要场所[4-6]。土壤酶活性和土壤微生物生物量均是土壤生态系统的重要组成成分,在有机质分解、养分循环和植物营养等过程中发挥着关键作用,它们共同推动着土壤的物质转化与能量流动[6-10],反映了土壤肥力的大小。土壤微生物通过自身的分解和代谢作用增加土壤养分含量、提高土壤酶的活性,进而为植被提供丰富的营养成分[11]。迄今,围绕海南假韶子开展的研究主要集中在叶片脂溶性可挥发部分的化学成分[12]、叶子脂溶性木栓烷型三萜化合物[13]。然而,有关海南假韶子种群土壤特性方面的研究尚未见报道。本研究针对海南假韶子所在海南岛三亚市落笔洞和亚龙湾热带天堂森林公园两个自然种群开展,比较分析了两个群落的土壤理化性质、土壤微生物和及土壤酶活性的差异,了解海南假韶子立地环境土壤特征以及群落土壤营养元素的丰缺情况,为极危树种海南假韶子的迁地保护提供依据。
1 研究地概况
研究地位于三亚市落笔洞和亚龙湾热带天堂森林公园。落笔洞位于三亚市吉阳区(N18°19′54″,E109°32′47″),亚龙湾热带天堂森林公园位于三亚市东南方向(N18°15′27″,E109°37′57″),属热带海洋季风气候,全年暖热,雨量充沛,年日照时数为1 750~2 650 h,年平均气温26.5 ℃。落笔洞为天然的石灰岩地区,以石灰岩山地次生林为主,郁闭度为0.7左右;森林公园主要森林类型为次生阔叶林,郁闭度达0.9以上。两个调查样地的土壤母质均为花岗岩,表土层较薄,渗透性较强,属薄有机质薄土层粗砂褐色粘红壤。
2 研究方法
2.1 土壤采集
2017年 3 月对海南假韶子所在两个群落及无海南假韶子植株分布的次生林作为对照群落,分别设置4个10 m×10 m样方,在每个样方内随机选取5处具有代表性点采集样方土(即非根区土)。在海南假韶子所在两个群落中的每个样方选取3~5株海南假韶子植株采集根区表土,均取表层土壤0~10 cm采样,充分混合取土样,其中部分鲜土带回实验室后置于4 ℃保存供土壤微生物与土壤酶活性的测定;其余土样经过除去石块、根系等杂物后,磨碎过筛,装袋待测定土壤理化性质等。
2.2 土壤理化性质的测定
采用铝盒烘干法测定土壤自然含水率;采用电导率测定仪测定土壤电导率;采用玻璃电极法测定土壤pH值;采用高温外热重铬酸钾氧化-容量法测定土壤有机质(g·kg-1);采用开氏-蒸馏滴定法测定土壤全氮(g·kg-1);采用氢氧化钠熔融-钼锑抗比色法测定土壤全磷(g·kg-1);采用氢氧化钠熔融-火焰原子吸收分光光度法测定土壤全钾(g·kg-1);采用碱解扩散法测定碱解氮(g·kg-1);采用 0.5 mol·L-1NaHCO3溶液提取土壤速效磷;采用钼锑抗比色法测定速效磷(mg·kg-1);采用1 mol·L-1中性NH4OAC溶液浸提土壤速效钾,火焰光度法测定速效钾(mg·kg-1);采用1 mol·L-1NH4OAC浸提,EDTA络合滴定,火焰原子吸收分光光度法测定交换性钙和交换性镁(mg·kg-1);具体测定方法参见鲁如坤[14],所有样品做3个平行,取平均值作为样品的最终测定结果。
2.3 土壤微生物的测定
土壤微生物生物量碳(Cmic)和微生物生物量氮(Nmic)采用氯仿熏蒸浸提法测定。Cmic和Nmic(mg·kg-1) 计 算 方 法 如 下:Cmic=2.22 EC,Nmic=2.22 EN,式中,EC、EN分别为熏蒸和未熏蒸土样浸提液的有机碳、全氮的差值;2.22为校正系数[15],所有样品做3个平行,取平均值作为样品的最终测定结果。
2.4 土壤酶活性的测定
以容量法测定过氧化氢酶活性,以30 min后1 g 土壤的 0.1 N(即 0.02 mol·L-1)KMnO4的毫升数表示;靛酚蓝比色法测定脲酶活性,以24 h后1 g土壤中NH3-N的毫克数表示;磷酸苯二钠比色法测定磷酸酶活性,以24 h后1 g土壤中消耗五氧化二磷的毫克数表示[16],所有样品做3个平行,取平均值作为样品的最终测定结果。
2.5 数据处理与分析
试验数据用Excel 2010进行初步处理,通过SPSS21.0软件的单因素方差分析(ANOVA)比较检验和相关性分析;以各土壤特征指标通过CANOCO4.5软件完成PCA主成分(Principal component analysis)分析。
3 结果与分析
3.1 极小种群海南假韶子群落的土壤物理性质
从非根区土的物理性质来看,落笔洞和森林公园海南假韶子群落非根区土的土壤含水量、土壤容重和土壤电导率与对照林分的差异未达到显著水平(见表1)。从根区土的物理性质来看,森林公园群落的土壤含水量(28.12%)和土壤电导率(120.24 μs·cm-1)显著高于落笔洞,而两个群落根区土之间的土壤容重不显著。与群落非根区土相比,落笔洞根区土土壤含水量显著高于非根区,森林公园土壤含水量和土壤电导率均显著高于非根区土。

表1 落笔洞和森林公园海南假韶子群落非根区土和根区土的土壤物理性质†Table 1 The soil physical properties of non-planted soil and rhizospheric soil of Paranephelium hainanensis communities in Luobidong and forest park
3.2 极小种群海南假韶子群落的土壤化学性质
无论是非根区土,还是根区土,海南假韶子所在落笔洞和森林公园群落与对照林分的土壤pH值均呈酸性。从非根区土来看,两个群落的土壤有机质、碱解氮、有效磷、速效钾、交换性钙和交换性镁含量均高于对照林分。方差分析结果表明,两个群落非根区土的土壤碱解氮、有效磷和交换性钙含量显著高于对照林分。从根区土的土壤化学性质来看,森林公园群落根区土的土壤有机质、全钾、碱解氮和交换性镁含量均显著高于落笔洞群落,而落笔洞群落的全氮、全磷、有效磷、速效钾和交换性钙含量高于森林公园群落(见表2)。
与非根区土相比,落笔洞根区土的土壤有机质、全氮、碱解氮、速效钾、交换性钙和交换性镁含量显著高于非根区;而森林公园根区土的土壤有机质和交换性钙含量显著高于非根区土(见表2)。可见,海南假韶子所在群落根区土的土壤化学性质与非根区土存在较大的差异。
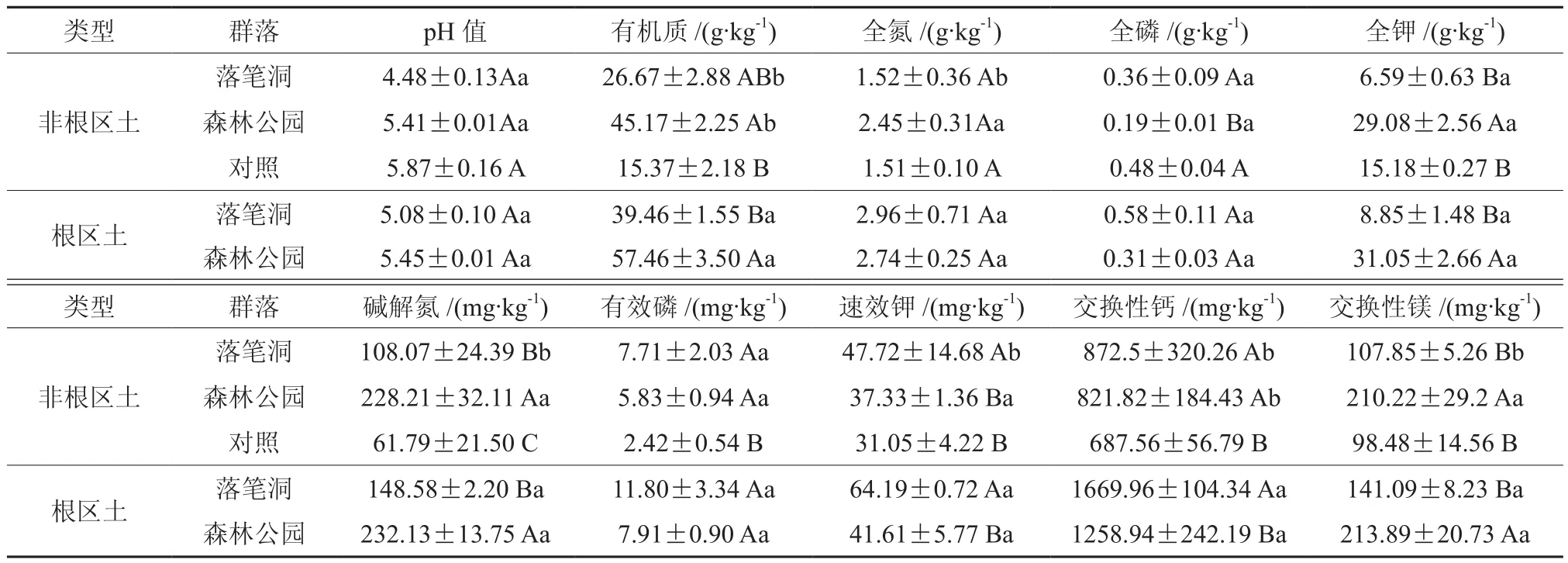
表2 落笔洞和森林公园海南假韶子群落非根区土和根区土的土壤化学性质†Table 2 The soil chemical properties of non-planted soil and rhizospheric soil of Paranephelium hainanensis communities in Luobidong and forest park
3.3 极小种群海南假韶子群落的土壤微生物生物量比较
土壤微生物生物量检测结果显示(见表3),海南假韶子所在群落非根区土的土壤微生物碳和氮生物量含量均高于对照林分;且森林公园群落的土壤微生物碳和氮生物量含量显著高于落笔洞群落。从根区土的土壤微生物量来看,微生物生物量碳含量(1 081.92 mg·kg-1)、微生物生物量C/N(15.79)以落笔洞群落根区土较高,微生物生物量氮含量(118.14 mg·kg-1)以森林公园群落较高。与非根区土相比,落笔洞根区土的土壤微生物碳和氮生物量含量均显著高于非根区土;森林公园根区土的土壤微生物氮含量显著低于非根区,微生物生物量碳含量和微生物生物量C/N与非根区土的差异不显著。
3.4 极小种群海南假韶子群落的土壤酶活性比较
由表4可以看出,两个群落非根区的土壤酸性磷酸酶和脲酶活性高于对照林分,且森林公园群落的土壤酸性磷酸酶和脲酶活性显著高于落笔洞群落非根区土,但两个群落的土壤过氧化氢酶活性与对照林分差异不显著。从根区土的土壤酶活性来看,森林公园群落的土壤酸性磷酸酶(726.18 mg·kg-1) 和 脲 酶(1 445.63 mg·kg-1) 的活性显著高于落笔洞群落。与非根区土的土壤酶活性相比,两个群落根区土的土壤过氧化氢酶和脲酶活性均显著高于非根区土。

表3 落笔洞和森林公园海南假韶子群落的土壤微生物生物量比较†Table 3 The soil microbial biomass of Paranephelium hainanensis communities in Luobidong and forest park

表4 落笔洞和森林公园海南假韶子群落土壤酶活性比较†Table 4 The soil enzyme activities of Paranephelium hainanensis communities in Luobidong and forest park
3.5 土壤理化性质与土壤微生物生物量、酶活性PCA分析
将两个群落土壤根区土和非根区土的土壤理化性质、土壤微生物生物量和土壤酶活性指标进行主成分分析(PCA)。在图 1中,每个点代表1个样品(每个样地均有4个样品),两个点之间的距离越近,反映两个样品的土壤特性差异越小。由图可以看出,第一和第二主成分的累积贡献率为83.8%,其中PC1占总方差的60.8%,PC2占方差的23%。落笔洞群落根区土和非根区图的样品均分布在PCA图的右边,森林公园群落根区土和非根区图的样品分布在PCA图的左边;两个群落的根区土和非根土样品均较好地聚为一类(图1)。
由图1还可以看出,落笔洞非根区的影响因子主要为土壤全氮和交换性钙含量;土壤pH、全磷、速效钾和微生物生物量C/N为落笔洞根区土的主要影响因子;森林公园非根区土的因子载荷量较高的有土壤容重、土壤含水量、过氧化氢酶、脲酶、微生物生物量碳、全钾、碱解氮和交换性镁含量;而根区土的主要影响因子为土壤电导率、土壤有机质和酸性磷酸酶。
4 讨论与结论
4.1 讨 论
4.1.1 不同群落土壤理化性质的差异比较
土壤物理特性的大小决定土壤的持水能力、溶解矿质元素的性能和植物根系的吸水能力等,从而影响着植物的生长和土壤肥力[17]。Reisinger et al.[18]研究表明,大多数植物根系正常生长的土壤容重在1.14~1.26 g·cm-3;当土壤容重在1.4~1.5 g·cm-3时,植物根系难以进入,而大于1.6 g·cm-3时为根系穿插的临界点。本研究结果显示,海南假韶子群落所在分布区落笔洞群落较干燥且通透性不良,土壤含水量为16.56~20.93%,土壤容重为 1.37~ 1.60 g·cm-3,土壤电导率为 47.44~ 55.11 μs·cm-1之间;而森林公园群落土壤较湿润(土壤含水量为21.49~28.12%、土壤容重为1.44~1.49 g·cm-3和土壤电导率 94.35~ 120.24 μs·cm-1)。两个群落的土壤物理性质差异反映了它们的林分结构、海拔高度等因子不同。本研究结果表明,海南假韶子群落的土壤速效性养分含量较低,特别是落笔洞群落,这可能与土壤pH值和地形地貌有关。与华南地区的土壤酸性相近,两个群落土壤为花岗岩发育而来,其土壤酸度可能是母岩的固有性质[19]。研究表明,土壤碱解氮为限制植物生长的重要因子[20],全磷为我国南亚热带森林的限制因子[21]。我们的研究结果显示,海南假韶子群落土壤全磷含量较为缺乏,两个分布区群落根区土的土壤有机质、全氮、全磷和全钾含量均高于非根区土,反映了海南假韶子根区土的土壤肥力较高。总体来看,海南假韶子所在落笔洞群落的土壤肥力低于森林公园,表明了海南假韶子生长需要较高的土壤肥力,与实地调查两个群落的结构状况相符合。

图1 落笔洞和森林公园群落土壤理化性质、土壤微生物和土壤酶活性的PCA分析Fig.1 PCA biplot of soil physical and chemical characteristics, soil microbial biomass, and soil enzyme activities of Luobidong and forest park communities
4.1.2 不同群落土壤微生物和土壤酶活性的差异比较
本研究结果表明,海南假韶子所在群落土壤特性与无海南假韶子自然分布群落的土壤性质存在一定差异,而群落间的根区土与非根区的化学性质差异不明显,但群落间的根区土与非根区土的土壤微生物碳和微生物氮含量差异较大,均表现出根区土的土壤微生物生物量高于非根区土,反映了两个海南假韶子所在群落归还给土壤的植物残体数量和质量上存在差异,其原因可能与群落植被对土壤微生物群落的影响很大程度上与土壤肥力相关。陈宏峻等人研究表明,土壤微生物生物量是反映土壤的物质和能量代谢旺盛的程度,同时也反映土壤的肥力状况[22]。由此可见,我们的研究结果表明森林公园的土壤微生物生物量较高,明显地促进土壤有机质的矿化及土壤微生物活跃度,从而提高群落土壤的肥力。
土壤酶是土壤中的生物催化剂,直接参与土壤营养元素的有效转化过程,对维持森林中土壤生态系统的稳定起着重要作用[23-25]。本研究结果显示,两个群落根区土的土壤酶活性高于非根区土,森林公园根区土的土壤酸性磷酸酶和脲酶活性均高于落笔洞根区土,其原因可能与群落植被不同有关,不同植被植物根系分泌物、枯枝凋落物积累不同,导致群落的土壤生化反应的方向和强度不同。该研究结果与刘淑慧等[26]、邵文山等[27]人的研究结果相近。
4.1.3 不同群落土壤理化性质、土壤微生物和酶活性的相关分析
森林土壤酶活性是森林土壤生物活动的主要产物,与森林土壤理化性质、微生物含量等密切相关,可作为生物活性物质直接或间接地参与土壤养分转化与根系吸收的指标。PCA分析结果表明,两个群落的土壤理化性质与土壤酶活性、微生物生物量数量之间存在密切关系,与赵维娜等[28]的研究结果一致。然而,不同群落(落笔洞和森林公园)、不同类型(根区土和非根区)的土壤影响因子存在差异;落笔洞群落根区土的土壤影响因子主要为土壤pH值、全氮、全磷、速效钾、交换性Ca含量和土壤微生物生物量C/N,非根区土土壤影响因子主要为土壤全氮和交换性Ca含量;森林公园群落根区土的主要影响因子为土壤电导率、土壤有机质和酸性磷酸酶,土壤容重、土壤含水量、过氧化氢酶、脲酶等为森林公园非根区土的土壤影响因子。PCA分析结果显示,用森林公园群落的土壤微生物生物量和土壤酶活性的总量来表征土壤肥力状况较好,它们之间具有显著相关性,对改善土壤理化性质具有一定的积极作用。与杨媛媛等[29]研究表明滇中地区常绿阔叶林土壤酶活性与土壤理化性质之间有着密切相关关系的结果一致。Galloway研究揭示了土壤成分的组成决定着植物对生存地的偏好[30]。我们实地调查发现,目前所分布海南假韶子群落生长地的土壤属于砂质壤土,分布在岩石裸露程度较高、土层薄的裸岩地段。因此,群落的土壤微生物生物量和土壤酶对土壤环境的净化、土壤生态环境的保护和保持整个生态平衡具有重要意义。因此,保护好海南假韶子群落的生态系统为一项长期的任务。
4.2 结 论
(1)海南假韶子所在落笔洞和森林公园群落土壤呈酸性,全磷含量较为缺乏;两个群落非根区土、根区土间的土壤含水量、土壤容重和土壤电导率的差异未达到显著水平。两个群落非根区土的土壤有机质、碱解氮、有效磷、速效钾、交换性钙和交换性镁含量均高于对照林分;但森林公园群落根区土的土壤有机质、全钾、碱解氮和交换性镁含量均显著高于落笔洞群落根区土。整体来看,森林公园群落的土壤肥力较高于落笔洞群落。
(2)海南假韶子所在群落非根区土的土壤微生物生物量、3种土壤酶活性均高于对照林分。落笔洞群落根区土的土壤微生物碳含量(1 081.92 mg·kg-1)和微生物生物量 C/N(15.79)高于森林公园群落根区土。森林公园群落根区土的土壤酸性磷酸酶(726.18 mg·kg-1)和脲酶(1 445.63 mg·kg-1)活性显著高于落笔洞群落。与群落非根区土的土壤微生物生物量和土壤酶活性相比,两个群落根区土的土壤微生物生物量均高于非根区土,两个群落根区土的土壤过氧化氢酶和脲酶活性均显著高于非根区土。
(3)PCA结果表明,海南假韶子所分布的两个群落对土壤因子响应显著,各群落能较好聚为一类,但同一群落根区土与非根区土对土壤因子响应也不同,各类型也能明显地聚为一类。
[1]于永福.中国野生植物保护工作的里程碑——《国家重点保护野生植物名录(第一批)》出台[J].植物杂志,1999, (5):3-11.
[2]China Plant Specialist Group.Paranephelium hainanensis.In:IUCN 2007.2007 IUCN Red List of Threatened Species.2004.http://www.iucnredlist.org/search/details.php/46620/ all (2008).
[3]中国科学院中国植物志编辑委员会.中国植物志:第47卷[M].北京:科学出版社,1985.
[4]Hancock A M, Witonsky D B, Alkortaaranburu G, et al.Adaptations to climate-mediated selective pressures in Humans[J]. Plos Genetics, 2011, 7(4):1-16.
[5]文 璐,刘晶岚,习 妍,等.北京地区重要古树土壤物理性状分析[J]. 水土保持研究,2011,18(5):175-178.
[6]杨满元,杨 宁,郭 锐,等.衡阳紫色土丘陵坡地恢复过程中土壤微生物数量特征[J].生态环境学报,2013,22(2):229-232.
[7]Steenwerth K L, Jackson L E, Calderon F J, et al.Soil microbial community composition and land use history in cultivated and grassland ecosystems of coastal California[J].Soil Biology &Biochemistry, 2014, 68: 252-262.
[8]杨 宁,杨满元,雷玉兰,等.紫色土丘陵坡地土壤微生物群落的季节变化[J].生态环境学报,2015,24(1): 34-40.
[9]刘 曼,辛 颖,赵雨森.氯氟氰菊酯对水源涵养林土壤微生物及酶活性的影响[J].东北林业大学学报,2013,41(6):80-83.
[10]Timothy M, Veronica A M, Francisco C, et al.Soil enzyme activities, microbial communities, and carbon and nitrogen availability in organic agroecosystems across an intensivelymanaged agricultural landscape[J].Soil Biology & Biochemistry,2014, 68: 252-262.
[11]Gloria Rodríguez-Loinaz, Miren Onaindia, Ibone Amezaga, et a1.Relationship between vegetation diversity and soil functional diversity in native mixed-oak forests [J].Soil Biology &Biochemistry, 2008,40: 49-60.
[12]王天山,陈光英,陆昌生,等.海南假韶子叶子脂溶性可挥发成分气相色谱-质谱联用分析[J].时珍国医国药,2008, 19(9):2239-2240.
[13]王天山,陈光英,钟琼芯,等.海南假韶子叶子中脂溶性木栓烷型三萜化合物[J].时珍国医国药,2010,21(2):322-323.
[14]鲁如坤.土壤农业化学分析方法[M].北京:中国农业科技出版社,2000,1-638.
[15]林启美,吴玉光,刘焕龙. 熏蒸法测定土壤微生物量碳的改进 [J]. 生态学杂志,1999,18(2):63-66.
[16]关松荫.土壤酶及其研究法[M].北京:中国农业出版社,1989.
[17]刘伟钦,陈步峰,尹光天,等.顺德地区不同森林改造区土壤水分-物理特性研究[J].林业科学研究,2003,16(4):495-500.
[18]Reisinger T W,Simmons G L,Pope P E.The impact of timber harvesting on soil properties, and seeding growth in the south[J].Southern Journal of Applied Foresting,2008, (12): 58-67.
[19]Duan L, Huang Y M, Hao J M, et al.Vegetation uptake of nitrogen and base cations in China and its role in soil acidification[J].Science of Total Environment, 2004, 330: 187-198.
[20]Sigurdsoon B D.Environmental control of carbon up-take and growth in a Populus trichocarpa plantation in Iceland[J].Uppsala:Swedish University if Agricultural Sciences, 2001.
[21]刘兴诏,周国逸,张德强,等.南亚热带森林不同演替阶段植物与土壤中N、P的化学计量特征[J].植物生态学报,2010,34(1):64-71.
[22]陈宏峻,李传涵.杉木幼林地土壤酶活性与土壤肥力[J].林业科学研究,1993,6(3):321-326.
[23]Su Y Z, Li Y L, Cui J Y, et al.Inf l uences of continuous grazing and livestock exclusion on soil properties in a degraded sandy grass-land, Inner Mongolia, northern China[J].Catena, 2005,59(3): 267-278.
[24]付美云,杨 宁,杨满元,等.衡阳紫色土丘陵坡地不同恢复阶段土壤微生物与养分的耦合关系[J].生态环境学报,2015,24(1):41-48.
[25]张 浩,莫罗坚,陈葵仙,等.香港人工林改造对林分土壤理化性质、土壤生物生物量及土壤酶活性的季节影响[J].生态环境学报,2016,25(12):1937-1944.
[26]刘淑慧,康跃虎,万书勤,等.松嫩平原盐碱草地主要植物群落土壤酶活性研究[J].土壤,2012,44(4):601-605.
[27]邵文山,李国旗,陈科元,等.荒漠草原4种常见植物群落土壤酶活性比较[J].西北植物学报,2016,36(3):0579-0587.
[28]赵维娜,王艳霞,陈奇伯,等.天然常绿阔叶林土壤酶活性受土壤理化性质、微生物数量影响的通径分析[J].东北林业大学学报,2016,44(1):75-80.
[29]杨媛媛,陈奇伯,黎建强,等.滇中地区常绿阔叶林土壤酶活性与理化因子通径分析[J].中南林业科技大学学报,2017,37(3):86-91,128.
[30]Galloway L F.Maternal effects provide phenotypic adaptation to local environmental conditions[J].New Phytologist, 2005,166(1): 93-100.

