重金属铅对榉树幼树叶绿素荧光参数的影响
邱 岚 ,何 颀 ,黄鑫浩 ,朱 凡 ,王仁杰 ,梁惠子
(1.铜仁学院 农林工程与规划学院,贵州 铜仁 554300;2.郴州市林业科学研究所,湖南 郴州 423000;3.中南林业科技大学 生命科学与技术学院,湖南 长沙 410004)
重金属铅是植物生长的非必需元素,被植物吸收后可通过破坏叶绿体超微结构,进而阻碍光合作用等生理过程最终导致植物生物量、固碳能力下降[1]。同时铅(Pb)又是被纳入国家《重金属污染综合防治十二五规划》重点监控与污染物排放量控制的五种重金属之一[2]。因此,土壤重金属Pb污染的治理一直是近年来修复污染土壤的主要方向之一。
对于重金属污染的治理,目前认为最有效的方法是植物修复技术[3-4]。因此,利用农作物[5-6]、草本植物[7-9]、木本植物[10-12]对重金属污染进行修复已成为近年来植物逆境生理学研究的热点。但利用农作物进行重金属污染土壤修复时,农作物可食部位的重金属含量超标,一旦进入食物链,将会对人类健康造成危害[13-14];草本植物由于生物量较低,根系较浅,只能修复土壤表层的重金属,不能修复深层土壤的重金属污染,不利于重金属的大量吸附,因而限制了在植物修复中的应用[15]。而木本植物由于其生物量高,根系发达,对重金属离子具有较强的吸收和积累能力[16-17],在治理重金属污染方面有着不可替代的作用。对重金属污染土壤的植物修复,尤其在矿区废弃地,需要建立长期稳定的植被群落,这时耐污染木本植物是关键。乔木幼苗生长是树木的起点及生物量形成的关键,其光合生理过程对环境污染胁迫的响应可作为评价树种抗性能力的指标之一。
榉树Zelkova schneideriana为榆科榉属硬阔叶树种,其分布范围广,材质优良,耐烟尘,抗病虫能力较强,深根性,侧根扩张,有改良土壤之效,具有较高的经济、生态、景观利用价值[18]。据报道,榉树对Pb等重金属具有较佳的吸收净化能力,具有作为土壤重金属污染区植物修复树种的潜力[19]。但目前,尚未见利用光合及叶绿素荧光技术来研究榉树耐重金属污染的报道。为此本文以榉树为目标树种,在室内进行盆栽试验,探究榉树叶绿素荧光参数在连续Pb处理胁迫下的变化特征,以及Pb处理胁迫下榉树光系统功能的运行情况,从而揭示榉树对铅胁迫的光合适应能力,为该植物有效利用于重金属污染土壤的修复提供科学依据。
1 材料与方法
1.1 供试材料
本试验采用室内盆栽方法,在中南林业科技大学西园温室中进行。实验土壤均采自于中南林业科技大学校园内10~20 cm表层土,土壤pH值为5.17,土壤全C、全N、全P和Pb含量分别为12.13、0.24、0.16和 0.02 g·kg-1。土壤过 10 mm×10 mm的筛,去除石头等杂物后装入塑料花盆(内径30 cm×高26 cm),每盆装土9 kg。
选取苗高、地径和生长状态基本一致的1年生榉树幼树栽植在盆中,每盆栽种1株。幼树放在室外1个月后移入温室继续培养2个月后,开始进行重金属耐性试验。苗木培养期间,用纯水浇灌。
1.2 试验设计
根据国内土壤环境质量标准[20]和湖南铅锌矿尾矿库铅含量[21],设置本研究Pb2+的浓度,即10 g的PbCl2(分析纯)溶于1 L纯水中配成浓度为10 g/L的PbCl2溶液,然后向每个已生长稳定的榉树花盆中掺入浓度为10 g/L PbCl2溶液400 mL(没有渗出液),掺入时,以植株为中心围绕土壤四周均匀掺入,避免溶液溅到植物表面,每次喷完后第15 d进行相关测定。30 d后再次进行Pb掺入处理,方法同上,依次类推,试验共进行了4次Pb处理。同时设置对照组,即供试植物掺入相同量的纯水(无Pb污染)。为了让掺入的重金属溶液能较好地渗入土壤,每次试验前实施锄草、松土等管理措施。试验期间,用纯水浇灌。每次Pb处理15 d后,测定榉树盆栽土Pb2+的含量,具体见表1。

表1 每次Pb处理后盆栽土Pb2+含量Table 1 The Pb2+ content of potting soil after each Pb treatment mg/Kg
1.3 测定项目和方法
1.3.1 叶绿素荧光参数
采用便携式脉冲调制叶绿素荧光仪(Mini-PAM,德国 WALZ)测定叶绿素荧光参数。每次掺入第15 d在Pb处理组和对照组各选取3盆盆栽,每盆选取长势相同的完全展开叶3片,进行荧光诱导动力学参数测量,测定时间为7:30—11:30。测定方法为:先将叶片暗适应20 min,获得Fo和Fm。利用Mini-PAM测定样品的快速光响应曲线时,设置光化光强度为1、光化光持续时间为40 s、光合有效辐射(PAR)强度分别为0、237、349、553、796、1 129、1 579 μmol·m-2s-1, 得 到 Fs、F′m、F′o、光化学淬灭系数(qP)、非光化学淬灭系数(NPQ)、最大光化学效率(Fv/Fm)、PSII光化学能量转化的有效量子产量Y(II)等各参数。
1.3.2 最大净光合速率
最大净光合速率(Pn)、蒸腾强度(Tr)、胞间CO2浓度(Ci)、气孔导度(Gs)的测定采用Li-6400(Licor,USA)光合仪的2 cm×3 cm标准透明叶室进行。每次掺入第15 d在Pb处理组和对照组各选取3盆盆栽,每盆测完全展开叶3片。测量时间为9:00—11:00。人工设定光强为1 000 μmol·m-2s-1,叶室空气温度测定控制在25~30 ℃,叶室空气湿度控制在40%~60%。气孔限制值(Ls)按照吴克宁等的方法[22]计算:
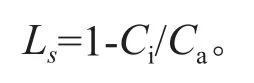
式中:Ci为胞间CO2浓度,Ca为大气CO2浓度。
1.4 数据处理与分析
数据统计分析和作图由SPSS20.0和Sigmaplot 12.5软件完成,用Duncan多重比较检验榉树叶片叶绿素荧光参数和光响应在不同处理和各次处理间的差异显著性,最后用Origin8.0完成参数间对Pb剂量响应的分析。
2 结果与分析
2.1 连续Pb处理下榉树叶片最大净光合速率的变化
从表2中可以看出,在连续Pb处理后,榉树叶片的净光合速率(Pn)和气孔导度(Gs)的变化规律基本一致。与对照相比,均呈下降的趋势,且差异性显著(P<0.05),Pn在第4次处理后,达到了最低值,与对照相比下降了30%,且前3次处理间无差异,在第4次处理后显著低于前3次处理(P<0.05)。气孔导度(Gs)在第3次处理后明显降低,与前面两次处理相比差异显著(P<0.05),但第1和第2次处理、第3和第4次处理间差异性均无显著性。
4次处理后榉树的蒸腾速率(Tr)与对照组相比,均明显低于对照,除了第3次处理后,与对照组相比仅降低12.5%,另外3次处理与对照组相比,显著低于对照(P<0.05)。此外,榉树的蒸腾速率(Tr)在各处理间随着处理次数的增加呈下降趋势,但第1和第2次处理、第3和第4次处理间差异性均无显著性。
胞间CO2浓度(Ci)在4次处理后与对照组相比,均显著高于对照。各处理间的Ci随着处理次数的增加呈上升趋势,即第1次<第2次<第3次<第4次,但仅在第2次处理后与第1次相比,出现显著性差异(P<0.05)。而Pb处理后的气孔阈值(Ls)与对照相比,均低于对照,与对照呈现显著性差异(P<0.05)。各处理间的气孔阈值(Ls)也随着处理次数的增加而逐渐降低,第1次>第2次>第3次>第4次,且4次处理间出现显著性差异(P<0.05)。
2.2 连续Pb处理下榉树叶片Fv/Fm的变化
从图1可知,与对照相比,PSⅡ最大光化学量子效率(Fv/Fm)随着Pb2+胁迫处理次数的增加呈下降趋势。但前3次Pb2+处理后的Fv/Fm相对于对照组差异不显著(P>0.05),仅第4次处理后的Fv/Fm值与对照组呈显著性差异(P<0.05);说明在第4次处理时,榉树的捕获光能的效率降低。4次处理之间比较发现,4次处理间Fv/Fm各有高低,Fv/Fm呈先升高后降低的变化趋势,当处理至第4次时,Fv/Fm值最低,而4次Pb2+处理之间的Fv/Fm,均无显著性差异。
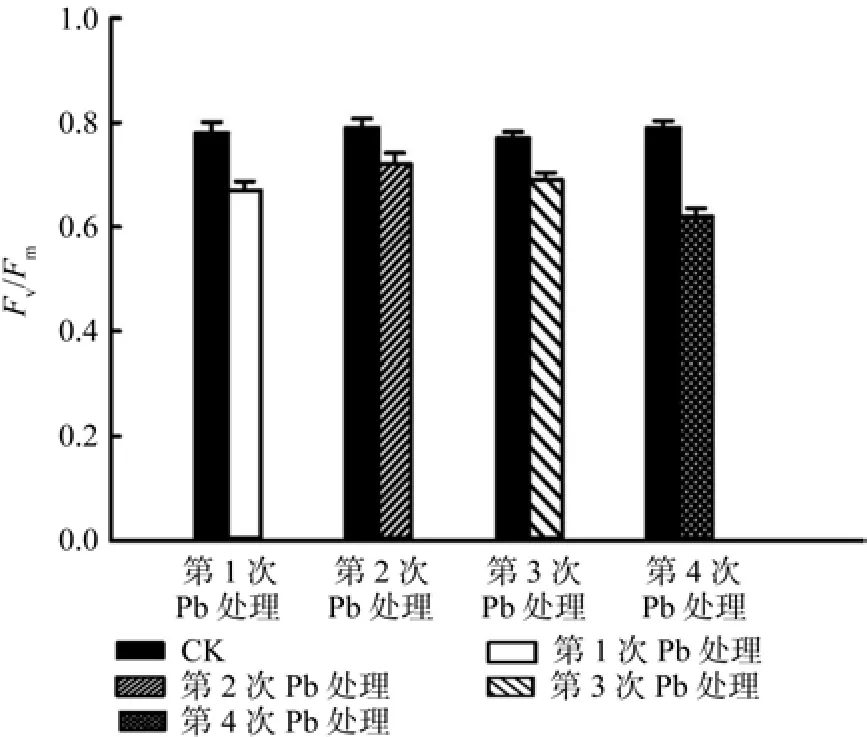
图1 连续Pb处理榉树叶片Fv/Fm的影响Fig.1 The variations of Fv/Fm in the leaves of Zelkova schneideriana in serial Pb treatments
2.3 连续Pb处理下榉树叶片qP与NPQ的变化
从图2可以看出,无论是对照组还是处理组的光化学淬灭系数(qP)都是随着光强PAR的增加而下降。在每一次Pb2+处理后,与对照组相比,表现为处理组显著低于对照(P<0.05)。而从4次Pb2+处理之间的比较可发现,前两次Pb2+处理后的qP最高,且显著高于后两次,而第1和第2次处理、第3和第4次处理间差异性均无显著性。但在第1次处理后,随着光强的继续增加qP迅速降低,而第4次处理后,随着光强的继续增加qP则表现出缓慢下降。qP的下降趋势暗示,PSII反应中心受铅影响可能部分关闭。
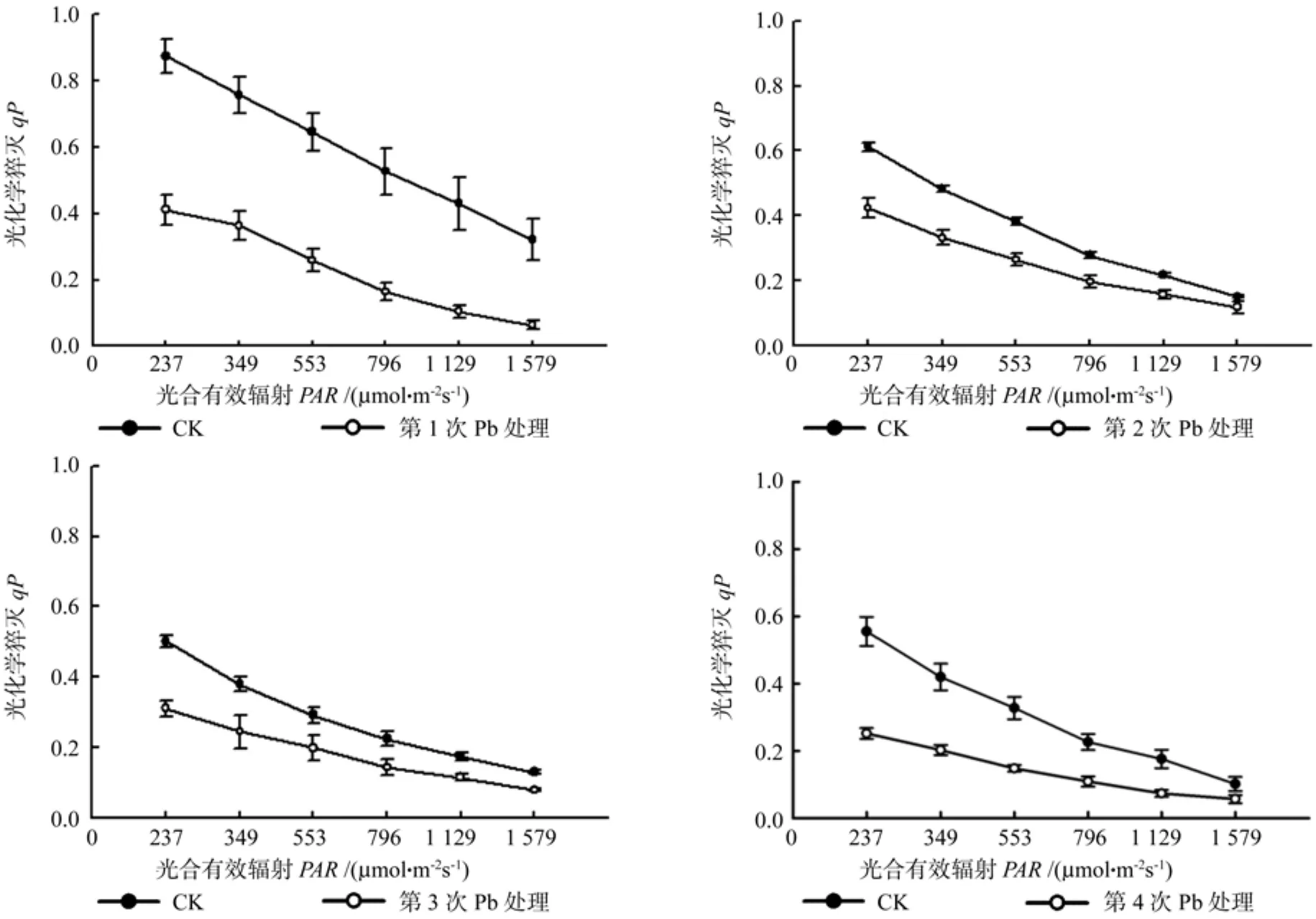
图2 连续Pb处理榉树光化学淬灭系数(qP)的变化Fig.2 The variations of qP in the leaves of Zelkova schneideriana in serial Pb treatments
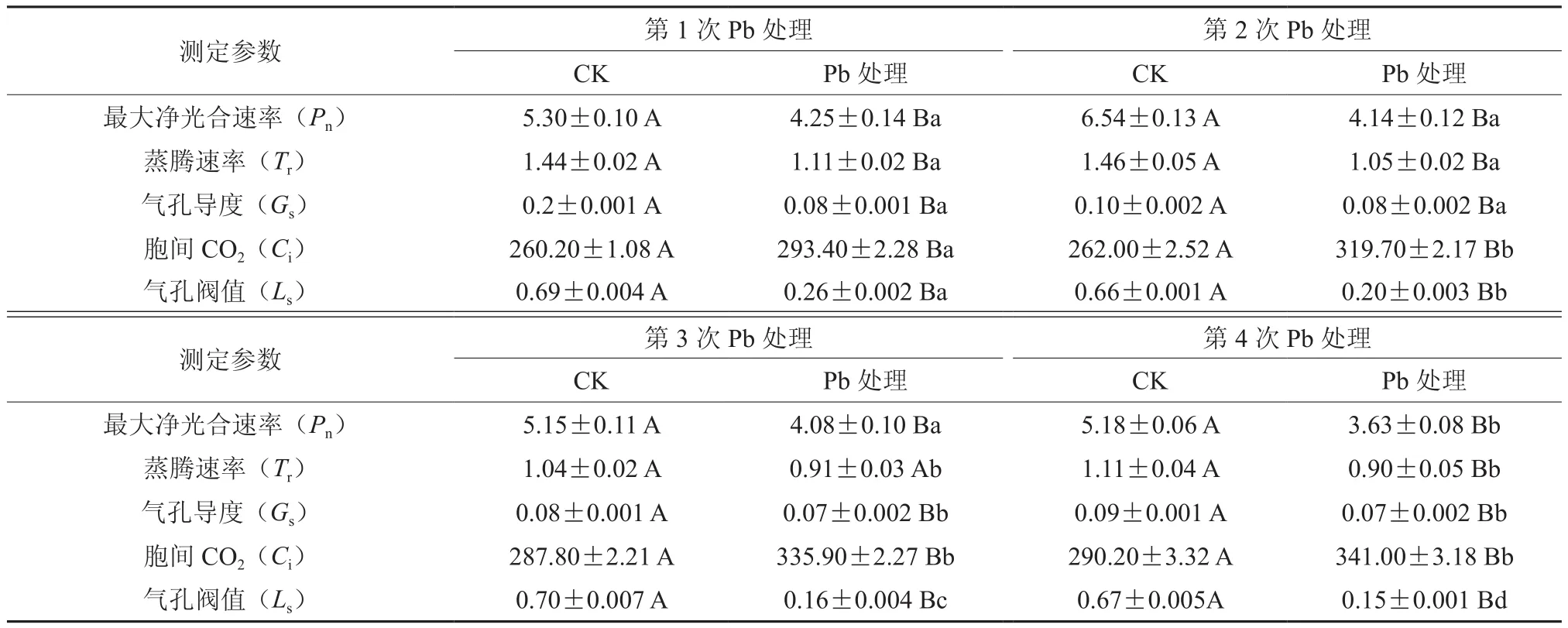
表2 连续Pb处理下榉树最大净光合参数变化†Table 2 The variations of net maximum photosynthetic rate parameters in the leaves of Zelkova schneideriana in serial Pb treatments
从图3可以看出,对照组与处理组的NPQ都刚好呈现出与qP相反的变化趋势,即对照组与处理组都随着光强PAR的增加而呈现上升趋势,并表现为Pb2+处理明显高于对照,且差异性显著(P<0.01)。4次Pb2+处理之间比较发现,在第3次处理时,NPQ随着光强的增加而迅速升高,并表现出如下规律:第3次>第4次>第1次>第2次,4次处理之间均有差异性(P<0.05)。
2.4 连续Pb处理下榉树叶片PSII光能分配的变化
由于净光合速率是在光强为 1 000 μmol·m-2s-1下测定,为更好的评价榉树的耐性,选取光强为1 129 μmol·m-2s-1的 YⅡ、YNPQ和 YNO的数据分析 PSII光能量子产量的分配规律。PSⅡ的反应中心吸收的光量子主要通过三个途径来进行转化与耗散。即光化学途径转化为能量存储YⅡ、调节性能量耗散的量子产额YNPQ和非调节性能量耗散,YNPQ是光保护的重要指标,YNO是光损伤的重要指标。从图4可以看出,4次Pb2+处理下,YⅡ均表现为Pb2+处理明显低于对照,且呈显著性差异(P<0.05),第2次Pb2+处理后的YⅡ下降最大,降幅达到75.17%;YNPQ与对照组相比则表现为Pb2+处理高于对照,其中前2次Pb2+处理后的YNPQ显著高于对照(P<0.05);而YNO与对照组相比,变化幅度不是很大。4次Pb2+处理之间比较发现,YⅡ在第1次Pb2+处理后的最低,在第3次最高,而YNPQ和YNO在处理间的均未表现出一定的规律性。

图3 连续Pb处理榉树非光化学淬灭系数(NPQ)的变化Fig.3 The variations of NPQ in the leaves of Zelkova schneideriana in serial Pb treatments
3 讨论与结论
生物或非生物胁迫均会对植物光合作用各过程产生影响[24],最终导致植物对碳固定和同化效率的降低。本研究显示,Pb胁迫后榉树叶片的最大净光合速率(Pn)和气孔阀值(Ls)都显著下降,胞间CO2浓度(Ci)明显升高。Farquhar认为当Ci升高的同时伴随着Ls的降低,说明Pn下降是非气孔限制引起[23]。由此可知,在连续Pb处理下榉树Pn下降是由非气孔限制引起。非气孔限制引起最大净光合速率下降主要是指在植物受到比较严重的胁迫时,光合作用代谢过程发生抑制和损伤变化,如叶片光合放氧能力、叶绿体Hill反应、PSII活力、叶绿素荧光强度和表观量子产额明显降低等[25-27],研究中也证实连续Pb处理下光化学猝灭qP低于对照组,说明Pb抑制榉树叶片光系统氧化侧向光系统II(PSII)反应中心的电子流动,PSII的电子传递活性变小,减弱了该反应中心光合电子的传递能力,导致光合速率下降[28]。
由于叶绿素荧光参数的变化可以快速、灵敏、无损伤探测环境条件对植物光合作用的影响[29-32],利用这一优势,我们进一步对连续Pb胁迫下榉树的生理状态进行研究,结果表明,连续4次Pb处理下榉树叶片的Fv/Fm低于对照,说明榉树幼苗叶片在Pb胁迫下,植物PSII反应中心活性受到影响,叶片捕获的光量子超过光合作用所能利用的量,导致光抑制的发生。另外,4次处理间的Fv/Fm数值大小各有高低,仅在第4次处理后到达最低点,这可能是因为PSII反应中心在逆境条件下受到影响,但它具有高效的调节和修复功能[33],使其活性能得以一定程度的恢复,同时,由于最大光能利用效率的下降具有累加效应,因此,在第4次Pb处理后,榉树叶片PSII受伤害的程度远高于它自身的调节和修复,最终造成榉树叶片Fv/Fm的值下降到最低点。本研究对连续Pb胁迫下榉树叶片的非光化学猝灭NPQ的研究发现,Pb处理组的NPQ显著高于对照,NPQ的升高说明PSII将不能用于光化学反应的能量以热的形式耗散,减轻榉树叶片在Pb胁迫下的光抑制,这与光化学猝灭qP减小的结果相对应。

图4 连续Pb处理下榉树叶片PSII光能分配的变化Fig.4 The variations of PSII optical energy distributive in the leaves of Zelkova schneideriana in serial Pb treatments
已有研究表明,可以运用PSII量子效率YⅡ、调节性能量耗散YNPQ和非调节性能量耗散YNO,三者相加等于1(YⅡ+YNPQ+YNO=1)的关系,用于描述额定光强下光系统中能量平衡及分配状况[34]。因此,在本研究中Pb处理组YⅡ的下降必然会造成YNPQ和YNO的升高,连续Pb处理下榉树叶片的YNPQ和YNO高于对照,且YNPQ的上升幅度高于YNO,说明榉树能有效地通过自身调节,将过剩光能以热的形式耗散,减轻PSII反应中心受伤害的程度。
综上所述,在Pb连续处理下,榉树叶片Pn、qP、Fv/Fm和YⅡ均下降,NPQ、YNPQ和YNO均上升,说明在Pb胁迫下榉树产生了光抑制的现象,但可提高热耗散,减轻PSII的受伤害程度,对光合机构起一定的保护作用,这与梁红柱等的研究结果是一致的[34-35]。在PSⅡ光能分配中,与对照组相比,YⅡ出现显著下降的同时YNPQ则表现出上升,也说明了榉树的光合作用虽然在Pb处理下会受到胁迫,但它自身拥有较强的热耗散能力,可以通过热耗散调节在一定层度上保护PSII,这进一步说明榉树幼树对Pb具有较强的抗逆性。基于本次试验的结果,在今后的研究中将结合快速叶绿素荧光诱导动力学(OJIP)来阐明榉树PSII反应中心的受损程度,以及植物在逆境条件下,光保护和光合器官的修复发生在能量转化的不同阶段[36],D1蛋白(D1)、捕光复合体(LHCII)和Rubisco酶(Rubisco)这三种光合蛋白是植物光化学调节中的关键物质[37-39],它们在Pb胁迫下的榉树中对光合器官保护和修复的机制还需要通过试验进一步研究。
[1]杨 刚, 伍 钧, 唐 亚.铅胁迫下植物抗性机制的研究进展[J].生态学杂志, 2005,24(12):1507-1512.
[2]Li Z, Ma Z, van der Kuijp T J, et al.A review of soil heavy metal pollution from mines in China: Pollution and health risk assessment[J].Scienceof the Total Environment, 2014, 468/469: 843-853.
[3]樊 霆,叶文玲,陈海燕, 等.农田土壤重金属污染状况及修复技术研究[J].生态环境学报, 2013, 22(10):1727-1736.
[4]杨启良, 武振中, 陈金陵, 等.植物修复重金属污染土壤的研究现状及其水肥调控技术展望[J].生态环境学报, 2015,24(6): 1075-1084.
[5]王崇臣,王 鹏,黄忠臣.盆栽玉米和大豆对铅、镉的富集作用研究[J].安徽农业科学,2008,36(24):10383-10386.
[6]杨春刚, 廖西元, 章秀福,等.不同基因型水稻籽粒对镉积累的差异[J].中国水稻科学,2006,20 (6):660-662.
[7]袁 敏,铁柏清,唐美珍,等.四种草本植物对铅锌尾矿土壤重金属的抗性与吸收特性研究[J].草业学报,2005,14(6):57-62.
[8]张然然, 罗鹏林, 刘远河,等.大冶铜绿山矿区优势草本植物重金属富集能力测定[J].化学与生物工程,2016,33(11):63-70.
[9]孙宗连,肖 昕,王 倩.3种多年生草本植物对土壤中铅的富集性研究[J].徐州工程学院学报,2011,26(3):72-76.
[10]杨卫东, 陈益泰.桉树在土壤重金属污染区土壤生物修复的应用前景[J].南京林业大学学报,2009(9):17.
[11]方 晰, 田大伦, 康文星.湘潭锰矿矿渣废弃地植被修复盆栽试验[J].中南林业科技大学学报, 2007, 27(1):14-19.
[12]刘艳丽,吴凤霞.杨树修复重金属污染土壤的研究进展[J].林业科学,2012(9):139-142.
[13]谢光明,甘 欣,高亚琴.玉米植株各器官中重金属含量相关性的研究[J].四川环境,2014,33(2):13-16.
[14]刘维涛,周启星.重金属污染预防品种的筛选与培育[J].生态环境学报,2010,19(6):1452-1458.
[15]杨启良,武振中,陈金陵,等.物修复重金属污染土壤的研究现状及其水肥调控技术展望[J].生态环境学报,2015,24(6):1075-1084.
[16]康 薇,鲍建国,郑 进,等.湖北铜绿山古铜矿遗址区木本植物对重金属富集能力的分析[J].植物资源与环境学报,2014, 23(1): 78-84.
[17]李彩霞,朱国强,彭 坤.绿化带土壤重金属污染特征及植物富集研究——以长沙市为例[J].中南林业科技大学学报,2016, 36(10): 101-107.
[18]胡红泉,崔同林.珍贵树种榉树的生物学利用价值及繁育技术[J].安徽农学通报, 2011, 17(15):79-80.
[19]毕 波,刘云彩,陈 强,等.榉树对大气污染物的净化能力研究[J],西部林业 ,2011,40( 4) : 77-79.
[20]宗良刚,丁 园.土壤重金属(Cu Zn Cd)复合污染的研究现状[J].农业环境保护, 2001, 20(2): 126-128.
[21]郭建平, 吴甫成,谢淑容,等.湖南临湘铅锌矿尾矿库环境状况及开发利用研究[J].土壤通报, 2007, 38(3):553-557.
[22]Wu K L, Zhao Y F, Lu Q L, et al.Effect of irrigation during grain filling stage and applying phosphate on the photosynthetic efficiency and yield of winter wheat in the fl uvoaquic soil area[J].Plant Nutrition and Fertrilizer Science,2002, 8(4): 428- 434.
[23]Kramer D M, Johnson G, Kiirats O, et al.New Fluorescence Parameters for the Determination of QA Redox State and Excitation Energy Fluxes[J].Photosynthesis Research, 2004,79(2): 209-218.
[24]Farquhar G D, Sharkey T D.Stomatal conductance and photosynthesis[J].Annual Review of Plant Physiology, 1982,33(3): 317-345.
[25]李亚藏, 梁彦兰, 王庆成.Pb对山梨和山荆子光合作用和叶绿素荧光特性的影响[J].西北林学院学报, 2012, 27(5):21-25.
[26]李牡丹.重金属Pb对芨芨草种子萌发及其幼苗生长的影响[D].北京:北京林业大学,2008.
[27]原海燕, 郭 智, 黄苏珍.Pb污染对马蔺生长、体内重金属元素积累以及叶绿体超微结构的影响[J].生态学报, 2011,31(12):3350-3357.
[28]Wang K F, Xu C X, Zhao F H, et al.The effects of water stress on some in vivo chlorophyll a fl uorescence parameters of wheat fl ag leaves[J].Acta Biophysica Sinica, 1997, 13(2): 273-278.
[29]Luo Q H, Li Z J, Wu W M, et al.Comparative Study of Photosynthetic and Chlorophyll Fluorescence Characteristics of Populuseuphratica and P.pruinosa[J].Acta Botanica Boreali-Occidentalia Sinica, 2006, 26(5):983-988.
[30]Lin S Q, Xu C H, Zhang Q D, et al.Some application of chlorophyll fluorescence kinetics to plant stress physiology,phytoecology and agricultural modernization[J].Chinese Bulletin of Botany, 1992, 9(1) :1-16.
[31]Li P M, Gao H Y, Strasser R J.Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study[J].Journal of Plant Physiology and Molecular Biology,2005, 31(6) : 559-566.
[32]Bai J, Xu D H, et al.Photopro-tective function of photorespiration in Reaumuriasoongorica during different levels of drought stress in natural high irradiance[J].Photosynthetica,2008, 46, 232-237.
[33]Tikkanen M, Mekala N R, Aro E M.Photosystem II photoinhibition-repair cycle protects Photosystem I from irreversible damage[J].Biochimica Et Biophysica Acta, 2014,1837(1): 210-215.
[34]钱永强,周晓星,韩 蕾,等.Cd胁迫对银芽柳PSⅡ叶绿素荧光光响应曲线的影响[J].生态学报, 2011,31(20):6134-6142.
[35]梁红柱, 窦德泉, 冯玉龙.热带雨林下砂仁叶片光合作用和叶绿素荧光参数在雾凉季和雨季的日变化[J].生态学报, 2004,24(7): 1421-1429.
[36]Mlinarić S, Dunić J A, Babojelić M S, et al.Differential accumulation of photosynthetic proteins regulates diurnal photochemical adjustments of PSII in common fi g (Ficuscarica,L.) leaves[J].Journal of Plant Physiology, 2017, 209(209):1.
[37]Faraloni, C., &Torzillo, G.Phenotypic characterization and hydrogen production in chlamydomonasreinhardtiiQB-binding D1-protein mutants under sulfur starvation: changes in chl fl uorescence and pigment composition[J].Journal of Phycology,2010, 46(4), 788-799.
[38]Takeuchi A, Yamaguchi T, Hidema J, et al.Changes in synthesis and degradation of Rubisco and LHCII with leaf age in rice (Oryza sativa, L.) growing under supplementary UV-B radiation[J].Plant Cell & Environment, 2002, 25(6):695-706.
[39]Lepedus, H, Schlensog, M.University of Kiel, Muller, L.University of Kiel, et al.Function and molecular organisation of photosystem 2 in vegetative buds and mature needles of Norway spruce during the dormancy[J].Biologia, 2005, 60(1):89-92.

