4种木本植物对重金属铅、锌的积累及叶片养分含量特征研究
王旭旭 ,黄鑫浩 ,胡丰姣 ,朱 凡 ,梁惠子 ,王仁杰 ,楚晶晶 ,朱雅荃
(1.中南林业科技大学,湖南 长沙 410004;2.南方林业生态技术国家工程实验室,湖南 长沙 410004)
近年来,伴随着铅、锌矿产资源开发、金属冶炼、燃料生产以及锌肥在农业中的广泛使用,铅、锌元素及其化合物大量进入土壤,导致土壤生产性能下降和土壤质量恶化,进而影响和危害人类健康[1-2]。根据2014年全国土壤污染状况调查公报,全国土壤点位超标率为16.1%,其中重金属污染物铅、锌的点位超标率分别为1.5%、0.9%。有报道称,自“十五”规划实施以来,湖南省的汞、镉、铅、铬排放量居全国首位,全省受重金属污染的土地面积达28 000 hm2,占全省总面积的13%。严重的重金属污染问题对湖南的经济发展与生态文明建设提出了新的拷问。
植物修复是一种新兴且发展前景较好的绿色环境修复技术,具有广域性、永久性、低廉性和易操作等特点,被世界各国所关注[3-7]。其中木本植物寿命长,生物量大,生长迅速,根系深,可用于修复重金属污染[8]。
目前对于铅、锌的超富集植物、耐性植物的研究多限于草本与灌木[1,9-10],对木本植物也有一些相关报道,如施翔等[11]通过盆栽实验证明紫穗槐Amorpha fruticosa Linn.可作为修复铅锌矿区污染土壤的潜力树种。张富运等[12]将8种木本植物种植于铅锌矿渣中证明光皮树Swida wilsoniana、黧蒴栲Castanopsis fi ssa、楠木Phoebe zhennan、杜鹃Azalea可用于铅锌污染土壤的修复。周疆丽等[13]通过根生长法研究表明,柳树Salix matsudana对重金属铅、锌具有一定的耐性。张轩等[14]通过在矿区样地随机取样法证明乌桕Sapium sebiferum、泡桐Paulownia、栾树Koelreuteria paniculata可用于植物修复铅锌污染土壤。上述研究结果为铅锌矿区土壤植物修复提供了树种选择。本研究选用湖南林业生产常用的4种阔叶木本植物,探究它们对铅、锌的吸收富集潜力,同时为多年生木本植物在矿区修复地发挥后续生态效应,还研究了叶片元素的养分吸收特征。研究结果将为今后湖南铅、锌矿废弃地植物修复提供参考。
1 材料与方法
1.1 试验材料与设计
本试验采用盆栽法,于2015年1月至11月在中南林业科技大学西园温室中进行。试验土壤采自于中南林业科技大学校园内10~20 cm表层土,土壤pH为5.17,土壤全C、全N、全P以及Pb、Zn的含量分别为12.13、0.24、0.16、0.02、0.06 g·kg-1。将采回的土壤风干,研磨,过5 mm×5 mm的筛,充分混匀后装入塑料花盆(上口径30 cm、下口径26 cm、高26 cm),每盆装土9.0 kg,待用。
供试植物选用榆科榉属榉树Zelkova schneideriana、楝科香椿属毛红椿Toona ciliata var.pubescens、无患子科栾树属栾树Koelreuteria paniculata、山茶科木荷属木荷Schima superba,均为1年生容器苗。选取苗高、地径基本一致的树苗栽植在盆中,每盆栽种1株。苗木于室外培养1个月后移入温室继续培养2个月。苗木培养期间,用纯水浇灌,保持所有供试苗木盆内土壤田间持水量在40%左右。
然后人工分别配置Pb、Zn污染溶液,Pb污染处理:将浓度为10 g·L-1PbCl2溶液400 mL掺入每盆盆栽土中(盆底无渗出液),并且设置4种Pb污染浓度梯度,即L1(400 mL量掺入1次)、L2(400 mL量掺入2次)、L3(400 mL量掺入3次)、L4(400 mL量掺入4次),多次掺入每次间隔的时间为3 d。掺入过程中向盆栽土四周均匀掺入,避免溶液接触到植物干基部。Zn处理方法同上。对照组喷洒等量的纯水(CK),每种植物每种处理重复3次,试验共计120盆。木荷在Zn污染处理5 d后陆续死亡。试验期间,每次用等量的水浇灌所有盆栽,保持所有供试苗木盆内土壤含水率40%左右,温室内白天、夜晚温度分别为28 ℃、20 ℃,空气湿度为60%~70%,定期对所有盆栽进行锄草,松土等管理措施。
1.2 取样与测定
植株在污染土中培养40 d后进行破坏性取样,将植株完整地从盆中取出。取出的植株用自来水洗净后,按根、茎、叶分别风干后,放入干净的布口袋中置于空气干燥恒温箱内105 ℃杀青20 min,70 ℃恒温烘至恒质量。植物样品粉碎后,称取2.0 g,用干灰化-HP3510原子吸收分光光度计法测定植物根、茎、叶样品中Pb、Zn含量以及叶片中Mg、Ca、Fe的含量[15],用钼锑抗比色法测定植物叶片中全P的含量[16],用火焰光度计法测定植物叶片中K的含量[17]。将土壤进行风干、研磨、烘干后,称取0.5 g,用王水消煮-HP3510原子吸收分光光度计法测定土壤样品中Pb、Zn的含量[18]。
1.3 数据处理
转运系数(Translocation factor)= 地上部分的金属含量/根中的金属含量[19]。
富集系数(Accumulator factor)= 植物地上或地下部分重金属含量/土壤中重金属含量[20]。
采用Microsoft Excel数据系统进行平均值和标准误的计算,用SPSS 20.0对同一种植物同一部位在不同浓度处理下的重金属含量以及同一种植物同一浓度处理下不同部位重金属含量进行ANOVA单因素方差分析、LSD多重比较,对不同浓度Pb、Zn处理与P、K、Mg、Ca、Fe含量进行相关性分析。
2 结果与分析
2.1 不同木本植物中Pb含量及分布特征
4种木本植物对Pb吸收状况如表1所示。4种木本植物体内Pb含量基本上随着Pb浓度的增加而增加。根系是吸收积累Pb的主要部位,4种植物中以木荷最高,达1 277.18 mg·kg-1,其次为榉树、毛红椿,最小为栾树。其中在L4污染水平以木荷最高,分别是榉树、毛红椿、栾树的1.30倍、2.35倍、2.45倍。4种木本植物地上部分Pb含量以木荷最高,达182.51 mg·kg-1,其次为毛红椿,榉树最低。当土壤中Pb处理浓度为L1时,4种木本植物各器官中Pb含量均表现为:根系>茎>叶片,榉树在L2~L4均表现为:根系>叶片>茎,栾树从L3~L4后均表现为:根系>叶片>茎,毛红椿在L4时表现为:根系>叶片>茎,木荷在各水平处理下均表现为:根系>茎>叶片,且各器官间Pb含量基本上差异显著(P<0.05)。4种Pb处理水平下各植物体内Pb的总含量均表现为Pb处理显著大于对照(P<0.05),且植物体内Pb的总含量显著增加(P<0.05),表明土壤中Pb的施加浓度是决定植物对Pb吸收量的关键因素。
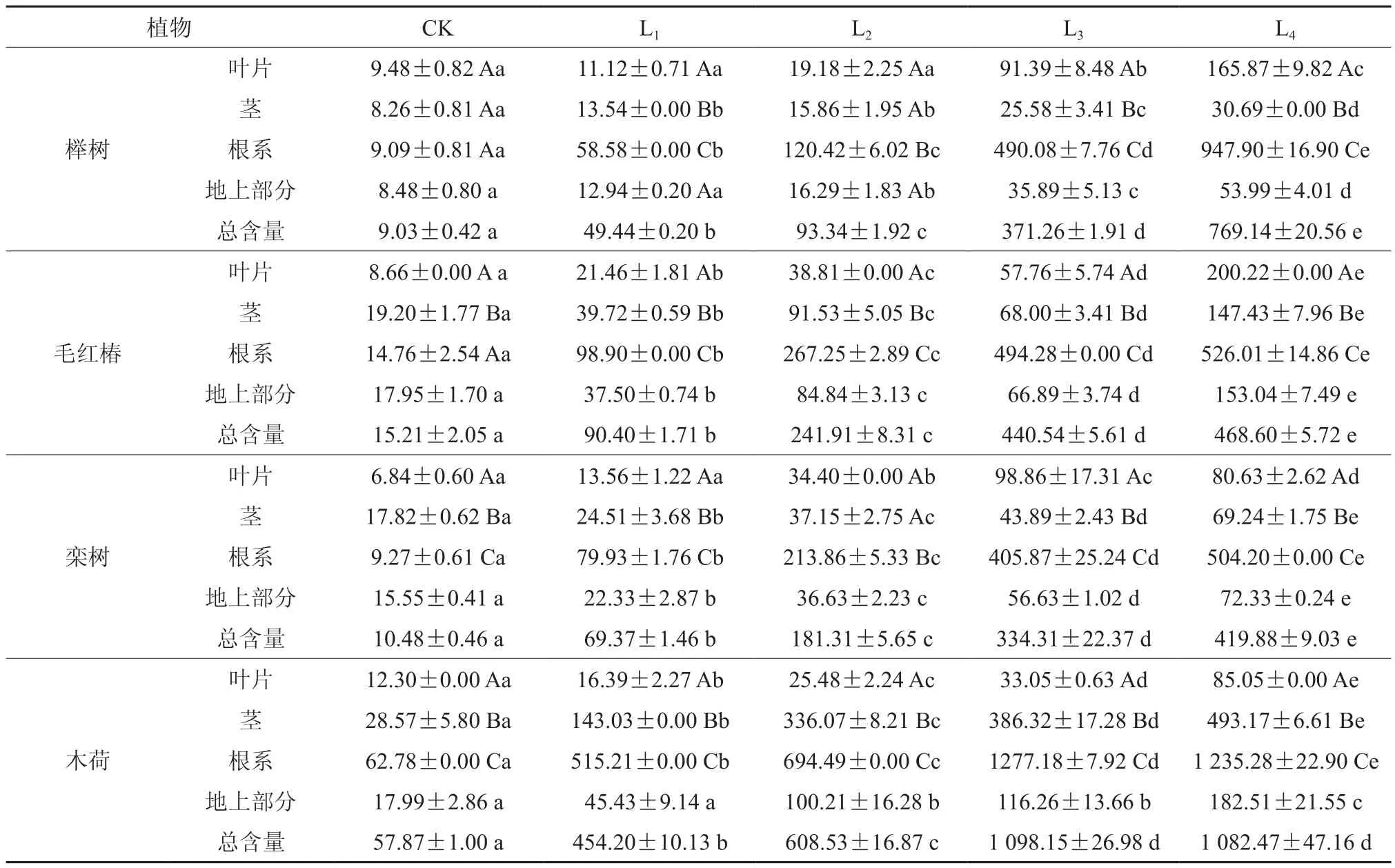
表1 Pb在不同植物体内的分布与含量†Table 1 Pb distribution and concentration in different woody species (mg·kg-1)
2.2 不同木本植物中Zn含量及分布特征
3种木本植物对Zn的吸收状况如表2所示。随着土壤中Zn处理浓度的增大,3种木本植物各器官中Zn的含量均显著大于对照(P<0.05)。在L1、L2处理水平时,根系是3种木本植物吸收积累Zn的主要部位,以毛红椿地上部分Zn含量最高,为145.67 mg·kg-1。在L3处理水平下,毛红椿陆续死亡,栾树地上部分的Zn含量和总含量分别为榉树的1.07倍和1.08倍。当处理水平低于L3时,榉树、栾树各器官中Zn含量均表现为:根系>茎>叶片,毛红椿表现为根系>叶片>茎,当处理水平为L3时,榉树、栾树各器官中Zn含量表现为:茎>叶片>根系。榉树、栾树体内Zn的总含量随Zn处理水平的提高呈先增后减的趋势(P<0.05);毛红椿呈增加趋势;毛红椿、栾树分别在L3、L4污染水平下死亡。
2.3 不同木本植物对Pb、Zn的富集能力
植物的转运系数能反映出重金属Pb、Zn在植物体内的运输和分配情况[21-23],转运系数越大,表明重金属从根系向地上部分器官转运的能力越强[11-12,24]。植物的富集系数是反映植物将重金属吸收转移到体内能力大小的重要指标,富集系数越高,则植物对重金属的吸收积累能力越强,越有利于植物提取重金属,修复污染土壤[24-27]。4种木本植物对Pb、Zn富集能力状况如表3所示。4种木本植物在Pb处理下转运系数均小于1,榉树、毛红椿、栾树和木荷的转运系数的平均值分别为0.12、0.28、0.18、0.11,这表明4种植物对Pb的运输能力的高低顺序为:毛红椿>栾树>榉树>木荷。3种木本植物对Zn的转运系数普遍大于Pb处理下的对Pb的转运系数,表明3种木本植物对Zn的运输能力较强。毛红椿、栾树在Zn处理水平L2、L3时相继枯萎死亡,榉树的转运系数虽然随着土壤Zn污染水平的增大呈递减趋势,但仍能存活,其体内可能存在较强的运输与解毒机制以应对重金属Zn的胁迫,而毛红椿、栾树这方面的能力相对较弱。
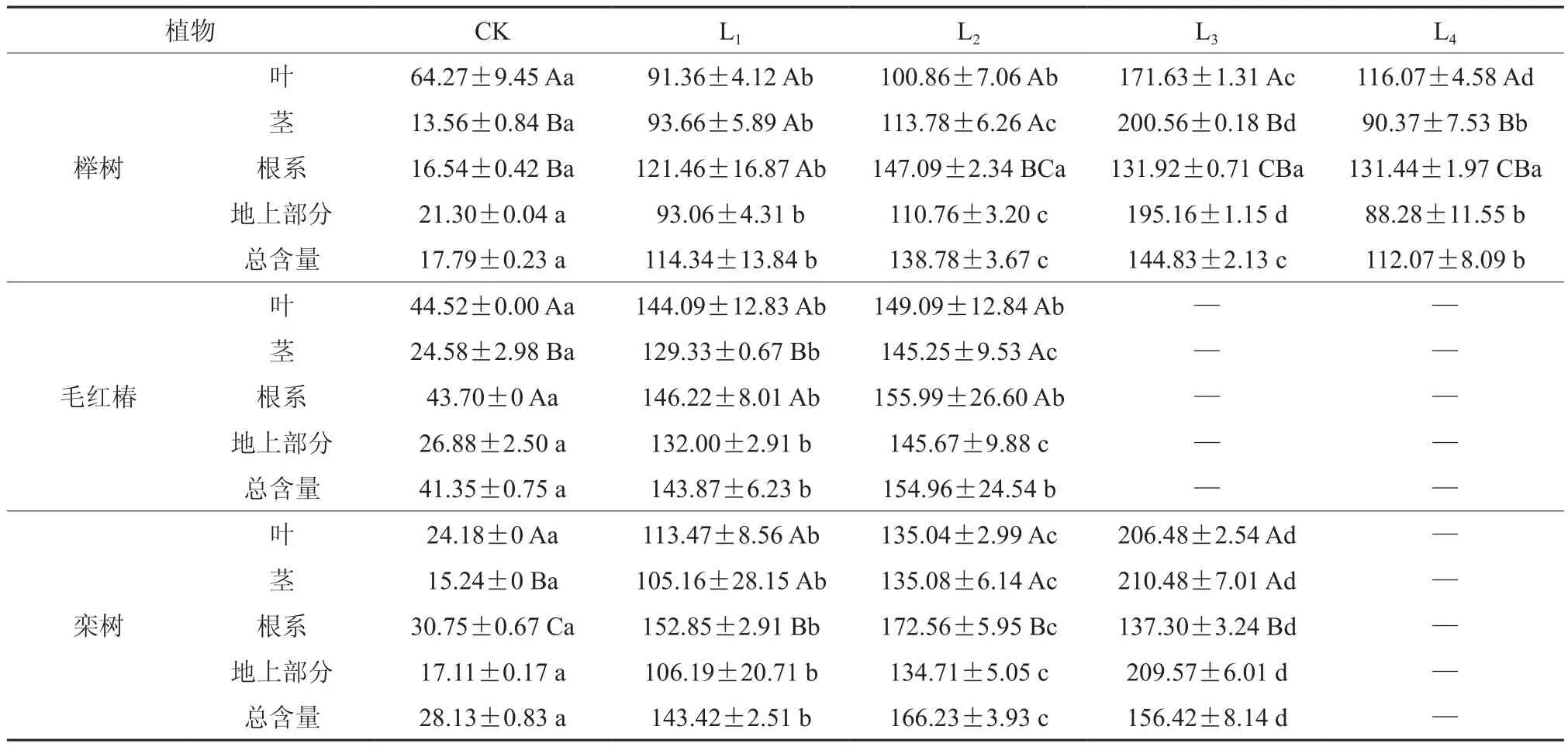
表2 Zn在不同植物体内的分布与含量†Table 2 Zn distribution and concentration in different woody species (mg·kg-1)
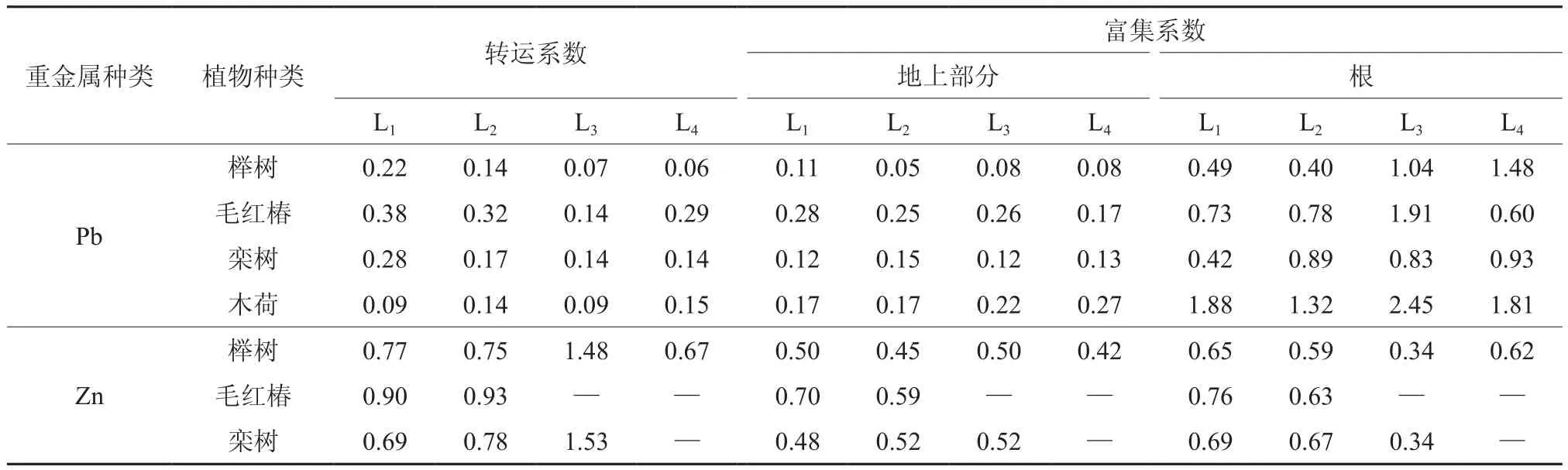
表3 不同木本植物对重金属Pb、Zn的转运系数与富集系数Table 3 Translocation factor and accumulator factor of Pb, Zn in different woody species
4种植物地上部分对Pb的富集系数均小于1,表明植物地上部分中Pb的含量低于土壤中Pb的含量;4种木本植物地上部分对Pb的富集能力表现为:毛红椿>木荷>栾树>榉树;榉树、毛红椿、栾树、木荷的根系对Pb富集系数的平均值分别为0.85、1.00、0.77、1.87,表明木荷根系对Pb的富集能力高于其他树种,其次为毛红椿、榉树,栾树最低。榉树和毛红椿对Zn的富集系数普遍存在减小的趋势,表明当处理水平为L1时,这2种植物对Zn的富集能力较强,但当处理水平高于L1,Zn对植物产生胁迫作用,从而降低植物对Zn的富集能力;3种木本植物地上部分对Zn的富集系数最大值分别为0.50、0.70和0.52,根系富集系数最大值分别为0.65、0.76和0.69。
2.4 不同木本植物在Pb胁迫下叶片中的养分含量
4种木本植物在Pb胁迫下叶片养分状况如表4所示。4种木本植物叶片中K、Ca含量普遍大于对照,Fe含量普遍小于对照;毛红椿、栾树叶片中的P含量普遍大于对照。栾树、木荷叶片中Mg含量普遍大于对照,但榉树、毛红椿叶片中Mg含量普遍低于对照。榉树叶片中P、Fe含量与Pb处理浓度相关性不显著(P>0.05);Mg含量与Pb处理浓度呈显著负相关(-0.049,P<0.05);K、Ca含量与Pb处理浓度呈极显著正相关(0.865、0.968,P<0.01),K含量表现为先增后减的趋势。毛红椿叶片中Fe含量与Pb处理浓度呈显著负相关(-0.668,P<0.01);P、K、Ca含量与Pb处理浓度呈极显著正相关(0.676、0.950、0.678,P<0.01),总体上表现为增加趋势。栾树叶片中Mg、Fe含量与Pb处理浓度相关性不显著(P>0.05);K含量Pb处理浓度呈显著正相关(0.630,P<0.05);P、Ca含量与Pb处理浓度呈极显著正相关(0.734、0.908,P<0.01)。木荷叶片中P、Fe含量与Pb处理浓度相关性不显著(P>0.05);而K、Ca、Mg含量与Pb处理浓度呈极显著正相关(0.969、0.926、0.968,P<0.01)。
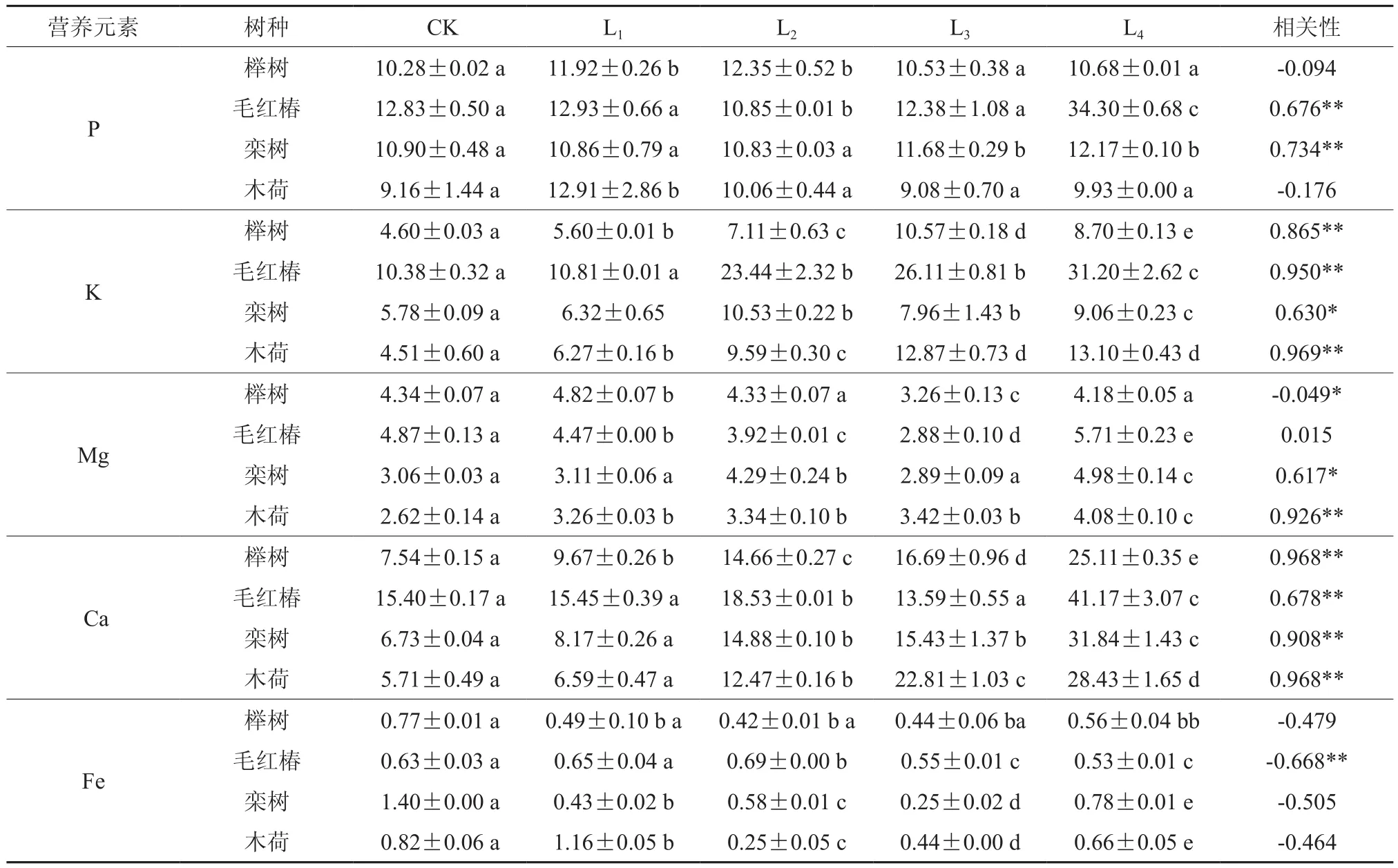
表4 不同木本植物在Pb处理下叶片中营养元素含量†Table 4 The concentration of nutrition element in different woody species under Pb stress (g·kg-1)
2.5 不同木本植物在Zn处理下叶片中的养分含量
3种木本植物在Zn处理下对养分含量状况如表5所示。3种木本植物叶片中K、Ca含量普遍大于对照,Fe含量普遍小于对照;栾树叶片中的P、Mg含量显著大于对照。土壤中Zn处理水平与榉树、毛红椿体内的P、Mg、Fe含量相关性不显著,表明Zn2+对榉树、毛红椿叶片中P、Mg、Fe含量影响较小;而榉树、毛红椿体内K、Ca含量与土壤中Zn处理水平呈极显著正相关(P<0.01),表明两者之间存在协同作用。栾树叶片中P、Mg、Ca与Zn污染水平呈极显著正相关(P<0.01),而Fe含量与Zn污染水平呈极显著负相关(P<0.01),表明重金属Zn抑制了植物对Fe的吸收。
3 讨 论
Pb、Zn在不同植物体内的地上部分与根系的分布与总含量是不同的[11,26]。根是4种木本植物吸收积累重金属Pb的主要部位,这可能是木本植物通过根部细胞的金属位点实现对重金属铅的富集,使Pb对地上部分影响降低,体现4种木本植物对Pb的耐性[28-29],这与施翔[11]、张富运[23]、Salt[30]等的研究结果相符。L4污染水平下,4种木本植物中,栾树对Pb的吸收累积量最低,但栾树能够正常生长,这可能是栾树通过根系对Pb的排斥作用[31],或者根系分泌有机酸、氨基酸、糖等改变根际环境从而影响铅的吸收[32]来减少重金属对根系的毒害作用,体现了植物对重金属的避性。根是榉树和栾树吸收Zn的主要部位,但毛红椿茎、叶中的Zn含量显著高于根系,且在Zn处理下出现落叶现象,这可能是毛红椿通过代谢途径将重金属排出体外,以减少重金属对植物的毒害,表现另一种对重金属的耐性途径[28-29]。
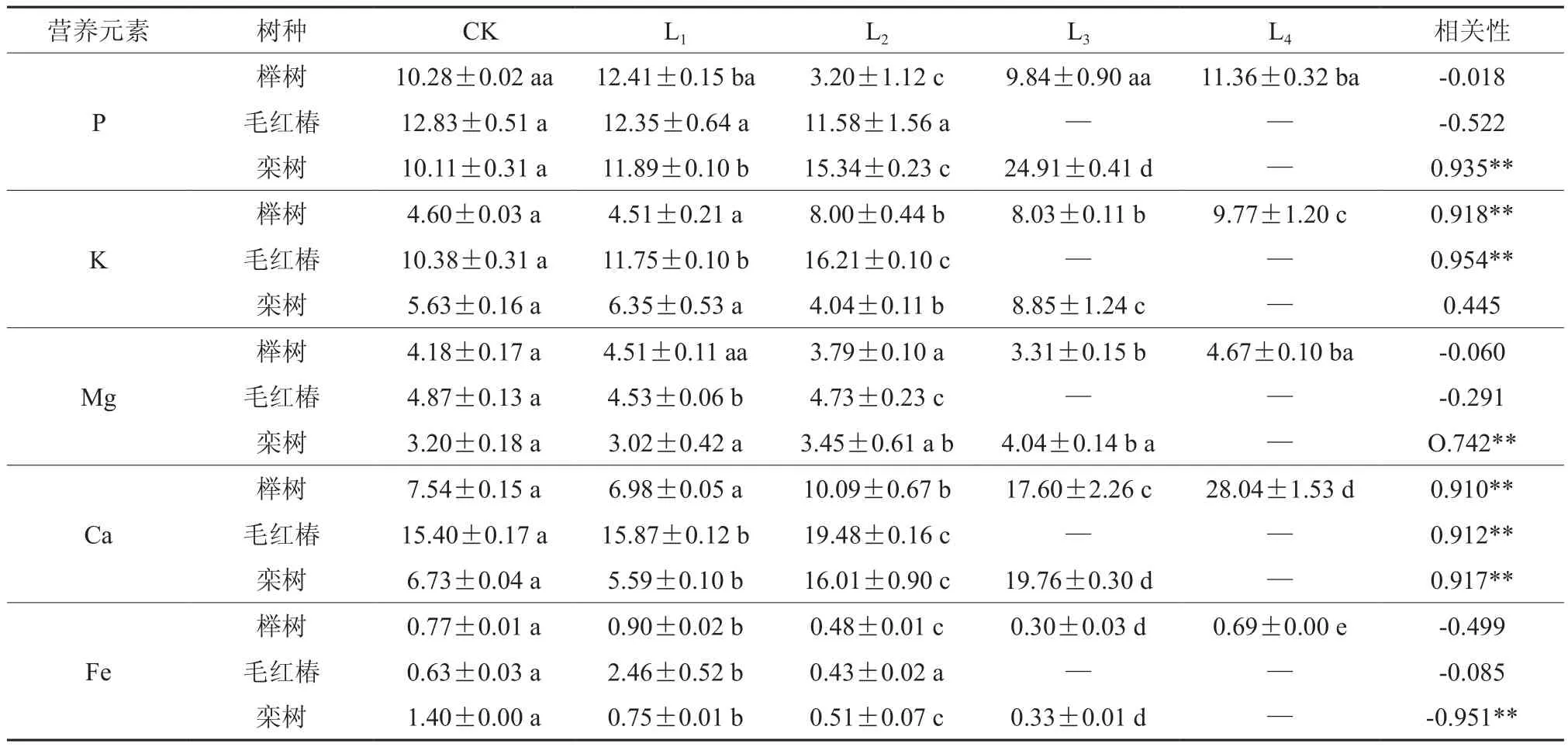
表5 3种木本植物在Zn处理下叶片中营养元素含量†Table 5 The concentration of nutrition element in different woody species under Zn stress (g·kg-1)
根据Baker与Brooks提出的参考值[4-5],当植物叶片或地上部分(干质量)中含Pb量达到 1 000 mg·kg-1,Zn 达到 10 000 mg·kg-1以上,且还满足植物地上部分重金属含量/根系重金属,即转运系数>1的植物为超富集植物。本文中Pb处理下4种木本植物中地上部分累积量最高的为木荷,累积量为182.51 mg·kg-1,分别为榉树的3.38倍、毛红椿的1.92倍、栾树的2.52倍。但4种木本植物地上部分对Pb的累积量均低于超富集植物标准值,且4种木本植物对Pb的转运系数均小于1。榉树、栾树、毛红椿在不同浓度Zn处理下,其转运系数虽然大于1,但是其地上部分Zn累积量均未达到标准值。因此本文中4种木本植物均不能作为Pb或Zn的超富集植物。但王广林[33]提出木本植物富集系数大于0.4,即可认为该植物的修复能力强,富集系数在0.1~0.4时,即可认为该植物对土壤重金属污染有一定的修复能力。因此本文中4种木本植物可作为Pb污染土壤修复的潜力树种,同理,榉树也可作为Zn污染土壤的修复树种。
P、K是植物生长发育期间所必须的大量营养元素。Ca、Mg、Fe具有调节植物体的物质合成、渗透压,维持体内代谢平衡等功能,是植物正常生长必需的营养元素。重金属不仅可以通过自身的离子毒性对植物产生毒害作用,还可以与养分元素竞争植物根系吸收位,或者影响植物生理生化过程,从而引起植物对养分吸收性能的改变,间接影响植物的正常的生长发育[34]。Pb处理下,植物叶片中Fe含量与Pb处理浓度呈负相关,且4种木本植物均出现不同程度的失绿现象,这可能是由于铅可与叶绿素蛋白的-SH结合,并通过代替其中的Fe2+、Mg2+,使叶绿素蛋白的中心离子遭到破坏,从而降低光合酶活性甚至影响叶绿素的合成,从而影响植物的光合作用[35-36]。本文中4种木本植物叶片中K、Ca含量总体上随着Pb处理浓度增加呈不断上升的趋势,表明Pb与K、Ca吸收存在协同作用,Pb可以促进K、Ca的吸收,K可以通过影响根细胞的膜透性,Ca可以通过调节质膜的酶活性增强植物对重金属离子的吸收,与Fontes等[37]的研究相符。Zn处理下,从毛红椿体内营养元素含量来看,毛红椿最终死亡并不是营养元素缺失造成的,可能与叶绿体结构受到破坏、光合速率低、光合产物无法满足植株生长需要有关。栾树的死亡可能与Fe的缺失有关[35-36]。
4 结 论
(1)4种木本植物均非超富集植物,但均能作为修复Pb污染土壤的潜力树种。4种木本植物对Pb的最大累积量分别为769.14、468.60、419.88、1 098.15 mg·kg-1,表现为:木荷>榉树>毛红椿>栾树,转运系数均小于1,地上部分富集系数表现为:毛红椿>木荷>栾树>榉树,根系富集系数表现为:木荷>毛红椿>榉树>栾树。榉树、毛红椿、栾树、木荷在Pb处理下表现出较好的吸收、富集与转运能力,可作为Pb污染土壤的潜力修复树种。
(2)榉树和栾树在Zn处理下基本上能正常生长,且对Zn有一定的富集能力,可用于Zn污染土壤的治理。但木荷和毛红椿在Zn胁迫下易死亡,所以在选用木荷、毛红椿修复Pb-Zn复合污染土壤时要慎重考虑Zn的胁迫作用。
(3)重金属Pb、Zn对4种木本植物叶片中的K、Ca吸收存在促进作用,对Fe存在抑制作用。
[1]张富运,陈永华,吴晓芙,等.铅锌超富集植物及耐性植物筛选研究进展[J].中南林业科技大学学报,2012,32(12):92-96.
[2]龚红梅,沈 野.植物对重金属锌耐性机理的研究进展[J].西北植物学报,2010,30(3):633-644.
[3]高 岚,李泽琴,李国臣.土壤重金属污染植物修复研究动态[J].作物杂志,2011(5):12-15.
[4]Brooks R R.Plants that hyperaccumulate heavy[J].CAB International, 1989,1-2.
[5]Baker A J M, Proctor J.The inf l uence of cadmium ,copper,lead and zinc on the distribution and evolution of metal lophytes in the British Isles[J].Plant System Evolution,1990,173:91-108.
[6]骆永明.金属污染土壤的植物修复[J].土壤, 1999, 31(5):261-265.
[7]李思亮,杨 斌,陈 燕,等.浙江省铅锌矿区土壤重金属污染及重金属超富集植物筛选[J].环境污染与防治,2016, 38(5):48-54.
[8]鲁 敏,李英杰.绿化树种对大气金属污染物吸滞能力[J].城市环境与城市生态,2003(1):51-52.
[9]罗 忠,文仕知,刘 虹.枫香人工林根系重金属元素含量的季节变化[J].湖南林业科技,2015,42(5):6-9.
[10]王旭军,吴际友,程 勇,等.铅胁迫对4种行道树生长的影响[J].湖南林业科技,2011,38(5):34-38.
[11]施 翔,陈益泰,王树凤,等.3种木本植物在铅锌和铜矿砂中的生长及对重金属的吸收[J].生态学报, 2011, 31(7):1818-1826.
[12]张富运,陈永华,吴晓芙,等.8种木本植物对矿渣中重金属的吸收与富集研究[J].环境科学与管理,2014,39(3):168-170.
[13]周疆丽,田胜尼,张玉琼,等.根生长法测定柳树对重金属的耐性研究[J].安徽农业科学,2010,11(16):98-101.
[14]张 轩,赵俊程,吴子剑,等.六种木本植物对铅锌尾矿库重金属富集力的研究[J].湖南林业科技,2016,43(6):64-68.
[15]周仁飞.锰矿区废弃地重金属污染土壤下栾树和杜英的光合生理响应研究[D].长沙:中南林业科技大学,2010.
[16]章家恩.生态学常用实验研究方法与技术[M].北京:化学工业出版社,2007.
[17]鲍士旦.土壤农化分析[M].第3版.北京:中国农业出版社,2000.
[18]林大仪.土壤学实验指导[M].北京:中国林业出版社,2004.
[19]Baker A J M, Reeves R D, Hajar A S M.Heavy metal accumulation and tolerance in British populations of themetallophyte Thlaspicaerulescens J.& C.Presl.(Brassicaceae)[J].New Phytologist, 1994,127:61-68.
[20]Chamberlain A C.Fallout of lead and uptake by crops.Atmosphe ricEnvironment,1983,17:693-706.
[21]Monni S, Salemaa M, White C, et al.Copper resistance of Calluna vulgaris originating from the pollution gradient of a Cu-Ni smelter, insouthwest Finland[J].Environmental Pollution,2000,109: 211-219.
[22]刘秀梅,聂俊华,王庆仁.6种植物对Pb的吸收与耐性研究[J].植物生态学报,2002,26(5):533-537.
[23]石汝杰,陆引罡.4种草本植物对酸性黄壤中铅的吸收特性研究[J].水土保持学报,2007,21(3):73-76.
[24]Sharma P, Dubey R S.Lead toxicity in plants[J].Brazilian Journal of Plant Physiology, 2005,17(1):35-52.
[25]李玉双,孙丽娜,孙铁珩,等.超富集植物叶用红菾菜(Beta vulgaris var.cicla L.)及其对Cd的富集特征[J].农业环境科学学报,2007,26(4):1386-1389.
[26]刘 影,伍 钧,杨 刚,等.3种能源草在铅锌矿区土壤中的生长及其对重金属的富集特性[J].水土保持学报,2014,28(5):291-296.
[27]孙约兵,周启星,王 林,等.三叶鬼针草幼苗对镉污染的耐性及其吸收积累特征研究[J].环境科学,2009,30(10):3028-3035.
[28]Baker A J M.Metal tolerance[J].New Phytologist, 1987,106(S1): 93-111.
[29]杨居荣, 黄 翌.植物对重金属的耐性机理[J].生态学杂志,1994, 13(6): 20-26.
[30]Salt D E, Prinee R, et al.Meehanism of cadmium mobility and accumulation in Indian mustard[J].Plant Physiol, 1995,109:1427-1433.
[31]周芙蓉,王进鑫,张 青,等.侧柏和国槐叶片中铅的化学形态与分布研究[J].农业环境科学学报,2012,31(11):2121-2127.
[32]常学秀,段昌群,王焕校.根分泌作用与植物对金属毒害的抗性[J].应用生态学报,2000,11(2):315-320.
[33]王广林,张金池,庄家尧,等.31种园林植物对重金属的富集研究[J].皖西学院学报,2011,27(5):83-87.
[34]涂 从,郑春荣,陈怀满.土壤-植物系统中重金属与养分元素交互作用[J].中国环境科学,1997,17(6):526-529.
[35]Van A F,Clijsters H.Effects of metals on enzyme activity in plants.Plant, Cell &Environment, 1990, 13(3): 195-206.
[36]Symeonidis L, Karataglis S.The effect of lead and zinc on plant growth and chlorophyllcontent of Holcus lanatus L[J].Journal of Agronomy and Crop Science,1992, 168(2):108-112.
[37]Fontes R L F,Cox F R.Iron deficiency and zinc toxicity in soybean grown in nutrient solution with different levels of sulfur[J].Journal of Plant Nutrition,1998,21(8):1715-1722.

