闭路循环动态针捕集/气相色谱-质谱法测定卷烟烟丝挥发性成分
李远根,吴穹曼,寇天舒,赵 彬,张艳芳,何爱民,苏国岁
(河北中烟工业有限责任公司 技术中心,河北 石家庄 050051)
卷烟中挥发性成分作为决定卷烟品质的重要因素,直接影响卷烟产品的吸味特征[1-4],因此,卷烟烟丝中挥发性化学成分的测定作为判断产品品质的重要鉴别手段一直备受关注。目前,卷烟挥发性成分测定时样品预处理的常用方法有同时蒸馏萃取[5-6]和顶空-固相微萃取法[7-8]。蒸馏萃取法重现性好,但长时间高温加热会导致美拉德反应和焦糖化反应加剧,副产物增多[9];固相微萃取法灵敏度高,但受单一涂层限制,易对部分目标组分产生歧视效应,重复性差[10],且萃取纤维头比较脆弱,易损坏。
本实验采用一种新型动态顶空技术——动态针捕集(Needle trap,NT)进行样品预处理,NT兼具灵活的主动吸附捕集与固相微萃取的简便、快速,以及易与气相色谱联用的优点,可单独或分段填充不同吸附材料[11]。目前该技术在大气、水质分析测定中已有应用[11-15],但在卷烟烟丝测定方面尚未见报道。本文建立了浸入式闭路循环动态针捕集/气相色谱-质谱测定卷烟烟丝中挥发性化学成分的方法,旨在为卷烟烟丝中挥发性化学成分捕集提供一种更有效的手段。
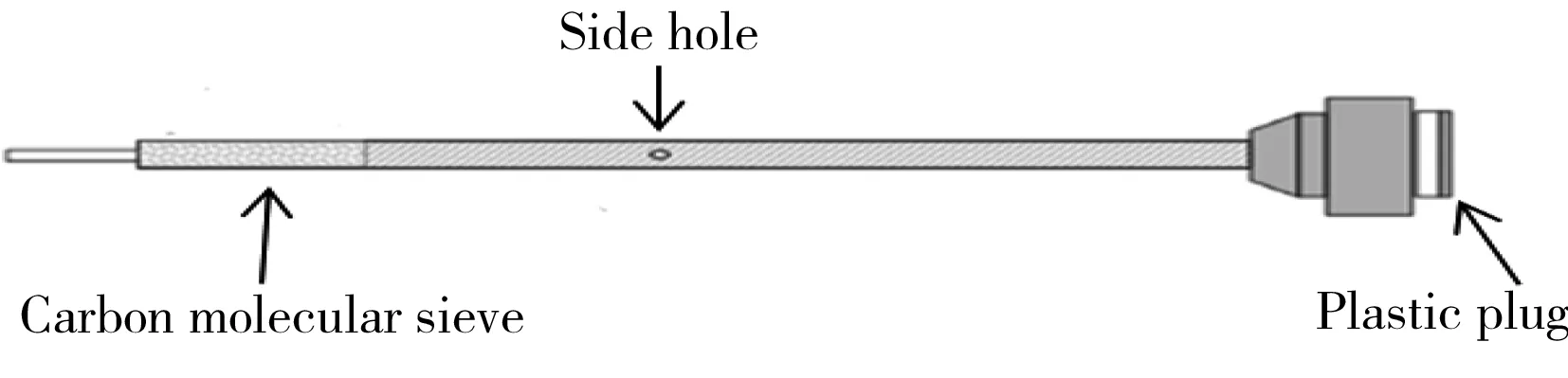
图1 Needle trap动态捕集针及衬管示意图Fig.1 Schematic diagram of capture needle and liner of needle trap
1 实验部分
1.1 仪器与试剂
市售卷烟。
Needle trap动态捕集针和配套的窄径衬管(如图1,内填充Carboxen1000)、针捕集采样箱(上海新拓分析仪器科技有限公司);SPME固相微萃取头(PDMS/DVB,65 μm)、10 mL带橡胶垫螺纹顶空进样瓶(美国Supelco公司);Agilent 7890B/5977A气相色谱-质谱联用(GC-MS)仪;可调精密加热器(自制);电子天平(感量:0.000 1 g,德国Sartorius公司)。
1.2 实验方法
1.2.1NT萃取方法NT首次使用前于250 ℃活化处理30 min。每次使用后于280 ℃净化5 min。
取1.0 g烟丝置于顶空瓶中,压紧瓶盖。将顶空瓶按图2A连接于浸入式闭路循环捕集系统,并放入萃取加热器中加热,恒流泵流速为3 mL/min,于80 ℃保持30 min,萃取完毕后于250 ℃色谱进样口解吸进样5 min。
1.2.2SPME萃取方法65 μm萃取纤维头首次使用前于250 ℃活化处理30 min。取1.0 g烟丝置于顶空瓶中,压紧瓶盖,将萃取头插入顶空瓶,于80 ℃萃取30 min,萃取完毕后于250 ℃色谱进样口解吸进样5 min。
1.3 GC-MS分析条件
色谱柱:DB-5 MS(30 m×0.25 mm×0.25 μm)毛细管柱;载气为He(纯度为99.999%);恒压模式:70 kPa;升温程序:40 ℃保持5 min,以3 ℃· min-1升温至250 ℃,保持5 min;进样方式:不分流进样;进样口温度:250 ℃;传输线温度:250 ℃;电离方式:EI;电离能量:70 eV;离子源温度220 ℃;四极杆温度:160 ℃;扫描质量范围:33~450 amu;溶剂延迟:2 min。采用NIST标准谱库检索并结合相关文献定性,面积归一化法定量。

图2 4种提取采样方式示意图Fig.2 Schematic diagrams of four sampling methods

图3 不同萃取方式萃取结果的比较Fig.3 Comparison of four sampling methods
2 结果与讨论
2.1 NT萃取条件的优化
2.1.1提取方式的选择为使NT萃取效果达到最优,对比了如图2所示的4种提取方式[11]:(A)加热密闭循环吹扫-NT,吹扫针浸入样品;(B)加热密闭循环吹扫-NT,吹扫针未浸入样品;(C)加热密闭非循环吹扫-NT;(D)将NT置于顶空中,通过顶空中目标物的自由扩散进行捕集。通过对比总峰面积和化合物数量,考察了不同提取方式对提取效果的影响。结果可知,方式A的提取效果明显优于其它方式(图3)。这是由于加热并浸入吹扫样品,加速了样品中目标物的逸出和固相与气相间的质量传递;强制密闭循环回路可使目标组分快速、反复接触吸附剂而被吸附剂吸附。故本实验采用加热密闭循环吹扫-NT提取方式。
2.1.2解吸温度与解吸时间的选择解吸时间和温度是影响分析结果的关键因素。本实验考察了不同解吸温度(220~260 ℃)和解吸时间(2~6 min)对总峰面积的影响。结果表明,目标物的总峰面积随温度升高而增大,当温度达250 ℃时,总峰面积趋于平稳;而且随解吸时间延长,总峰面积增大,当解吸时间为5 min时,总峰面积趋于平稳。因此本实验选择解吸温度为250 ℃,解吸时间为5 min。
2.1.3吹扫流速的选择吹扫流速是影响提取效率的重要因素[15]。本实验选择烟草中4种典型的挥发性成分(苄醇、乙基麦芽酚、二氢猕猴桃内酯和巨豆三烯酮B)进行流速优化。结果表明,当吹扫流速从1 mL/min增至3 mL/min时,目标物的提取量逐步增加,而继续提高流速,则提取量呈减少趋势。这是因为在NT发生体积穿透之前,随着流速的提高,NT对目标物的提取量不断增加,但气流流速的不断增加,会使某些目标物不易被NT吸附而发生穿透或被二次解吸,致使提取量下降[16-17];同时NT针内径细,当线速度过大时,顶空瓶内产生较高的压力可能导致密封隔垫泄漏而造成目标组分损失,而且容易损坏探针[11]。因此本实验选择吹扫流速为3 mL/min。
2.1.4提取温度的选择提取温度是影响挥发性成分分配系数[18]的关键因素。本实验考察了提取温度(60~90 ℃)对烟草中上述4种典型挥发性成分峰面积的影响。结果表明,随着温度的升高,烟丝中挥发性成分提取量的增速变缓。这是因为在提取过程中,分配系数与温度密切相关,升高样品温度,可加快目标物在NT萃取头上的扩散速度,提高分析灵敏度;但温度升高会降低目标物在NT萃取头的分配系数,从而减小固相吸附量。因此,选择最佳提取温度为80 ℃。
2.1.5提取时间的选择考虑到NT吸附容量和挥发性成分传质速率等因素[19],考察了采样时间(10~40 min)对烟草中上述4种典型挥发性成分峰面积的影响。结果表明,随着采集时间延长,提取量增加,但采集时间超过30 min时,提取量呈下降趋势。这可能是因为发生了吸附穿透以及过多的水蒸气抑制了吸附剂对目标组分的吸附[11]。因此,确定最佳采集时间为30 min。
2.1.6NT解吸率将解吸后的NT探针按照“1.2.1”的净化方法(280 ℃,5 min)再次进行解吸,分析NT中残留的挥发性成分,计算NT解吸率(表1)。结果表明,在NT检出的45种挥发性成分中,有40种解吸率高于95%,4种在85%~95%之间,仅有1种挥发性成分的解吸率低于85%,说明NT的解吸率较高;个别目标物的解吸率较低,是因为Carboxen1000内部有许多微孔和亚微孔,出现不可逆吸附。

表1 烟丝中挥发性、半挥发性成分的测定结果Table 1 Determination results of volatile and semi-volatile components in tobacco
(续表1)

PeakCompoundRetentiontime/minResponsevalue(×106)NTSPMEDesorptionefficiencyofNT/%RSD(n=5)/%NTSPME103⁃Pyridinecarbonitrile(3⁃氰基吡啶)24 6092 05-100 07 6-11Ethanone,1⁃(1H⁃pyrrol⁃2⁃yl)⁃(2⁃乙酰基吡咯)26 7913 78-100 09 7-12Ethanone,1⁃(3⁃pyridinyl)⁃(3⁃乙酰基吡啶)28 8960 56-100 06 3-13Nicotinylalcohol(3⁃吡啶甲醇)29 2970 46-100 014 7-14Phenol(苯酚)30 086-0 77--4 615N⁃Methyl⁃2⁃(4⁃chlorophenyl)eth⁃2⁃en⁃2⁃yl⁃1H⁃benzimidazole(N⁃甲基⁃2⁃(4⁃氯苯基)⁃2⁃乙烯⁃2⁃酰基⁃1H⁃苯并咪唑类)30 809-0 48--7 716Ethanol,2⁃(2⁃butoxyethoxy)⁃(二乙二醇丁醚)31 8502 391 2592 12 18 1174H⁃Pyran⁃4⁃one,2⁃ethyl⁃3⁃hydroxy⁃(乙基麦芽酚)32 3750 480 4993 83 16 1183⁃Pyridinecarboxylicacid(烟酸)33 2891 22-100 02 2-194H⁃Pyran⁃4⁃one,2,3⁃dihydro⁃3,5⁃dihydroxy⁃6⁃methyl⁃(2,3⁃二氢⁃3,5⁃二羟基⁃6⁃甲基,4H⁃吡喃⁃4⁃酮)33 345-0 18--3 920Phthalicanhydride(苯酐)36 8100 33-100 02 3-21Pyridine,3⁃(1⁃methyl⁃2⁃pyrrolidinyl)⁃,(S)⁃(烟碱)37 334160 258 2498 16 57 922Triacetin(三乙酸甘油酯)37 9301 220 0891 83 78 4232⁃Furancarboxaldehyde,5⁃(hydroxymethyl)⁃(5⁃羟甲基糠醛)38 104-0 21--12 324Tricyclo[2 2 1 0(2,6)]heptane,1,3,3⁃trimethyl⁃(1,3,3⁃三甲基⁃三环[2 2 1 0(2,6)]庚烷)38 2132 92-100 06 0-251H⁃Pyrrole⁃2,5⁃dione,3⁃ethyl⁃4⁃methyl⁃(3⁃乙基⁃4⁃甲基,1H⁃吡咯⁃2,5⁃二酮)39 342-0 17--14 526Vanillin(香兰素)39 6400 810 12100 01 13 2275,9⁃Undecadien⁃2⁃one,6,10⁃dimethyl⁃,(E)⁃(香叶基丙酮)41 4502 770 25100 03 74 128Hexadecane,2,6,11,15⁃tetramethyl⁃(2,6,11,15⁃四甲基⁃十六烷)41 6740 68-100 09 7-29p⁃Isopropenylphenol(p⁃异丙烯基苯酚)42 2700 95-100 01 9-301H⁃Pyrazole,3⁃methyl⁃1⁃phenyl⁃(3⁃甲基⁃1⁃苯基吡唑)43 15542 08-100 07 5-316,8⁃Nonadien⁃2⁃one,8⁃methyl⁃5⁃(1⁃meth⁃ylethyl)⁃,(E)⁃(茄酮)45 378-16 23--5 2322(4H)⁃Benzofuranone,5,6,7,7a⁃tetra⁃hydro⁃4,4,7a⁃trimethyl⁃,(R)⁃(二氢猕猴桃内酯)45 5785 251 41100 09 34 2332⁃Buten⁃1⁃one,1⁃(2,6,6⁃trimethyl⁃1,3⁃cyclohexadien⁃1⁃yl)⁃,(E)⁃(β⁃大马烯酮)45 867-0 93--2 934MegastigmatrienoneA(巨豆三烯酮A)46 4921 591 95100 05 45 835MegastigmatrienoneB(巨豆三烯酮B)47 1656 310 75100 08 03 736Hexadecane(十六烷)47 3591 59-100 010 4-37Pyridine,3⁃(3,4⁃dihydro⁃2H⁃pyrrol⁃5⁃yl)⁃(麦斯明)47 510-0 27--4 138Dodecane,4⁃methyl⁃(4⁃甲基⁃十二烷)47 5356 31-100 03 1-393⁃Methyl⁃4⁃phenylpyrazole(3⁃甲基⁃4⁃苯基吡唑)47 9140 79-100 02 5-403⁃Hydroxy⁃β⁃damascone(3⁃羟基⁃β⁃大马酮)48 4031 391 01100 03 16 041MegastigmatrienoneC(巨豆三烯酮C)48 5920 980 91100 04 93 142MegastigmatrienoneD(巨豆三烯酮D)49 0346 190 48100 03 62 3433⁃Methylcinnamicacid(3⁃甲基苯乙烯酸)49 574-0 53--1 1442⁃Cyclohexen⁃1⁃one,4⁃(3⁃hydroxy⁃1⁃bute⁃nyl)⁃3,5,5⁃trimethyl⁃(4⁃(3⁃羟基⁃1⁃丁烯基)⁃3,5,5⁃三甲基,2⁃环己烯⁃1⁃酮)49 6241 913 40100 05 75 3
(续表1)
PeakCompoundRetentiontime/minResponsevalue(×106)NTSPMEDesorptionefficiencyofNT/%RSD(n=5)/%NTSPME452,3′⁃Dipyridyl(2,3′⁃联吡啶)52 598-0 52--2 446Benzylbenzoate(苯甲酸苄酯)53 8811 490 17100 01 13 247Oxalicacid,butyl6⁃ethyloct⁃3⁃ylester(6⁃丁基草酸酯)55 099-3 44--5 4487,11,15⁃Trimethyl⁃3⁃methylidene⁃hexadec⁃1⁃ene(新植二烯)55 745278 120 95100 03 62 549Phthalicacid,isobutylpentadecylester(邻苯二甲酸异丁基十五烷基酯)56 8181 10-100 02 4-50Aceticacid,3,7,11,15⁃tetramethyl⁃hexadecylester(3,7,11,15⁃四甲基,十六基乙酸酯)57 895-3 54--5 951Pentadecanoicacid,14⁃methyl⁃,methyles⁃ter(十五烷酸14甲基,甲基酯)58 2091 106 98100 03 07 5525,9,13⁃Pentadecatrien⁃2⁃one,6,10,14⁃trimethyl⁃,(E,E)⁃(法尼基丙酮)58 5062 98-100 01 2-53(E,E)⁃7,11,15⁃Trimethyl⁃3⁃methylene⁃hexadeca⁃1,6,10,14⁃tetraene(6E,10E)⁃(7,11,15⁃三甲基⁃3⁃亚甲基⁃1,6,10,14⁃十六四烯)59 3435 17-100 01 7-54Tetradecanoicacid,ethylester(肉豆蔻酸乙酯)60 0616 53-100 07 7-559,12,15⁃Octadecatrienoicacid,ethyles⁃ter,(Z,Z,Z)⁃(亚油酸乙酯)64 4780 301 52100 01 25 6565,9,13⁃Pentadecatrien⁃2⁃one,6,10,14⁃trimethyl(金合欢基丙酮)69 2530 270 21100 00 73 157Eicosane(二十烷)75 6510 231 66100 01 36 9
*no detected

图4 NT捕集所得的烟丝代表性总离子流色谱图Fig.4 Representative total ion flow chromatogram of tobacco by NT method
2.2 方法评价
2.2.1卷烟烟丝的分析结果采用NT-GC/MS对卷烟烟丝进行分析(图4),各色谱峰对应的质谱图经人工解析及计算机谱库检索确定其化学成分,共鉴定出45种化合物。其中包含烟草中常见醇类、醛类、酮类、酯类和吡啶类等烟草本身特征性香味成分,以及烟草常用香味添加剂,表明在本文优化的条件下,NT能有效捕集烟草中的常见挥发性香味成分,适用于卷烟烟丝中挥发性成分的捕集。
2.2.2NT与SPME的比较采用文献[19]中优化的萃取头及萃取、解吸参数,应用SPME法分析卷烟烟丝的挥发性成分。从NT法和SPME法对比结果(表1)可知:①采用NT法吸附共鉴定出45种化合物,与SPME法鉴定出的35种化合物相比,NT法鉴定出的化合物数量和总峰面积均高于SPME法。②采用NT法吸附,有27种物质的相对标准偏差(RSD)小于5%,占挥发性成分的60%;RSD 大于10%的有2种,占挥发性成分的4.44%;而采用SPME法有16种物质的RSD小于5%,占挥发性成分的45.71%;RSD 大于10%的有2种,占挥发性成分的5.71%。因此,NT的重复性优于SPME。③NT提取的化合物多为能够体现烟草特征风格的低沸点挥发性成分,而SPME提取的化合物中高沸点挥发性成分较NT更多,因此NT更适于烟草中挥发性半挥发性物质的捕集。
3 结 论
本文建立了快速、简单、准确测定卷烟中挥发性成分的闭路循环动态针捕集/气相色谱-质谱测定方法。采用内部填充Carboxen1000的Needle trap动态捕集针对样品进行萃取、富集,避免了SPME萃取法因涂层单一导致的歧视效应,提高了捕集效果。方法的灵敏度高、重复性好,适用于卷烟中挥发性成分的萃取、分析。
参考文献:
[1] Sakaki T,Sakuma H,Sugawara S.Agric.Boil.Chem.,1984,(48):2719-2724.
[2] Sakaki T,Niino K,Sakuma H,Sugawara S.Agric.Biol.Chem.,1984,(48):3121-3128.
[3] Tang G L,Liu H M.J.Instrum.Anal.(唐纲岭,刘惠民.分析测试学报),2001,20(7):279-280.
[4] Gao Q,Chen L,Yu L,Liu B Z.AcademicSymposiumonTobaccoTechnologyoftheIndustrialSpecializedCommitteeofChinaTobaccoSociety(郜强,陈磊,余苓,刘百战.中国烟草学会工业专业委员会烟草工艺学术研讨会论文集),2010:211-218.
[5] Li Y Q,Xian K F.TobaccoSci.Technol.(李炎强,冼可法.烟草科技),2000,(2):18-21.
[6] Wu L J,Duan J,Li C Z,Cao J L,Li Q Q,Min S G.J.Anal.Sci.(吴丽君,段佳,李春子,曹金莉,李倩倩,闵顺耕.分析科学学报),2012,28(6):807-810.
[7] Liu B Z,Zhang Y,Sun L,Zhuang Y D,Qiu F Y.J.Instrum.Anal.(刘百战,张映,孙磊,庄亚东,仇方沂.分析测试学报),2000,19(4):28-31.
[8] Li Q L,Chen L,Yang W B,Huang Z X.TobaccoSci.Technol.(李庆龙,陈玲,杨文斌,黄祖萱.烟草科技),2000,(2):21-24.
[9] Sun K J,Wang M L,Shen Y,Liu B Z.Chin.TobaccoSci.(孙凯健,王美琳,沈轶,刘百战.中国烟草科学),2007,28(2):23-26.
[10] Lü J,Ruan X M,Sheng Z Y,Xu H T,Li Y Q.TobaccoSci.Technol.(吕健,阮晓明,盛志艺,徐海涛,李炎强.烟草科技),2003,(2):25-28.
[11] Gao S,Liu Y Y,Liu N.Chin.J.Anal.Chem.(高松,刘园园,刘娜.分析化学),2012,40(9):1353-1359.
[12] Eom I,Tugulea A,Pawliszyn J.J.Chromatogr.A,2008,1196/1197:3-9.
[13] Eom I,Niri V,Pawliszyn J.J.Chromatogr.A,2008,1196/1197:10-14.
[14] Warren J M,Pawliszyn J.J.Chromatogr.A,2011,1218(50):8982-8988.
[15] Li X,Chen J M.Environ.Sci.(李想,陈建民.环境科学),2011,12(32):3613-3616.
[16] Gao S,Deng Y Z,Li Y Q.RockMiner.Anal.(高松,邓银舟,李玉芹.岩矿测试),2015,34(4):480-486.
[17] Lord H L,Zhan W,Pawliszyn J.Anal.Chim.Acta,2010,677(1):3-18.
[18] Ma Q L,Hamid N,Bekhit A E D,Robertson J,Law T F.Microchem.J.,2013,111:16-24.
[19] Yang J,Duan Y X,Zhao W,Yang L,Han J M,Zhu D L,Gong X W,Miao M M,Chen Y K.TobaccoSci.Technol.(杨继,段沅杏,赵伟,杨柳,韩敬美,朱东来,巩效伟,缪明明,陈永宽.烟草科技),2015,48(4):42-48.

