刺山柑果实精制提取物抗类风湿关节炎的实验研究
周海凤, 乐心逸, 王娴娴, 丁广宇, 李默影, 沈龙海, 吴 彤
(中国医药工业研究总院上海医药工业研究院, 上海 200437)
类风湿关节炎(rheumatoid arthritis, RA)是以关节滑膜慢性、进行性炎症损伤为特征, 临床表现为慢性、自残性自身免疫性疾病[1]。佐剂性关节炎(AA)由细菌学家Freund于20世纪50年代创立, 又称弗氏佐剂关节炎, 是免疫性动物模型的基础方法[2]。炎症以踝关节为重, 可侵及足垫、全足[3]。AA的发病原理与RA相似,为一种典型的免疫性炎症反应,且AA大鼠造模的方法简单易行,其病理表现与RA临床反应类似,故在我国被广泛用于RA或防治RA药物的研究。II型胶原是一种与免疫系统隔绝的蛋白, 有报道[4]证明50%的RA患者血清中存在有抗II型胶原的自身抗体, 证明了II型胶原能诱发胶原诱导关节炎(CIA), CIA模型是目前作为抗RA药物研究中被认为最接近人类RA的实验动物模型。
刺山柑(Capparis spinosaL.)属白花菜科(capparidaceae)山柑属(capparis)植物,其原产于地中海地区,后被广泛种于亚洲西部和中部地区[5]。其未成熟的花蕾、果实和芽被作为烹饪中的食物或调味品食用。该植物的不同部分, 包括花蕾、果实、种子、茎、根和皮, 作为民族药被用于各种疾病的治疗,如风湿、胃痛、头痛、牙痛等[6]。我国维吾尔族民间用于治疗风湿病, 有祛风、散寒、除湿的作用[7]。研究[8]表明刺山柑活性部位中主要含有三类化学成分: 吲哚类、黄酮类、酚酸类化合物。其中双黄酮类化合物具有很好的NF-κB抑制活性[9]。本文开展了刺山柑精制提取物在佐剂和II型胶原两种致炎剂诱导的RA模型中的应用,实验结果显示刺山柑精制提取物具有预防和治疗RA疾病的开发前景。
1 材料与方法
1.1 实验动物
AA造模,采用清洁级雄性SD大鼠30只,体质量(200±20) g; CIA造模: 采用对胶原免疫反应更为敏感的清洁级雌性Wistar大鼠40只,体质量(130±10) g; 以上大鼠均购自上海西普尔-必凯实验动物有限公司[SCXK(沪)2008-0016]; 饲养于屏障设施[SYXK(沪)2014-40018], 温度 24~26℃, 相对湿度 60%~70%,自由饮食饮水。
1.2 受试药物
刺山柑精制提取物主要由刺山柑药材(产地: 吐鲁番)使用回流法煎制浓缩的浸膏采用水提醇沉和乙酸乙酯萃取法精制而成,制备法参考专利文献[10],得率为1.14‰,批号20151003。阳性药使用临床常用药吲哚美辛肠溶片(上海信谊黄河制药有限公司批号: A100101)。
1.3 仪器与试剂
弗氏完全佐剂(Freunds Adjuvand in Complete),购自荷兰Difco公司, 批号: 23553464; II型胶原(CII,牛软骨中提取) 购自美国Sigma公司, 编号: C7806-160 mg 035k3748 CAS 9007-34-5; 肿瘤坏死因子-α(TNF-α)、白细胞介素 -1(IL-1)和干扰素 -γ(IFN-γ)检测试剂盒均购自上海欲立生物科技有限公司。YLS-7A 足趾容积测量仪,购自荷兰Herga Electric公司; Varioskan Flash 全波长扫描式多功能读数仪购自美国Thermo Scientific公司。
1.4 实验方法
1.4.1 刺山柑提取物治疗大鼠AA 30只大鼠取其中24只随机分4组,每组6只,以弗氏完全佐剂(10 mg/kg) 0.1 mL右后足跖皮下注射致炎, 剩余大鼠麻醉处死后取关节滑膜冷冻备用。造模大鼠造模前和造模后15 d内每3 d以足趾容积测量仪用排水法测量致炎足及未致炎足的足垫体积, 观察造模是否成功。确定造模成功后从15 d起连续给药10 d, 其中刺山柑提取物低剂量组100 mg/kg、刺山柑提取物高剂量组200 mg/kg、吲哚美辛阳性药组2 mg/kg。记录致炎和给药前后的大鼠足垫肿胀体积, 其中肿胀度 =(致炎后体积/致炎前体积-1)×100%, 抑制率 =(1-给药组肿胀率/模型组肿胀率) × 100%, 计算肿胀度和抑制率。给药结束(致炎后25 d), 处死动物,取所有大鼠踝关节周围组织制备匀浆液, 测定组织液中TNF-α、IL-1、IFN-γ水平的变化, 该操作严格按照试剂盒说明书进行。
1.4.2 刺山柑提取物治疗II型胶原诱导的大鼠类风湿性关节炎 致炎剂配置: II型胶原溶解在0.05 mol/L醋酸中,配置成终浓度为2 g/L胶原溶液, 4 ℃过夜,次日将II型胶原溶液滴加至冷的弗氏完全佐剂中, 充分乳化(II型胶原液: 弗氏完全佐剂=1∶1),使终浓度为1g/L II型胶原乳剂。
分组和给药: 40只大鼠取5只为正常对照组,其余35只大鼠分5点皮内注射免疫(尾部及背皮内四点),每点0.1 mL,共0.5 mL含有II型胶原量为0.5 mg,7 d后以同样方法追加免疫一次。在造模20 d选取足关节出现明显肿胀, 足背面也开始红肿的成功致敏大鼠15只,随机分为3组,每组5只,分别为模型组[给予相应溶剂(生理盐水)]、刺山柑提取物组(50 mg/kg)、阳性药组(吲哚美辛2 mg/kg)。以上大鼠每日灌胃给药1次, 持续14 d(剂量为50 mg/kg),造模成功后(20 d起)每周2次以足趾容积测量仪用排水法测量大鼠足关节肿胀值,计算肿胀率及抑制率。
1.5 统计学方法
所有数据均用Excel 2007软件进行统计处理, 以±s表示, 采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 刺山柑提取物对大鼠AA治疗作用
造模过程中各组动物造模趾在致炎3 d内肿胀值迅速升高, 在9~12 d达到高峰, 由表1可见, 造模15 d与0 d相比大鼠致炎侧足体积有差异有显著统计学意义(P<0.01)。此时与正常大鼠比较, 可见造模大鼠的耳廓、尾部、前肢均出现了明显的红肿,前肢的足跖有明显的小关节突出。造模过程中大鼠日常行为出现明显的行动困难,致炎侧踝关节下全部足爪肿胀, 部分大鼠在15 d时未注射佐剂一侧(对侧非致炎足)因迟发性病变部分出现足垫肿胀,各组大鼠在同一时间组间肿胀度比较无显著差异。
表1数据显示, 刺山柑提取物对大鼠AA继发性病变具有一定的治疗作用, 其中刺山柑低剂量组在20~27 d与模型相比差异有统计学意义(P<0.05),抑制率分别为12.4%、14.7%、16.2%,抑制率呈现上升趋势; 刺山柑高剂量组在连续给药3 d后与模型对照组相比差异有统计学意义(P<0.05)并一直持续至实验结束, 抑制率最高可达到26.8%。刺山柑不同剂量组与阳性药组相比抑制率差异无统计学意义,提示刺山柑提取物有部分抗炎效果。
由表2可见,与正常对照大鼠比较,模型组大鼠的血清中TNF-α,IL-1,IFN-γ的含量与均有极显著上升(P<0.01), 提示造模成功,不同剂量给药组与模型组相比均能显著降低大鼠血清中TNF-α和IL-1的含量(P<0.05),其中刺山柑提取物低剂量、高剂量均能极显著下调IFN-γ含量(P<0.01),刺山柑不同剂量组与阳性药组相比治疗效果差异无统计学意义,提示了刺山柑提取物可通过调节对TNF-α,IL-1,IFN-γ的表达而起到抗炎作用。
2.2 刺山柑提取物对大鼠CIA的治疗作用
致炎过程中大鼠体质量无明显增长、精神萎靡、尾尖部出现溃烂灶,背部注射部位也都有溃烂灶,造模18 d部分大鼠足关节开始红肿,20 d大鼠的足关节已明显红肿,部分大鼠对恻足和前爪也出现红肿,造模成功率约50%。给药的前3 d无明显作用,一周后各给药组开始出现不同程度的足关节的肿胀抑制作用,外观可见大鼠足趾红肿逐渐消退,活动趋向正常,而模型组动物足关节依然肿胀、红肿,行动不便,有的双肢瘫痪,消瘦、萎靡,体质量减轻,但差异无明显统计学意义。
如表3所示, 刺山柑提取物在给药后3 d, 开始出现一定程度的抑制足关节的肿胀,致炎后27 d、30 d、34 d与模型组比较的抑制率分别为33.8%、47.2%、40.3%, 差异有一定统计学意义(P<0.05),提示刺山柑提取物存在抑制特异性免疫,改善类风湿性关节炎的作用。
3 讨论
刺山柑的果实、叶、花和根皮在维吾尔族民间均可作为治疗类风关药物使用, 根皮应用最广; 常用方法为敷于患处和口服[11]。文献多报道刺山柑果实、花、根皮的粗提物具有抗炎镇痛作用[12]、降糖[13]、利尿、抗高血压、外敷治疗关节炎等[14]。本文首次采用刺山柑果实的精制提取物[10]为研究对象, 并通过弗氏完全佐剂和II型胶原两种致炎剂建立的大鼠类风湿性关节炎模型评价其抗类风湿关节的药效作用,同时考察了其可能的作用机制。
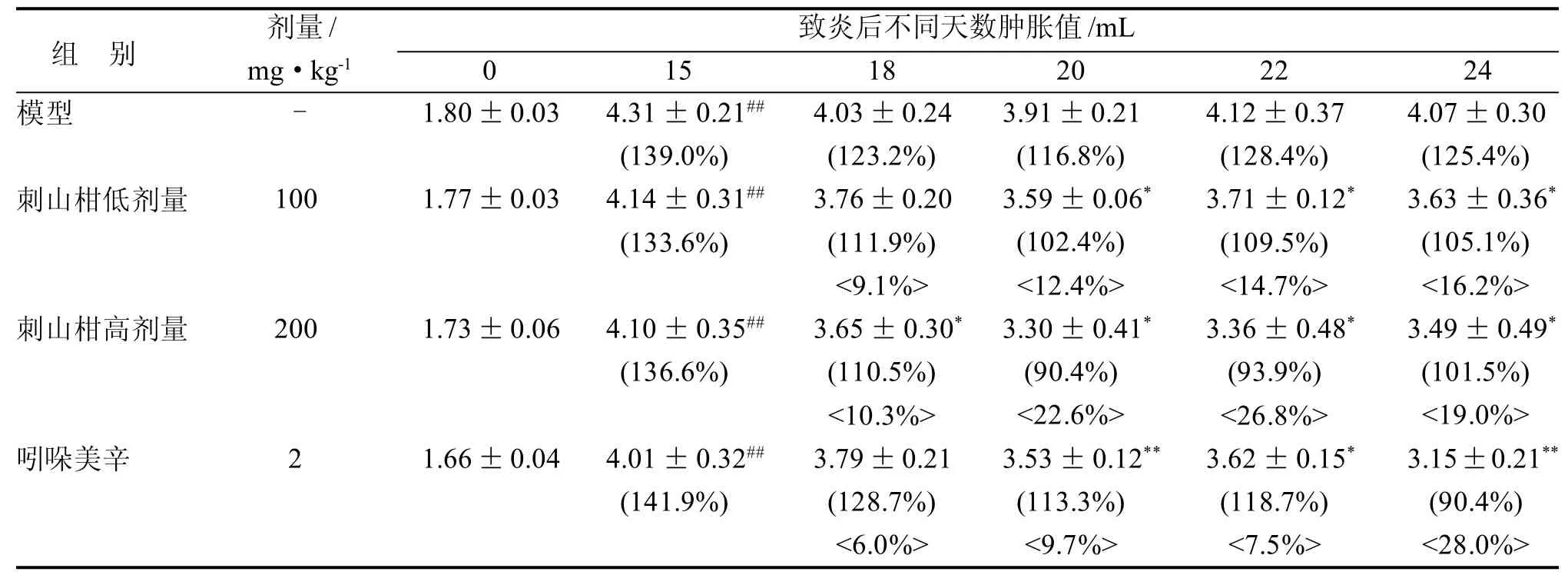
表1 刺山柑提取物对AA大鼠致炎侧的治疗作用

表2 刺山柑提取物对AA大鼠血清内炎症因子的影响

表3 刺山柑提取物对CIA大鼠致炎侧的治疗作用
研究结果表明,刺山柑精制提取物对大鼠AA继发性病变具有一定的治疗作用,其中刺山柑低剂量(100 mg/kg)组给药一周后与模型组比有显著差异(P<0.05), 抑制率分别为12.4%、14.7%、16.2%, 抑制率呈现上升趋势; 刺山柑高剂量(200 mg/kg)组在连续给药3 d后与模型对照组比差异有统计学意义(P<0.05), 该显著差异一直持续至实验结束,高剂量的抑制率基本稳定在20%以上; 同时刺山柑提取物能通过调节对TNF-α, IL-1, IFN-γ的表达而起到抗炎作用。
刺山柑提取物对CIA同样有效,从给药3 d起开始起效, 致炎27 d、30 d、34 d与模型组比较抑制率分别为33.8%、47.2%、40.3%差异具有统计学意义(P<0.05)。
以上实验结果为刺山柑果实提取物进一步开发为抗RA疾病的药物提供实验依据。
[1]Binder MD, Hirokawa N, Windhorst U. Rheumatoidarthritis(RA) [M]. Vienna: Springer, 2009:185-186.
[2]李仪奎. 中药药理实验方法学[M]. 上海: 上海科学技术出版社, 1991:3.
[3]Easser RE, Hildebrand AR, Angelo RA, et al. Measurement of radiographic changes in adjuvant - induced arthritis in rats by quantitative image analysis[J]. Arthritis Rheum, 1995, 38(1):129-138.
[4]Trentham DE, Townes AS, Kang AH. Autoimmunity to type II collagen an experimental model of arthritis[J]. J Exp Med,1977, 146(3):857-868.
[5]Tlili N, Elfalleh W, Saadaoui E, et al. The caper (CapparisL.): Ethnopharmacology, phytochemical and pharmacological properties[J]. Fitoterapia, 2010, 82(2):93-101.
[6]Tesoriere L, Butera D, Gentile C, et al. Bioactive components of caper (Capparis spinosaL.) from Sicily and antioxidant e ects in a red meat simulated gastric digestion[J]. J Agric Food Chem, 2007, 55(21):8465-8471.
[7]罗俊, 谢阳. 维药刺山柑果治疗痛风风湿病15例[J]. 中国民族医药杂志. 1999(2):3-3.
[8]Haifeng Zhou, Renji Jiang, et al. Anti-inflammatory effects of Caper (Capparis spinosaL.) fruit aqueous extract and the Isolation of main phytochemicals[J]. J Agric Food Chem,2010, 58(24):12717-12721.
[9]Haifeng Zhou, Chenghui Xie, Renji Jiang, et al. Biflavonoids from Caper (Capparis spinosaL.) fruits and their effects in inhibiting NF-kappa B activation[J]. J Agric Food Chem,2011, 59(7):3060-3065.
[10]周海凤, 乐心逸, 吴彤, 等. 刺山柑提取物、其制备方法及应用[P]. 中国发明专利. 201710672050.8.
[11]买买提江·吐尔逊, 艾沙江·阿不都沙拉木, 阿曼古丽·依马木山. 刺山柑在吐鲁番地区维吾尔族民间药用价值研究[J]. 云南民族大学学报:自然科学版, 2015, 24(2):156-159.
[12]高莹莹, 敖明章, 万军梅, 等. 维药刺山柑醇提物抗炎镇痛作用的实验研究[J]. 中药材, 2007, 30(6):702-704.
[13]Eddouks M, Lemhadri A, Michel JB. Caraway and caper:potential anti-hyperglycaemic plants in diabetic rats[J]. J Ethnopharmcol, 2004, 94(1):143-148.
[14]Panico AM, Cardile V, Garufi F, et al. Protective effect ofCapparis spinosaon chondrocytes[J]. Life Sci, 2005, 77(20):2479-2488.

