43例贲门失弛缓症患者回顾分析
杨 琴,吕沐瀚,唐世孝
(西南医科大学附属医院消化内科,四川泸州 646000)
贲门失弛缓症(achalasiaa,AC)是一种病因不明的以食管下括约肌(lower esophageal sphincter,LES)松弛异常及食管体部缺乏推进性蠕动为特征的食管运动功能障碍性疾病[1]。其发病可能与环境、病毒感染、自身免疫及遗传有关,情绪及精神压力可能为其诱发因素。AC的主要临床症状为:吞咽困难、反酸、烧心、胸痛、体重下降等。主要检查方法包括胃镜、钡餐造影、胸部CT、食管测压等。现如今没有根除此病的治疗手段,均是通过消除由异常LES功能所引起的食管下段食物流出障碍,从而改善相关的症状[2]。治疗方法包括:①药物治疗,主要是促进胃排空及降低食管压力,如硝酸酯类、钙通道阻滞剂等;②内镜下治疗:食管下段注射肉毒素、球囊(气囊、水囊)扩张、支架扩张、POEM术治疗;③外科手术:经胸或经腹的各种改良的食管贲门部黏膜外肌层切开手术(Heller手术)。该研究拟通过分析收集的43例住院患者的相关信息来探讨关于AC的检查及治疗方案的临床意义。
1 资料与方法
1 资料
1.1 患者信息
我院2014年1月至2017年6月期间,经胃镜、钡餐造影等相关检查诊断为AC的具有完整信息的住院患者共计43例,并排除如食管肿瘤性疾病或强酸、强碱所致器质性吞咽困难患者,或者已明确诊断为GERD所致的以反酸或烧心为主要表现的患者,搜集其姓名、性别、年龄、病程、诱因、主要症状、既往诊治情况、胃镜及钡餐造影检查结果、治疗方式、住院日、住院费用及治疗后3个月随访情况,将上述信息进行统计分析。
1.2 仪器
胃镜Olympus CV-260SL 、Olympus GIF-260,数字胃肠SDR-100购自北京岛津医疗器械有限公司
2 方法
2.1 诊断方法
2.1.1 胃镜检查
可见食管腔内食物潴留,下段可见食管狭窄,狭窄部位以上可见食管扩张。胃镜下活检还可排除食管肿瘤等病变。
2.1.2 X线钡剂造影检查[3]
典型的特点可见食管不同程度的扩张,蠕动减弱或停止,狭窄处呈“鸟嘴征”。
2.1.3 食管测压[4-5]
食管测压是临床诊断AC的金标准,可以测定食管下段括约肌的蠕动及异常松弛以及食管的平均压力。
2.2 治疗方法
2.2.1 内科药物
硝酸异山梨酯片5 mg早餐前舌下含服、硝苯地平片10 mg早餐前舌下含服。
2.2.2 内镜下治疗
水囊扩张、POEM术
2.3 疗效判定
治疗3个月后随访患者,根据症状、胃镜或钡餐造影检查结果综合判断。显效:症状完全缓解,相关检查显示病变消失。有效:症状部分缓解,相关检查显示病变改善,但未完全消失。无效:症状无缓解甚至加重,或症状缓解后复发,相关检查显示病变无改善或加重。某种治疗方式的有效率=(该治疗方式显效患者人数+有效患者人数)/该治疗方式总人数。
2.4 统计方法
使用SPSS 17.0软件对计数资料进行c2检验,对计量资料进行t检验。
2 结 果
2.1 患者各年龄段患病情况比较
43例患者中男22例(51.16%),女 21例(48.84%),男女比为1.05∶1。性别差异无统计学意义(P>0.05)。年龄区间为16~81岁,男女两组年龄均呈正态分布,采用均数±标准差,整体平均年龄为(44.56±15.18)岁,男性平均年龄为(45.19±15.76)岁,女性平均年龄为(43.90± 14.51)岁,男女年龄差异无统计学意义(t=0.29,P=0.3874)以50~59岁为发病高峰期(见图1)。

图143 例AC患者各年龄段患病情况
2.2 AC患者不同诱因比较
43例患者中有诱因30例(69.8%),其中与饮食相关10例(33.3%),与情绪相关12例(40.0%),与精神因素相关11例(36.7%),无诱因13例(30.2%)。有诱因者比例更高,诱因中饮食、情绪、精神三者对AC的发病差异无统计学意义(P=0.866)
2.3 AC患者常见的临床症状
43例患者表现为吞咽困难10例(23.3%),恶心和(或)呕吐22例(51.2%),反酸和(或)烧心29例(67.4%),体重下降14例(32.6%),腹痛、腹胀14例(32.6%),胸痛、胸闷等11例(25.6%)(见图2)。
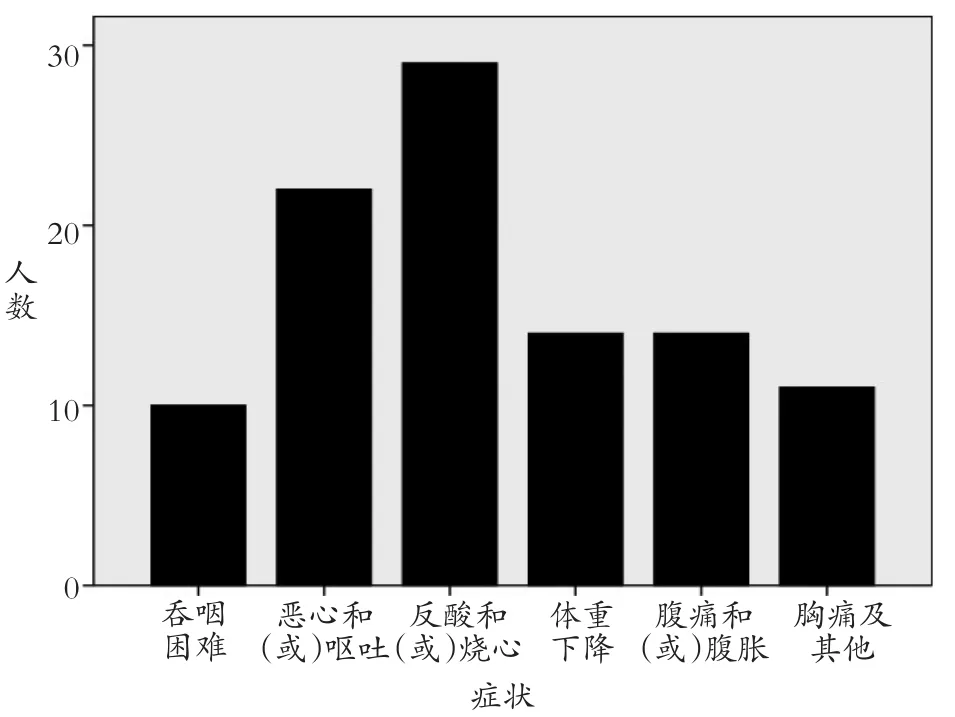
图2 43例AC患者各症状对比
2.4 AC患者胃镜及坝餐检查情况比较
43例患者胃镜检查阳性21例(检出率48.8%),钡餐检查阳性35例(检出率81.4%),其中胃镜及钡餐均阳性14例,均阴性1例(见表1),二者检查均阴性者依据院外食管测压结果及患者症状诊断为AC。胃镜及钡餐造影检查对于AC患者的诊断差异有统计学意义(P=0.019)。43例患者中合并其他食管疾病最多的是GERD16例。
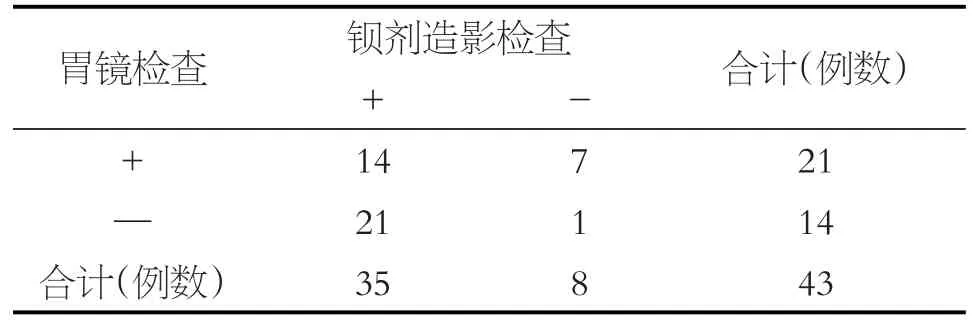
表1 43例AC患者胃镜及钡餐造影检查结果对比
2.5 AC患者不同治疗方式效果的比较
43例患者20例行药物治疗,3月后随访显效4例,有效2例,无效14例,有效率为30.0%。16例行水囊扩张治疗,显效4例,有效2例,无效9例,失访1例,失访者为食管癌患者,已死亡,记为无效,有效率为37.5%。7例行POEM治疗,显效5例,有效1例,无效1例,有效率为85.7%。43例患者中总显效12例,有效6例,无效25例,总有效率41.9%(见表2)。3种治疗方式差异有统计学意义(c2=6.812,P=0.033)。
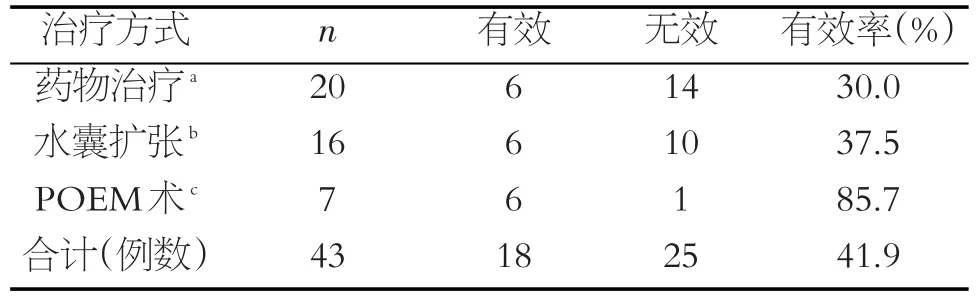
表2 43例AC患者不同治疗方式效果对比
2.6 不同的治疗方式的AC患者的住院日及住院费用情况
43例患者中3种不同治疗方式平均住院日及平均住院费用(见表3)。

表3 43例AC患者平均住院日及平均住院费用
3 讨 论
AC是一种少见病,国内有[6]研究报道该病在成年人群中发病率仅为0.30~1.63/10万人·年,国外有研究报道其发病率为1.6/10万人·年[7],1/10万人·年[8]。有研究[9-10]表明AC的发生在性别上差异无统计学意义,且以30~60岁为发病高峰。本研究男女比例1.05∶1,性别构成差异无统计学意义(P > 0.05),在30~60岁年龄段发病率为67.4%,与多数研究相符合,提示我们在以后的诊疗中需关注30~60岁人群此病的可能性。
AC病因至今不明确,有研究[11]认为精神因素为其主要诱因,可通过脑-肠轴机制影响感觉功能及食管动力。本研究中该病有诱因者比例较无诱因者高(2.3:1),但是诱因中饮食、情绪因素及精神因素三者的构成比差异无统计学意义(P=0.866),仍需大样本数据进行研究,并需关注除上述3种诱因之外有无其他可能诱因影响该病的发生。
有研究[12]认为AC的症状主要为吞咽困难、反流(包括烧心)、胸骨后疼痛及体重下降。本研究各症状的发生率与外文报道有区别。AC患者感到反流和(或)烧心可能与食管蠕动功能减弱、排空受阻,长期食物潴留引起食管黏膜损伤引起不适,这也可能和患者感到胸痛不适有关。主要的检查方式为胃镜、影像学、食管测压。胃镜可见食管腔内食物潴留,下段可见食管狭窄,狭窄部位以上可见食管扩张。胃镜还可排除食管肿瘤、病理性食管狭窄等病变[5,7]。影像学检查主要指钡餐食管造影及CT扫描,典型的钡餐食管造影可见“鸟嘴征”。诊断的金标准为高分辨率食管测压,可以发现食管下括约肌的蠕动障碍,表现为蠕动减弱或停止。有研究认为钡餐造影的阳性检出率较胃镜高,且因该方式无创伤、无痛苦,更易被大众接受,与本研究钡餐剂胃镜阳性率分别为81.8%、48.8%结果相符合,两者差异有统计学意义。但是对于AC早期患者,食管病变往往不典型,容易漏诊,故胃镜及钡餐造影检查均是必要的。该病最易合并GERD,在诊断过程中需注意鉴别。
AC的病因至今尚不明确,现有的治疗方法并不能有效逆转或者阻止贲门周围括约肌神经丛的退行性病变[5]。治疗的核心要点即早期对该病的诊断和预防,以便维持食道的结构和功能。目前较为可行的治疗方案的目的是通过降低LES的张力来缓解食管流出障碍,包括药物治疗、内镜治疗以及外科手术干预治疗。用于松弛平滑肌,减轻LES张力的药物能有效缓解症状,然而这种效果在临床上是有限的,通常情况下这些药物被用于不能耐受侵袭性治疗方案的短期替代治疗或者作为最终治疗方案前的过渡[13]。内窥镜肉毒素注射能有效缓解症状,但效果往往是短暂的[14],与口服药物制剂一样,此方法适用于那些不能忍受侵入性治疗的病人。内镜下水囊扩张方法能准确定位于LES处膨胀,能有效阻断肌肉在该部位的收缩压力,进而达到治疗的目的[15-16]。另外一种有效治疗方案为POEM,自2008年在全球推广以来,获得了广泛的认可,该内镜下手术能在短期内明显改善患者症状,相比于经腹腔Heller肌切开术的创伤性更小,且能达到水囊或气囊扩张的效果[17-18]。POEM优点是从食道到胃的肌肉切开的长度可以自由调整,以适应个别情况,这使POEM更合适,更安全[19]。不仅如此,相比于其他治疗方法,POEM几乎适用于所有种类的食道运动障碍的患者[20-21]。综合来说POEM方案更具有临床指导意义,结合本研究药物治疗、水囊治疗、POEM治疗的有效率分别为30.0%、37.5%、85.7%,POEM治疗较另外两种治疗方式的效果更为显著,差异有统计学意义,结果相一致。不足之处在于行POEM治疗患者平均住院日较其他治疗方案长,且所产生的平均住院费用也相对较高。因此,我们建议患者结合自身病情以及经济条件选择更为适合的治疗方案。
本研究的不足在于我院未开展高分辨率食管测压,可能导致某些病例诊断有误差,且未收集到经胸或腹Heller肌切开术患者,可能对患者治疗方式的选择有影响,另外可加强随访力度,如治疗后6月、1年等来评估治疗效果。
4 结论
在AC的诊断中钡餐造影检查阳性率优于胃镜,药物及水囊扩张为多数人选择的治疗方式,但DOEM较前两者更为有效,在以后的工作中,需要大样本,多中心的研究对AC的发病机制、诊治及预后作进一步探讨。
1. 文光旭,马洪升.贲门失弛缓症的治疗现状[J].华西医学,2009,12:3 273-3 275.
2. 王刚,张逊.贲门失弛缓症的治疗现状及进展[J].中国胸心血管外科临床杂志,2014,1:107-111.
3. 张月.49例贲门失弛缓症病例回顾分析[D].大连医科大学,2017.
4. Pandolfino J E,Ghosh S K,Rice J,et al.Classifying esophageal motility by pressure topography characteristics:a study of 400 patients and 75 controls[J].Am J Gastroenterol.2008,103(1):27-37.
5. Tuason J,Inoue H.Current status of achalasia management:a review on diagnosis and treatment[J].J Gastroenterol.2017,52(4):401-406.
6. 李淑香,曲波,李惠.贲门失弛缓症发病机制的研究进展[J].世界华人消化杂志,2015,8:1 252-1 257.
7. Arora Z,Thota PN,Sanaka MR.Achalasia:current therapeutic options[J].Ther Adv Chronic Dis,2017,8(6-7):101-108.
8. Krill JT,Naik R D,Vaezi MF.Clinical management of achalasia:current state of the art[J].Clin Exp Gastroenterol,2016,9:71-82.
9. Reas DL,Zipfel S,Ro O.Is it an eating disorder or achalasia or both?A literature review and diagnostic challenges[J].Eur Eat Disord Rev,2014,22(5):321-330.
10. Francis DL,Katzka DA.Achalasia:update on the disease and its treatment[J].Gastroenterology, 2010, 139(2):369-374.
11. Bredenoord A J,Fox M,Kahrilas P J,et al.Chicago classification criteria of esophageal motility disorders defined in high resolution esophageal pressure topography[J].Neurogastroenterol Motil,2012,24 Suppl 1:57-65.
12. Kessing BF,Bredenoord AJ,Smout AJ.Erroneous diagnosis of gastroesophageal reflux disease in achalasia[J].Clin Gastroenterol Hepatol,2011,9(12):1 020-1 024.
13. Vela MF.Management strategies for achalasia[J].Neurogastroenterol Motil,2014,26(9):1 215-1 221.
14. Vaezi MF,Pandolfino JE,Vela MF.ACG clinical guideline:diagnosis and management of achalasia[J].Am J Gastroenterol,2013,108(8):1 238-1 250.
15. Persson J,Johnsson E,Kostic S,et al.Treatment of achalasia with laparoscopic myotomy or pneumatic dilatation:long-term results of a prospective,randomized study[J].World J Surg,2015,39(3):713-720.
16. Fuchs KH,Schulz T,Varga G,et al.The potential and perspective of peroral endoscopic esophageal myotomy for achalasia[J].World J Surg,2015,39(7):1 598-1 602.
17. Ujiki MB,Yetasook AK,Zapf M,et al.Peroral endoscopic myotomy:Ashort-termcomparisonwiththestandardlaparoscopicapproach[J].Surgery,2013,154(4):893-900.
18. Von Renteln D,Fuchs KH,Fockens P,et al.Peroral endoscopic myotomy for the treatment of achalasia:an international prospective multicenter study[J].Gastroenterology,2013,145(2):309-311.
19. Tuason J,Inoue H.Current status of achalasia management:a review on diagnosis and treatment[J].J Gastroenterol,2017,52(4):401-406.
20. Patel K,Abbassi-Ghadi N,Markar S,et al.Peroral endoscopic myotomy for the treatment of esophageal achalasia:systematic review and pooled analysis[J].Dis Esophagus,2016,29(7):807-819.
21.Youn YH,Minami H,Chiu PW,et al.Peroral endoscopic myotomy for treating achalasia and esophageal motility disorders[J].JNeurogastroenterolMotil,2016,22(1):14-24.

