生物炭对土地整治区土壤微生物调控效应
邓建强,谭军,施河丽,樊俊,向必坤,王瑞
湖北省烟草公司恩施州公司,湖北省恩施市施州大道119号 445000
以乱石缝地整理和小流域治理为主的土地整治措施是解决部分区域的土层薄、水土流失风险高、不易机械化操作的主要途径[1-2],目前国家烟草专卖局已在重庆、贵州、四川、湖北、云南等区域开展了提高烟区生产力、改善烟农生产生活条件的土地整治工作。然而,因工程改造的影响,大量生土带入耕作层,造成了土壤理化性状改变,肥力水平整体下降,该情况在重度整治区表现尤为突出[3-4]。生 物炭被认为是亚马逊盆地几千年沃土的有效成分[5-6],它逐步被研究人员所关注,并在土壤改良方面得到一定范围的应用[7-9]。生物炭可通过自身多孔结构、孔隙内部的水分和营养物质[10],改变土壤微生物栖息环境,调控其群落结构[11-12],提高作物抗病性和产量[13-14]。但也有学者提出因生物炭对土壤养分具有强大的吸附能力,在一些土壤养分贫瘠区域施用,不利于微生物活性的提高[15],虽然在施用初期可提高土壤微生物生物量碳(MBC),但在一段时间后土壤MBC将迅速下降[16],对土壤微生物的调控效果具有可变性。然而,对于土地整治区,特别是重度区域,土壤养分基本处于贫瘠状态,施用生物炭是否能调控微生物群落结构,提高土壤质量,仍有待考量。为此,本研究分析讨论了生物炭对土地整治区土壤微生物性状的影响,旨在为该区域土壤肥力的快速恢复提供科学依据。
1 材料与方法
1.1 研究区概况
试验区位于湖北省恩施市“清江源”现代烟草农业科技园区(26º 45´N,111º 23´E,1015 m),具有典型山地立体气候特征,年均气温16.3°C,年均降水量1434.9 mm[17]。土地整治前土壤类型为山地黄棕壤,整治后耕作层带入生土较多,与非整治区相比土壤有机质低、容重变大,其基础土壤理化性质为:容重1.30 g/cm3,有机质5.75 g/kg,全氮0.87 g/kg,全磷0.87 g/kg,全钾20.46 g/kg,pH 7.50,阳离子交换量(CEC)7.51 cmol/kg。
1.2 供试材料
供试生物炭由某再生能源专业加工厂提供,原料为水稻谷壳,炭化温度为400~500℃。基本化学性质为:全氮2.16 g/kg,全磷6.85 g/kg,全钾7.42 g/kg,pH 7.73, 有 机 碳 543.53 g/kg,CEC 22.50 cmol/kg,灰分27.69 %。
1.3 试验方法
1.3.1 试验设计
试验为大田试验,共5个处理,即生物炭用量分 别 为 CK(0 t/hm2)、7.5 t/hm2、15 t/hm2、30 t/hm2和45 t/hm2,每处理3次重复,小区面积为39.60 m2,随机排列。2014年4月将生物炭均匀施于土壤表面,翻耕混匀至0~30 cm土壤耕作层,后期不再补施生物炭。烟叶种植品种为云烟87,行株距1.2 m×0.5 m,移栽和采收结束时间分别为当年5月1日和9月15日。烟叶移栽前30 d施用997.5 kg/hm2烟草专用复合肥(N:P2O5:K2O为8:12:24)作底肥,移栽后10 d施用150.0 kg/hm2提苗肥(N:P2O5:K2O为13.5:0:45.5),移栽后30 d施用75.0 kg/hm2追肥(N:P2O5:K2O为0:0:50.0)。试验始于2014年4月,止于2015年10月。
1.3.2 测定项目与方法
烟叶生长季每隔15 d,在距离茎部10 cm处取耕作层混合土壤样品进行土壤常规化学指标测定[18]。2015年9月,采用多点取样法,采集烟株间垄体0~20 cm处的土壤,并将10个取样点的土壤混合后作为一个样品,保存于-20 ℃冰箱,待测土壤微生物指标。土壤微生物生物量采用氯仿熏蒸-K2SO4提取[19],土壤MBC和土壤微生物生物量氮(MBN)的测定方法参见相关文献[20]。同时,对土壤样品的细菌16S rDNA和真菌18S rDNA进行高通量测序,随后进行微生物同源鉴定和多样性分析[21]。
1.3.3 烟叶病害调查
在烟叶生长季,每隔30 d按照《GB/T 23222-2008 烟草病虫害分级及调查方法》进行病害调查。
1.4 数据处理
常规统计在Excel 2003和SPSS 16.0进行。多重比较差异性采用新复极差法,显著水平设为P<0.05,极显著水平设为P< 0.01。
2 结果
2.1 土壤MBN、土壤MBC和微生物商分析
根据分析表明,生物炭对土壤MBN和土壤MBC的影响较大(表1)。随着生物炭用量的上升,土壤MBN呈现先提高后降低再提高的趋势。7.5 t/hm2、15 t/hm2、30 t/hm2和45 t/hm2处理的土壤MBN分别比对照提高了61.01 %、112.83 %、19.05 %和117.72 %,且15 t/hm2和45 t/hm2与对照相比达到显著差异。与土壤MBN变化规律基本相反,土壤MBC随生物炭用量的上升呈先增加再降低的趋势,用量为15 t/hm2、30 t/hm2和45 t/hm2的土壤MBC分别较对照显著降低了37.01 %、48.91 %和68.62 %,而7.5 t/hm2的较对照显著增加了36.83 %。从土壤MBC/MBN来看,7.5 t/hm2处理与对照无显著性差异,但当用量≥15 t/hm2时,生物炭显著降低了土壤MBC/MBN 70.05 %左右。生物炭快速提高了土壤有机碳,但对土壤微生物商却有降低作用,与对照相比,除7.5 t/hm2无显著差异外,15 t/hm2、30 t/hm2和45 t/hm2处理的微生物商分别显著降低了70.96 %、81.05 %和91.34 %,这与陶朋闯等[22]的研究结果一致。
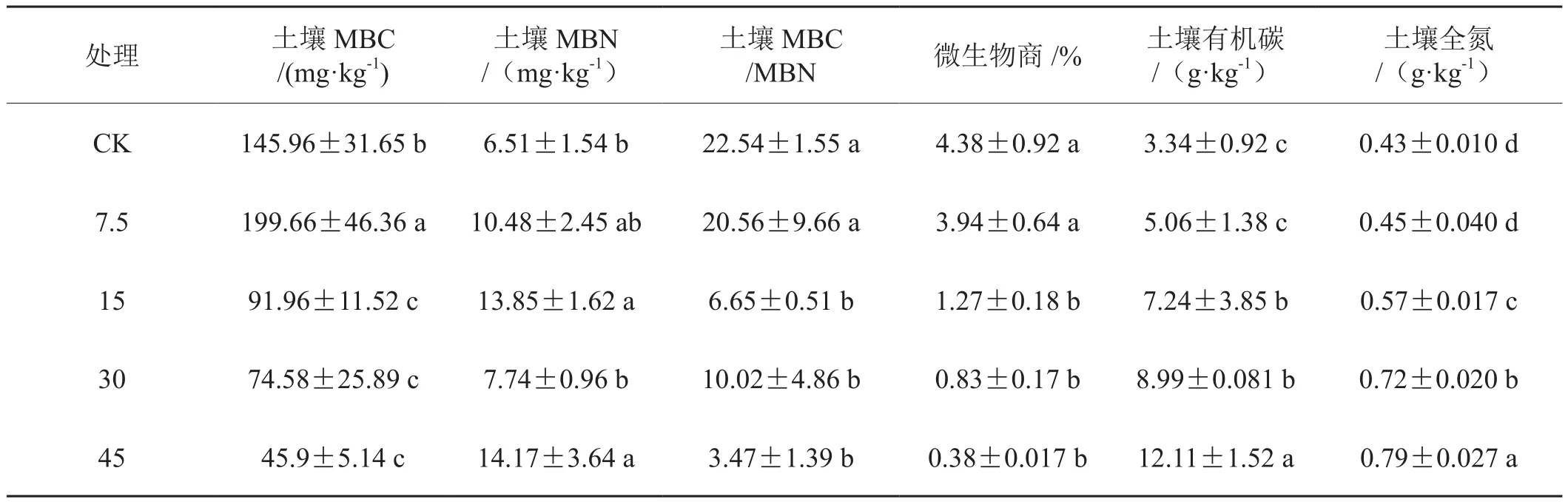
表1 生物炭对土壤微生物生物量碳、氮和土壤有机碳、全氮的影响Tab.1 Effect of biochar on soil microbial biomass carbon , nitrogen and soil organic carbon, and total nitrogen
2.2 土壤微生物多样性分析
根据图1可知,随着生物炭的增加,细菌和真菌的OTUs先增加后降低,细菌和真菌分别在生物炭用量20~30 t/hm2和10~30 t/hm2出现峰值,用量超过30 t/hm2时,土壤微生物种类数逐步降低。由图2可知,生物炭对真菌的Shannon指数影响大于细菌,与对照相比,45 t/hm2处理细菌的Shannon指数降幅仅为3.38 %,而真菌的降幅却达到了23.27 %。

图1 生物炭对OTUs的影响Fig.1 Effect of biochar on OTUs of bacteria and fungi
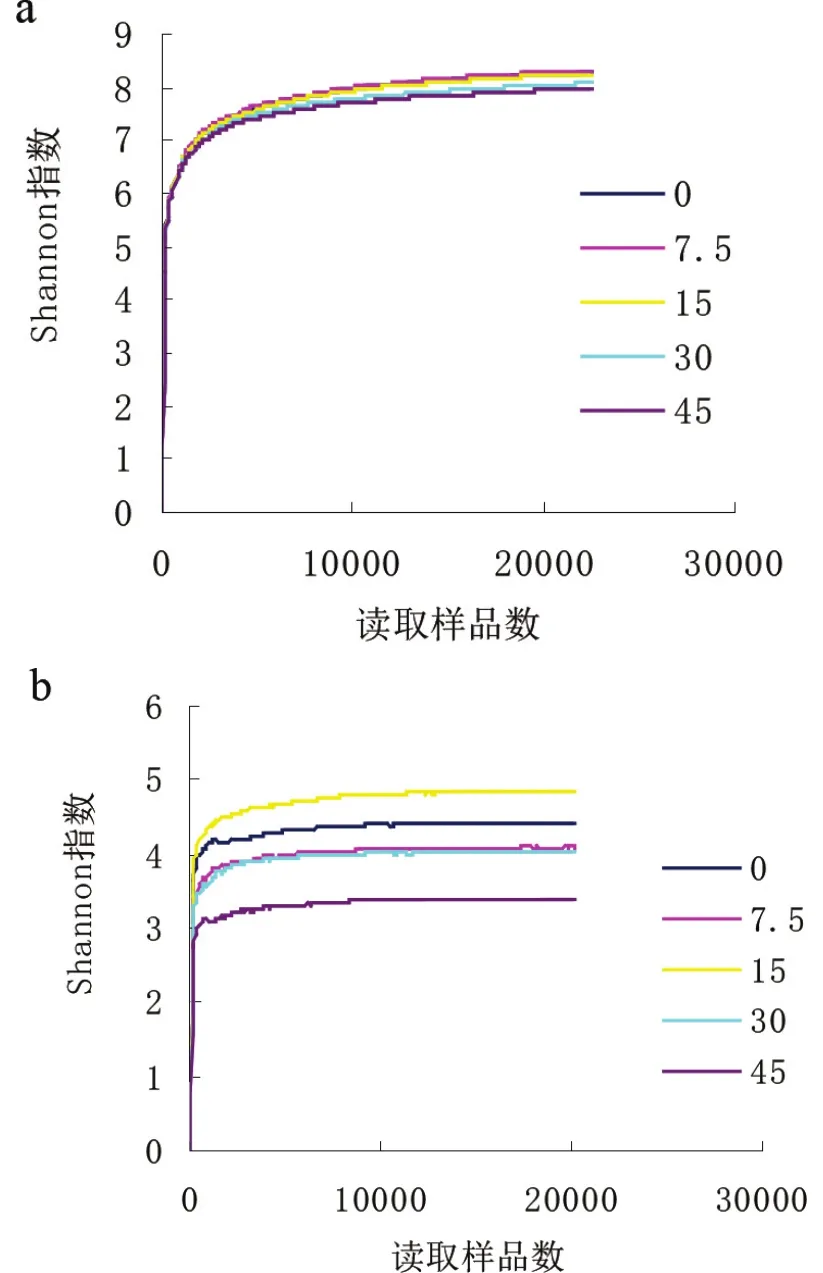
图2 生物炭对细菌(a)和真菌(b)Shannon指数的影响Fig.2 Effect of biochar on Shannon index of bacteria(a)and fungi(b)Shannon index
2.3 土壤细菌、真菌群落结构分析
根据图3可知,变形菌 门(Proteobɑcteriɑ)、放线菌门(Actinobɑcteriɑ)和酸杆菌门(Acidobɑ cteriɑ)为该土壤类型的优势细菌种群。生物炭可迅速降低变形菌门的相对丰度,降幅约为13.08 %。但放线菌门的相对丰度却随生物炭用量的提高快速上升,且达到了显著正相关(图4),与对照相比,7.5 t/hm2、15 t/hm2、30 t/hm2和45 t/hm2处理分别上幅了4.03 %、11.56 %、7.71 %和19.91 %。同时,生物炭用量与劣势种群绿弯菌门(Chloroflexi)和TM7的相对丰度分别达到显著正相关和极显著负相关(图4),说明生物炭不仅对土壤整治区土壤优势种群具有调节作用,对某些劣势种群也产生影响。

图3 生物炭对细菌门水平上的物种相对丰度的影响Fig.3 Effect of biochar on relative abundance of bacterial phyla species
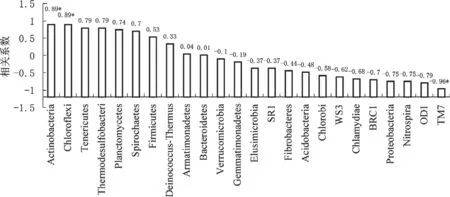
图4 生物炭对细菌门水平上相对丰度的相关分析Fig.4 Correlation analysis between biochar and relative abundance of bacterial phyla species
根据图5可知,除未分类样本外,研究区土壤真菌群落可归属于子囊菌门(Ascomycotɑ)、担子菌门(Bɑsidiomycotɑ)、壶菌门(Chytridiomy cotɑ)和接合菌门(Zygomycotɑ),其中子囊菌门所占比例最高。随着生物炭用量的提高,子囊菌门相对丰度先降低后升高。接合菌门相对丰度除45 t/hm2处理外,均高于对照。其它两个菌门占有比例偏低,其相对丰度随生物炭用量的上升略有先升高后降低的趋势。
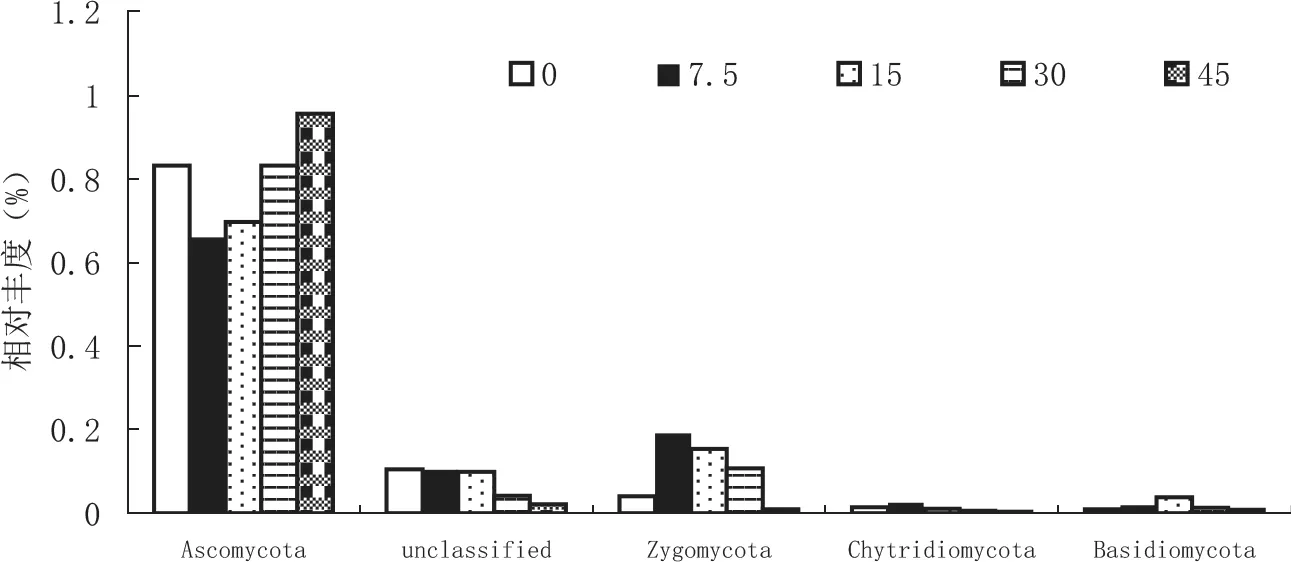
图5 生物炭对 真菌门水平上的物种相对丰度的影响Fig.5 Effect of biochar on relative abundance of eukaryotic phyla species
2.4 土壤功能性菌属分析
从表2可知,生物炭降低了硝化细菌和反硝化细菌相对丰度(平均降幅分别为47.22 %和46.12 %),提高了固氮菌相对丰度(平均升幅17.48 %),说明生物炭可降低土壤的硝化速率和反硝化速率,更有利于土壤微生物固氮。同时,随着生物炭用量的提高,有着抗病虫害功能的芽孢杆菌属(Bacillus)和类芽孢杆菌属(Paenibacillus)的相对丰度具有先下降后上升的趋势,说明在土地整治区施用中低剂量生物炭可降低此类有益微生物比例,但生物炭用量较高时又将促进其繁衍。对于一些植物或人体致病细菌种属来讲,随着生物炭用量的提高,其相对丰度先降低后急速升高,用量15 t/hm2的相对丰度最低,相比对照降低了20.76 %,但当用量提高到45 t/hm2时,升幅却达64.71 %,说明生物炭用量为15 t/hm2时可降低土壤可能致病性菌属的相对丰度,更高剂量可能将增大烟叶生产的感病风险。
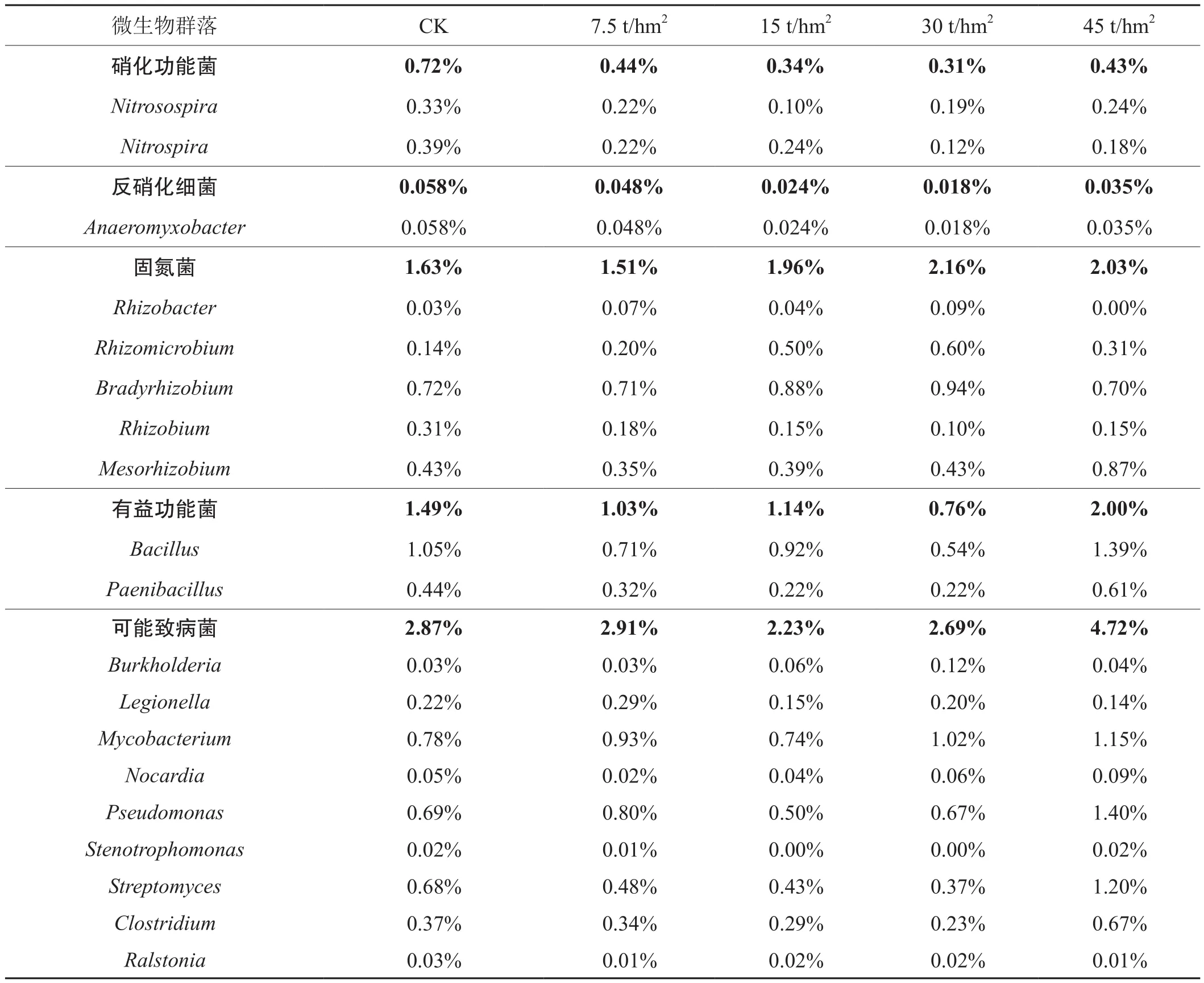
表2 生物炭对功能性菌属相对丰富的影响Tab.2 Effect of biochar on relative abundance of functional bacteria genera
3 讨论
3.1 生物炭对土壤MBN、土壤MBC及土壤氮素供应能力的影响
土壤MBN和土壤MBC是用于评价土壤质量和微生物群落状态变化的重要指标,能较早地反映出生态系统功能的变化趋势[23]。本研究中土壤MBN随着生物炭用量的提高而逐步上升,土壤MBC和土壤MBC/MBN则相反,与相关研究结果基本一致[24]。土壤MBC/MBN下降可能与生物炭有利于微生物群落向高效利用氮的群落结构发展有关[25],使得土壤MBN未随土壤MBC降低反而持续升高。同时,细菌比真菌更容易被生物炭吸附[26],在一定程度上促进了细菌的繁殖,因细菌的碳氮比低于真菌,使得土壤MBC/MBN进一步降低。
同时,土壤MBC/MBN的降低有利于土壤氮素利用率的提高[27],生物炭对土壤MBC/MBN的影响也反馈到土壤氮素供应中。在本研究中,随着生物炭用量的提高,土壤MBC/MBN不断下降,土壤微生物固定了大量氮源,在施用初期对土壤氮素供应有一定降低作用。如图6所示,2014年烟叶生长中期土壤无机态氮供应能力均低于对照,但2015年部分处理已高于对照,说明生物炭可增强土壤微生物的固氮能力,且随着时间的延长,这些微生物固定的氮素可逐步重新释放,进而在某阶段将增强土壤氮素供应,与相关研究结果一致[28-30]。
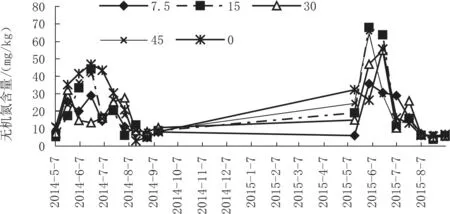
图6 生物炭对土壤无机态氮的影响Fig.6 Effect of biochar on soil inorganic nitrogen
3.2 生物炭对土壤微生物商的影响
随着生物炭用量的提高,土壤微生物商具有下降趋势,可能与生物炭本身属性有关[31]。生物炭中芳香族碳所占比例较大,能够被微生物利用并转化的部分较少,致使微生物商大幅下降。同时,生物炭蜂窝状孔隙结构和高比例的小微孔数量,增大了生物炭的比表面积和物质空间分隔度,增强了对土壤有机质、土壤微生物和土壤酶的吸附量和吸附力,钝化了土壤微生物和土壤酶活性[32],且增大了对微生物、土壤酶与有机质隔离能力,进一步降低了微生物对土壤有机碳的利用。因此,随着生物炭用量的提高,微生物商逐步下降。
3.3 生物炭对土壤微生物群落的影响
生物炭对土地整治区土壤细菌和真菌群落有一定影响,适量生物炭可提高土壤细菌和真菌的生物多样性,用量过多将降低土壤微生物种类。生物炭对细菌变形菌门和放线菌门的相对丰度影响较大,变形菌门相对丰度随着生物炭用量提高迅速降低,而放线菌门则相反,这可能与生物炭促进烟叶根系生长,提高了土壤放线菌门相对丰度,降低了变形菌门比例有关[33]。同时,在本研究中,绿弯菌门的相对丰度和生物炭用量具有显著的正相关,这与生物炭带入较多难降解碳源,绿弯菌可将此类碳源作为代谢底物利用有一定联系[34]。但候选门TM7的相关报道较少,生物炭与TM7相对丰度负相关性的原因,仍有待进一步探讨。
随着生物炭用量的提高,真菌子囊菌门相对丰度先降低后升高,这与子囊菌门具有分解土壤中葡萄糖和纤维素的功能有关。在中低生物炭用量条件下,生物炭的芳香族碳不易作为子囊菌门底物基质,进而降低了此类真菌的相对丰富[35]。但生物炭仍然含有一定量的易分解碳源,随着生物炭用量的持续提高,易分解碳源带入量也随之上升,使得子囊菌门相对丰度在高用量时逐步提高。同时,子囊菌门的链格孢菌被认为是烟草赤星病的主要病原体[36],生物炭施用7.5~15 t/hm2时,子囊菌门相对丰度降低约18%,但当用量达到45 t/hm2时,却提高约15%,暗示适宜生物炭用量具有降低烟草赤星病的潜力,但高剂量施用可能对防治此类病害不利。
3.4 生物炭对土壤功能菌属的影响
本研究结果显示,生物炭降低了硝化细菌和反硝化细菌的相对丰度,提高了固氮菌的相对丰度,暗示生物炭可降低土壤的硝化速率和反硝化速率,有利于土壤微生物固氮[37],即生物炭可能促进土壤微生物的固氮能力。本研究中生物炭用量的增加导致土壤全氮大幅提高,也印证了这一观点。生物炭对烟叶潜在病害的发生也有一定影响,与烟草野火病、细菌角斑病、黑斑病和青枯菌发生密切的假单胞菌属(Pseudomonɑs)、伯克霍尔德菌(Burkholderiɑ)和劳尔氏菌属(Rɑlstoniɑ)[36]的相对丰度之和,随着生物炭用量的提高呈先降低后上升的趋势,与试验田青枯病发病率规律大致吻合(图7),说明适量生物炭具有降低烟草细菌性病害的能力,但高剂量施用可能不利于烟叶生产,将用量控制在15 t/hm2左右为宜。
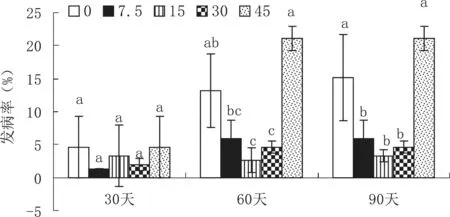
图7 生物炭对青枯病发病率的影响Fig.7 Effect of biochar on bacterial wilt disease incidence
4 结论
生物炭对土地整治区土壤微生物特征具有一定影响,可降低土壤MBC/MBN和微生物商、改变细菌和真菌的群落结构、降低硝化细菌和反硝化细菌相对丰度、提高固氮菌相对丰度、有利于土壤固氮。施用适量生物炭可提高土壤细菌和真菌的生物多样性,降低土壤可能致病性菌属的相对丰度,减少烟草细菌性病害发生率,将用量控制在15 t/hm2左右为宜。
[1]杨庆媛, 张明举, 涂建军, 等. 喀斯 特地貌区土地整治与生态环境建设途径研究——以四川省珙县为例[J]. 西南师范大学学报(自然科学版), 2001, 26(2): 217-221.YANG Qingyuan, ZHANG Mingju, TU Jianjun, et al. A study on the ways of land renovation and ecological environment construction on the karst area —a case study of Gongxian county, Sichuan province[J]. Journal of Southwest China Normal University (Natural Science), 2001, 26(2): 217-221.
[2]王军, 李正, 白中科, 等. 喀斯特地区 土地整理景观生态规划与设计——以贵州荔波土地整理项目为例[J]. 地理科学进展,2011, 30(7): 906-911.WANG Jun, LI Zheng, BAI Zhongke, et al. Landscape ecological planning and design of land consolidation in karst area: a case of land consolidation project in Libo, Guizhou[J]. Progress in Geography, 2011, 30(7): 906-911.
[3]徐大兵, 邓建强, 刘冬碧, 等. 整治区植烟土壤 养分空间变异及肥力适宜性等级评价[J]. 应用生态学报, 2014, 25(3): 790-796.XU Dabing, DENG Jianqiang, LIU Dongbi, et al. Nutrient spatial variability of tobacco soil restoration area and fertility suitability level evaluation[J].Chinese Journal of Applied Ecology, 2014,25(3): 790-796.
[4]蒲元瀛, 张光辉, 仝景川, 等. 恩施州基本烟田 土地整理建设模式研究与实践[J]. 中国烟草科学, 2012, 33(06): 1-6.PU Yuanying, ZHANG Guanghui, TONG Jingchuan, et al. Study and practice of land consolidation for fundamental tobacco fields in Enshi[J]. Chinese Tobacco Science, 2012, 33(6): 1-6.
[5]Glaser B, Balashov E, Haumaier L, et al. Black carbon in density fractions of anthropogenic soils of the Brazilian Amazon region[J].Organic Ge ochemistry, 2000, 31(7): 669-678.
[6]Sombroek W, Ruivo MDL, Fearnside PM, et al. Amazonian Dark Earths as carbon stores and sinks//Amazonian Dark Earths[M].Springer Netherlands, 2003: 125-139.
[7]Wang L, Butterly CR, Wang Y, et al. Effect of crop residue biochar on soil acidity amelioration in strongly acidic tea garden soils[J].Soil Use and Management, 2014, 30(1): 119-128.
[8]Sun J, Wang B, Xu G, et al. Effects of wheat straw biochar on carbon mineralization and guidance for large-scale soil quality impro vement in the coastal wetland[J]. Ecological Engineering,2014, 62(1): 43-47.
[9]Roberts DA, Paul NA, Dworjanyn SA, et al. Biochar from commercially cultivated seaweed for soil amelioration[J]. Scientific Reports, 2015, 5: 9665.
[10]Gheorghe C, Marculescu C, Badea A, et al. Effect of pyrolysis conditons on biochar production from biomass[C]// Proceedings of the 3rd WSEAS international conference on Renewable Energy Sources. Romania, 2009.
[11]Zavalloni C, Alberti G, Biasiol S, et al. Microbial mineralization of biochar and wheat straw mixture in soil: a short-term study[J].Applied Soil Ecology, 2011, 50(1): 45-51.
[12]Dempster DN, Gleeson DB, Solaiman ZM, et al. Decreased soil microbial biomass and nitrogen mineralisation with Eucalyptus biochar addition to a coarse textured soil[J]. Plant and Soil , 2012,354(1-2): 311-324.
[13]Elad Y, David DR, Harel YM, et al. Induction of systemic resistance in plants by biochar, a soil applied carbon sequestering agent[J]. Phytopathology, 2010, 100( 9): 913-921.
[14]Noguera D, Barot S, Laossi KR, et al. Biochar but not earthworms enhances rice growth through increased protein turnover[J]. Soil Biology and Biochemistry, 2012, 52(3): 13-20.
[15]Kuzyakov Y, Subbotina I, Chen H, et al. Black carbon decomposition and incorporation into soil microbial biomass estimated by 14C labeling[J]. Soil Biology and Biochemistry, 2009,41(2): 210-219.
[16]Bhupinder PS, Cowie AL. Long-term influence of biochar on native organic carbon mineralisation in a low-carbon clayey soil[J].Scientific Reports, 2014, 4(3): 3687-3696.
[17]邓建强, 谭毛彦, 杨军, 等. 恩施烟区气候周期性变化的特征分析[J]. 烟草科技, 2011, 290(9): 81-84.DENG Jianqiang, TAN Maoyan, YANG Jun, et al. Characteristics of periodic climate variation in Enshi tobacco growing area [J].Tobacco Science&Technology, 2011, 290(9): 81-84.
[18]鲍士旦. 土壤农化分析(第三版)[M]. 北京: 中国农业出版社,2000.Bao Shidan. The method of analysis for soil agro-chemistry (third edition)[M]. Beijing: China agriculture press, 2000.
[19]Vance ED, Brookes PC, Jenkison DS. An extraction method formeasuring soil microbial biomass C[J]. Soil Biology and Biochemistry, 1987, 19(6): 703-707.
[20]鲁如坤. 土壤农业化学分析法[M]. 北京: 农业科技出版社,2000.LU Rukun. Soil agricultural chemical analysis[M]. Beijing:agricultural science and technology press, 2000.
[21]Hartmann M, Frey B, Mayer J, et al. Distinct soil microbial diversity under long-term organic and conventional farming[J].Isme Journal, 2015, 9(5): 1177-1194.
[22]陶朋闯, 陈效民, 靳泽文, 等. 生物质炭长期施用对旱地红壤微生物特性及理化性质的影响[J]. 土壤通报, 2017, 48(06): 1423-1428.TAO Pengchuang, CHEN Xiaomin, JIN Zewen, et al. Longterm Effects of Biochar Application on Microbial Properties and Physicochemical Properties in Upland Red Soil, China [J].Chinese Journal of Soil Science, 2017, 48(6): 1423-1428.
[23]He ZL, Yang XE, Baligar VC, et al. Microbiological and biochemical indexing systems for assessing quality of acid soils[J].Advances in Agronomy, 2003, 78(2): 89-138.
[24]陶朋闯, 陈效民, 靳泽文, 等. 生物质炭与氮肥配施对旱地红壤微生物量碳、氮和碳氮比的影响[J]. 水土保持学报, 2016,30(1): 231-235.TAO Pengchuang, CHEN Xiaomin, JIN Zewen, et al. Effects of biochar combined with nitrogen fertilizers on microbial biomass C,N and carbon-to-nitrogen ratio of upland red soil[J]. Journal of Soil and Water Conservation, 2016, 30(1): 231-235.
[25]胡亚林, 汪思龙, 颜绍馗. 影响土壤微生物活性与群落结构因素研究进展[J]. 土壤通报, 2006, 37(1): 170-176.HU Yalin, WANG Silong, YAN Shaokui. Research advances on the fac tors influencing the activity and community structure of soil microorganism[J]. Chinese Journal of Soil Science, 2006, 37(1):170-176.
[26]Pietikainen J, Kiikkila O, Fritze H. Charcoal as a habitat for microbes and its effect on the microbial community of the underlying humus[J]. Oikos, 2000, 89(2): 231-242.
[27]吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006.WU Jinshui, LIN Qimei, HUANG Qiaoyun, et al. Determination of soil microbial biomass and its application[M]. Beijing:meteorological press, 2006.
[28]Biederman LA, Harpole WS. Biochar and its effects on plant productivity and nutrient cycling: a meta-analysis[J]. Global Change Biology Bioenergy, 2013, 5(2):202-214.
[29]Bai SH, Reverchon F, Xu CY, et al. Wood biochar increases nitrogen retention in field settings mainly through abiotic processes[J]. Soil Biology and Biochemistry, 2015, 90:232-240.
[30]Bai SH, Xu CY, Xu Z, et al. Soil and foliar nutrient and nitrogen isotope composition (δ15N) at 5 years after poultry litter and green waste biochar amendment in a macadamia orchard[J]. Environmental Science and Pollution Research, 2015, 22(5): 3803-3809.
[31]马莉, 吕宁, 冶军, 等. 生物碳对灰漠土有机碳及其组分的影响[J]. 中国生态农业学报, 2012, 20(8): 976-981.MA Li, LV Ning, YE Jun, et al. Effects of biochar on organic carbon content and fractions of gray desert soil[J]. Chinese Journal of Eco-Agriculture, 2012, 20(8): 976-981.
[32]Zimmerman AR, Gao B, Ahn MY. Positive and negative carbon mineralization priming effects among a variety of biochar-amended soils[J]. Soil Biology and Biochemistry, 2011, 43(6): 1169-1179.
[33]殷全玉. 延边烟区土壤微生态与烤烟质量关系研究[D]. 郑州大学, 2013.YIN Quanyu. Research on the relationship between the soil microecological environment and flue-cured tobacco quality in Yanbian tobacco region[D]. Zhengzhou university, 2013.
[34]Fierer N, Bradford MA, Jackson RB. Toward an ecological classification of soil bacteria[J]. Ecology, 2007, 88(6): 1354-1364.
[35]Thies J, Rillig M. Characteristics of biochar: Biological properties,in: Lehmann, J., Joseph, S., (Eds.), Biochar for Environmental Management: Science and Technology[M]. London: Earthscan,2009:89.
[36]邱强. 作物病虫害诊断与防治彩色图谱[M]. 北京:中国农业科学技术出版社, 2013.QIU Qiang. Color atlas of the diagnosis and control of crop pests and diseases[M]. Beijing: China agricultural science and technology press, 2013.
[37]陈俊辉. 田间试验下秸秆生物质炭对农田土壤微生物群落多样性的影响[D]. 南京农业大学, 2013.CHEN Junhui. Effects of straw biochar on soil microbial community diversity from croplands under field experiment[D].Nanjing agricultural university, 2013.

