琼脂糖自组装膜基底型免疫芯片载体制备及抗体固定研究①
马莉萍 马生龙 李云霞 聂莹莹 韩根亮
(甘肃省科学院传感技术研究所,甘肃省传感器与传感技术重点实验室,兰州 730000)
免疫芯片,又称为抗体微阵列,是实际应用中最重要、研究最多的一种蛋白质芯片。免疫芯片技术结合了抗原抗体反应的特异性和芯片高密度集成优势,只需少量生物样品,一次检测便可获得几种甚至几万种有关的生物信息或疾病的检测结果。与传统的免疫分析方法相比,免疫芯片最大的优点是能够实现并行、快速、高通量的检测;同时极大节省时间、试剂,被广泛应用于蛋白质组学研究,其在疾病诊断、药物筛选、食品安全和环境监测等领域已显示出广阔的应用前景。免疫芯片制备中,载体的表面修饰及抗体固定是影响芯片检测灵敏度的关键因素。目前,免疫芯片载体表面修饰可大致分为两类:二维表面修饰和三维表面修饰。二维表面修饰包括聚赖氨酸修饰[1]、氨基修饰[2,3]、醛基修饰[4,5]、巯基修饰[6]、链霉亲合素修饰[7,8]等,它们是通过共价键或特殊分子间的高亲合力把蛋白质固定在载体表面,所以对蛋白质的固定比较牢固,蛋白质的构象变化较少,有利于保持蛋白质的天然活性。但是二维表面修饰技术制备的载体在发展过程中仍存在不少问题,如:引起抗体蛋白质性质不稳定的问题,动力学检测范围窄等问题[9,10]。
三维表面修饰是在玻片表面包被一层凝胶或树突状多聚物,这些凝胶或多聚物又可以通过化学反应引入活性基团,以共价结合和物理吸附的方式把蛋白固定在载体表面。已有大量研究证明,这种三维结构的载体对蛋白质的固定量比二维平面载体大得多,而且凝胶的固-液环境使固定在上面的蛋白质不易失去活性[11-13]。所以三维修饰表面是近年来较受关注的修饰方法。研究表明,多糖膜具有三维多孔结构,经水化后可在内部形成固-液状态的水凝胶结构,这种三维、多孔结构以及湿润的微环境不但能固定足够的蛋白质,同时还可以防止蛋白质变性失活[14]。
本文在总结前人对免疫芯片载体表面修饰及探针固定技术的研究基础上,选择多糖中水溶性的琼脂糖为基质,利用分子自组装技术,在玻片表面制成具有三维结构的自组装多糖纳米膜,其经高碘酸钠氧化,制备出表面带醛基的免疫芯片载体。从而建立了多糖纳米膜基底型芯片载体制备的新方法,为后续免疫芯片的制备和应用提供实验参考和理论支持。
1 材料与方法
1.1材料 琼脂糖、3-氨基丙基三甲氧基硅烷(APTES)(Sigma公司,美国),高碘酸钠、戊二醛、36%冰乙酸、无水乙醇等均为分析纯(国药集团化学试剂有限公司);FITC标记的驴抗兔抗体(上海生工),FITC标记的兔抗人AFP抗体(上海生工)。
超纯水机、电子天平、磁力搅拌器、烘干箱,JSM-6360LV型高低真空扫描电镜,FTS3000FX 型的傅立叶变换红外光谱仪,OLYMPUS BX51型倒置荧光显微镜,Nanoscope IIIa型原子力显微镜。
1.2方法
1.2.1基片的预处理 25 mm×75 mm 光学载玻片用氨水洗液(体积比为氨水∶过氧化氢∶水=1∶1∶5)置摇床上振摇2 h,取出后用超纯水清洗干净,放入1 mol/L HCl中浸泡过夜,再用超纯水超声10 min,无水乙醇超声清洗2次,每次5 min,置电热恒温箱(120℃)烘烤2 h。
1.2.2琼脂糖自组装膜载体制备 ①分别配制0.6%、0.8%、1.0%、1.2%、1.4%的琼脂糖溶液,微波炉煮沸3 min完全溶解;②将2 ml琼脂糖溶液覆盖在60℃预热的清洁玻片上;琼脂糖室温凝固后,置37℃烤箱烘干2 h;置室温保存备用;③将上述制备好的琼脂糖玻片置于50 mmol/L NaIO4溶液中室温下活化60 min。接着用0.1 mol/L pH7.4 PBS洗涤5 min×3次,氮气流吹干。
1.2.3普通醛基载体制备 按照文献中的方法制备普通醛基载体[15]。清洗好的玻片浸入APTES活化试剂(丙酮稀释)中20 min后取出,玻片用丙酮、去离子水冲洗,120℃下烘干,然后放入含5%戊二醛溶液中室温下浸泡2 h,取出用去离子水冲洗5 min×3次,烘干后,至干燥处保存。
1.2.4基片表面抗体探针的固定 探针为FITC标记的驴抗兔IgG和兔抗人AFP抗体,将探针固定至修饰后的载体表面,研究载体对不同蛋白探针的固定效率。
取原始浓度为1 mg/ml的探针溶于含20%甘油的PBS溶液中稀释,使探针终浓度分别为0.1、0.2、0.3、0.4、0.5、0.6 mg/ml,将探针分子分别链接到修饰后基片上,避光,置于湿盒中,37℃固定3 h,然后PBS清洗3次,洗掉未结合的荧光探针,晾干后荧光显微镜检测,获取荧光图像。
1.2.5不同基片对抗体分子固定效率的比较 利用最佳条件分别制备普通醛基化载体,琼脂糖自组装膜载体,分别固定最佳浓度的抗体探针分子,根据平均荧光强度比较两种载体对抗体的固定效果。
1.2.6表征 载体表面的形貌用JSM-6360LV型高低真空扫描电镜(SEM)与原子力显微镜(AFM)观察;在IR Prestige-21型傅里叶变换红外光谱仪上测定红外光谱(FTIR),用来分析载体表面存在的化学键;用OLYMPUS BX51型倒置荧光显微镜观察载体表面荧光探针的固定效率。
1.3统计学方法 平均荧光强度使用Image J软件分析,图片选取的分析面积为100 μm×100 μm,同一基片选择10个区域并取其平均值,实验数据分析采用SPSS11.0软件进行单因素方差分析(One-Way ANOVA),以P<0.05为差异具有统计学意义。
2 结果
2.1载体的表面形貌
2.1.1SEM表征 本文采用扫描电镜来观察活化后基片表面形貌及琼脂糖自组装膜的分布情况。图1是载体表面放大5 000倍的SEM照片,从照片中可以明显地看到,表面形成了均匀的薄膜结构,琼脂糖自组装膜结构紧密、无空隙出现,玻片全部被薄膜均匀包覆。
2.1.2AFM表征 利用原子力显微镜对琼脂糖自组装膜修饰载体进行表征(图2),修饰后的玻片表面具有三维结构,可观察到高度约为400~600 nm 的锥形颗粒均匀分布于基片之上,呈现密集的凸起,使表面具有一定的粗糙度,这种结构可增大比表面积、提高探针固定率。
2.2载体的表面化学组成 利用红外光谱分析修饰载体的化学键组成,图3为琼脂糖自组装膜修饰载体和修饰载体固定了抗体后的红外谱图,由图可见,二者整体吸收峰位置并无大的改变,两种载体在3 435 cm-1同时出现峰,为羟基伸缩振动峰。二者在1 714 cm-1处也同时出现一个峰,为羰基伸缩振动峰。与未固定抗体的载体(图3A)相比,固定了抗体的载体在1 647 cm-1处出现一个尖峰(图3B),为C=N 双键特征吸收峰[16],这是由于载体表面高碘酸钠氧化琼脂糖后生成的醛基与蛋白探针上的氨基发生了希夫碱反应后生成的键,证明载体表面与抗体产生了交联反应,表明该修饰载体成功实现了对蛋白探针分子的有效固定。s

图1 琼脂糖自组装膜修饰载体的SEM照片Fig.1 SEM images of carrier modified by agarose self-assembled membrane

图2 琼脂糖自组装膜修饰载体AFM照片Fig.2 AFM micrograph of carrier modified by agarose self-assembled membrane
2.3不同浓度琼脂糖制备载体对抗体的固定效果 探针为FITC标记的驴抗兔IgG和FITC标记的兔抗人AFP抗体,将探针固定至修饰后的载体表面,研究载体对不同蛋白探针的固定效率。
分别利用质量分数为0.6%、0.8%、1.0%、1.2%、1.4%的琼脂糖溶液制备修饰载体,不同浓度琼脂糖制备的氧化自组装膜载体对抗体的固定效果见图4,在低浓度时,随着琼脂糖浓度的增加,载体对抗体分子的固定量随之增加,但当琼脂糖浓度大于1.0%时,荧光强度下降,因此,琼脂糖的最佳浓度是1.0%,以此作为后续实验的浓度工作。
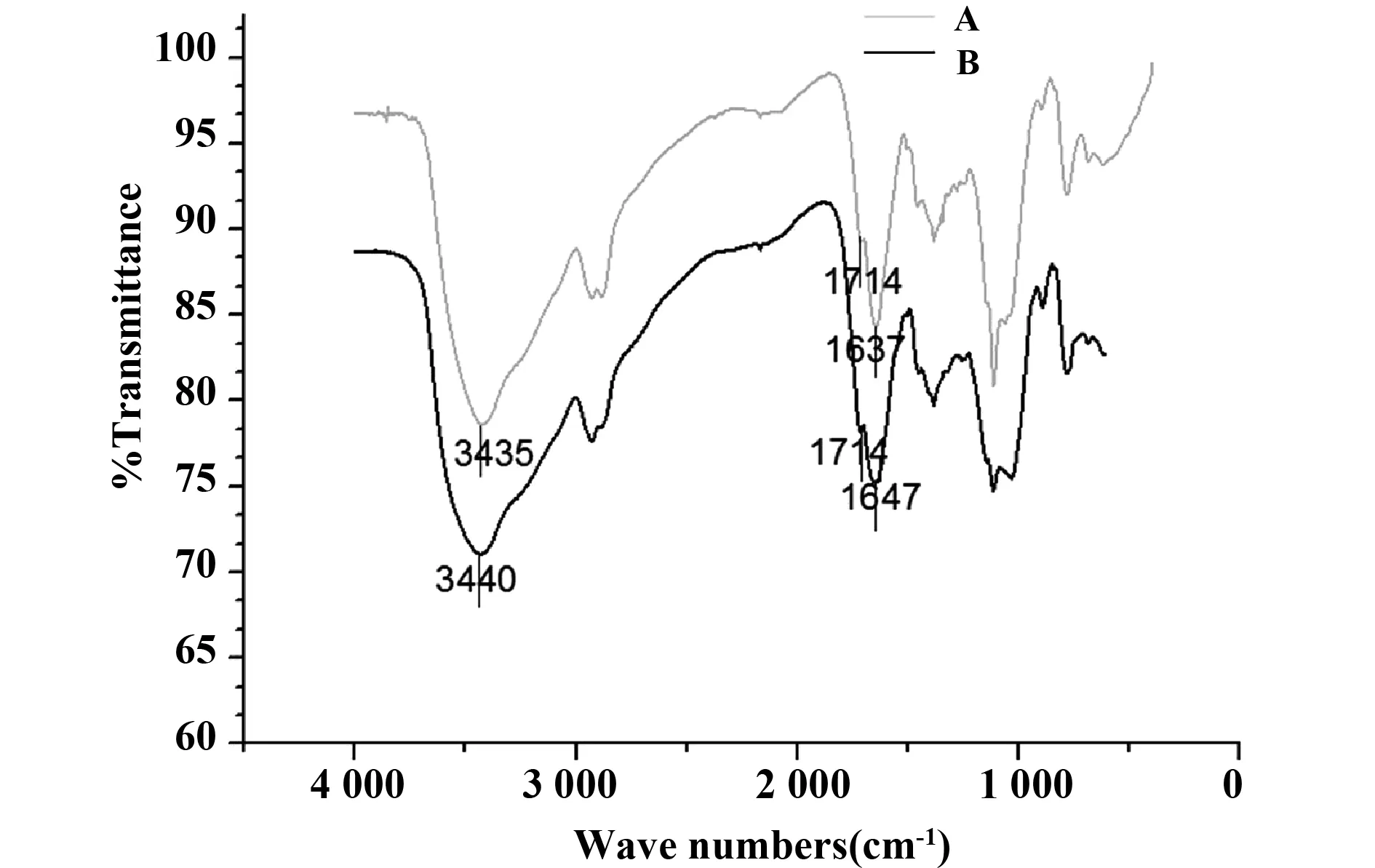
图3 琼脂糖自组装膜修饰载体红外光谱图Fig.3 FTIR spectrogram of the carrier modified by agarose self-assembled membraneNote: A.FTIR spectrogram of agarose self-assembled membrane;B.FTIR micrograph of agarose self-assembled membrane immobilized by antibody.

图4 不同浓度琼脂糖制备载体对抗体的固定效果Fig.4 Effect of agarose concentration on immobilization efficiency of IgG

图5 IgG 浓度-荧光强度曲线Fig.5 Curve of IgG concentrations versus fluoresc-ence intensityNote: A.The curve of donkey anti-rabbit IgG concentrations versus fluorescence intensity;B.The curve of rabbit anti-human AFP IgG concentrations versus fluorescence intensity.

图6 不同修饰载体的荧光照片Fig.6 Fluoroscope images of different modified carrierNote: A.Fluoroscope image of the ordinary aldehyde carrier;B.Fluoros-cope image of agarose self-assembled membrane carrier.
2.4载体对不同种属来源IgG的固定效率 在载体上固定的抗体探针(IgG)越多,所获取的荧光信号强度越高[17]。本文选择FITC标记的驴抗兔抗体和FITC标记的兔抗人AFP抗体为探针,研究琼脂糖自组装膜修饰载体对不同抗体的固定效率。将浓度为0.1、0.2、0.3、0.4、0.5、0.6 mg/ml的探针分子分别固定到琼脂糖自组装膜修饰载体上,载体对两种抗体的固定效果见图5,图5A为载体对不同浓度FITC标记的驴抗兔抗体的固定效率研究,由图可见,在一定范围内随着IgG浓度的增加,荧光信号强度增大,在IgG浓度为0.4 mg/ml时荧光强度达到最大,而后随着浓度的增加,荧光信号强度反而减弱。图5B为载体对不同浓度FITC标记的兔抗人AFP抗体的固定效率研究,载体对该抗体的最佳固定效率为0.3~0.4 mg/ml,而后随着抗体浓度的增加,荧光信号强度有减弱趋势。表明琼脂糖自组装膜修饰载体可实现对不同种属来源抗体的有效固定。
2.5不同修饰载体的探针固载效果分析 将浓度为0.4 mg/ml的FITC标记的驴抗兔抗体分别固定在普通醛基化及琼脂糖自组装膜表面,不同基片对探针分子的固载效果通过荧光显微镜图片 (图6)加以分析。图6A为普通醛基化载体,图6B为琼脂糖自组装膜载体,从图中可以看出,普通醛基化载体表面有大量FITC探针结合,琼脂糖自组装膜修饰载体比普通醛基化载体更强、更密、更均匀。通过Image J软件统计分析,两种修饰基片对抗体固定效率见表1,琼脂糖自组装膜修饰载体对抗体的固定效率是普通醛基化基片的3.94倍。
表1采用ImageJ软件对上述2种载体的荧光亮点数量进行统计分析
Tab.1StatisticalanalysisoffluorescentspotamountformedonthetwodifferentcarrierusingImageJsoftware

Carrier typeMean numberof fluorescent dotsOrdinary aldehyde-aldehyde carrier375Agarose nano-membrane carrier1 478
3 讨论
在免疫芯片的制备过程中,基片的表面化学处理极为重要,它直接影响探针与基片的结合强度与效率,进而影响杂交结果的灵敏度与准确性。探索优良的基片载体制备方法,提高探针分子的固定密度与强度,仍然是研究的重点。
本文以玻片为载体,以琼脂糖为基质,利用分子自组装技术,在玻片表面制成自组装琼脂糖纳米膜,其经高碘酸钠氧化为醛基,得到琼脂糖自组装膜修饰基片。由于琼脂糖是一种拥有多种生物活性的高聚物,有着很好的生物相容性,其在载玻片表面形成的自组装结构具有类似于聚丙烯酰胺的水凝胶特征,这三维自组装结构又可以通过化学反应引入醛基基团,即可与抗体分子的氨基发生共价偶联。具有这种三维结构的载体对蛋白质的固定量比二维平面载体大得多,而且凝胶的固-液湿润环境使固定在上面的蛋白质不易失去活性,因此更有利于固定抗体探针分子。本文的研究也表明:壳聚糖氧化自组装膜修饰玻片与抗体结合效率高,荧光信号强,点的密度及数量等都要优于普通醛基化玻片。
琼脂糖是一种多糖,加热后易溶于水,不同浓度的琼脂糖在玻片上形成的膜的厚度和孔径大小也有差异,膜的厚度和孔径的大小会直接影响蛋白质的固定。琼脂糖浓度低时膜较薄,对蛋白质的固定量少;随着琼脂糖浓度的增加,膜的厚度也增加,但制备的膜容易断裂,对蛋白质的固定量也少。本实验中我们选择了0.6%、0.8%、1.0%、1.2%及1.4%等琼脂糖浓度,SEM及荧光表征结果都证明琼脂糖最佳浓度为1.0%,此浓度下制备的琼脂糖膜较为平整、均匀,载体对蛋白质的固定量最大。
本文的研究表明琼脂糖修饰载体可实现对不同种属来源抗体的有效固定,并且其对抗体的固定量是有限的,在一定范围内对抗体固定的量和抗体样品的浓度呈正比,当这一浓度达到极限时,蛋白质的固定量就不再增加。分析其原因可能为:其一,空间位阻,蛋白质浓度过高,使得蛋白质的结合位点被封阻,其二,荧光分子浓度过高,发生淬灭。
免疫芯片的制备和应用过程中,载体的选择以及载体表面修饰是制备质量好、结合力高的芯片的重要环节。本试验以琼脂糖为基质材料,建立了一种新的免疫芯片载体制备方法。以此法制备的载体具有操作简单、低成本的优点,将更有利于在其表面连接抗体分子,为后续免疫芯片的制备和应用提供实验参考和理论支持。
参考文献:
[1] Afanassiev V,Hanemann V,Wolfl S.Preparation of DNA and protein micro arrays on glass slides coated with an agarose film [J].Nucl Acids Res,2000,28(12):e66.
[2] Sjöberg R,Mattsson C,Andersson E,etal.Exploration of high-density protein microarrays for antibody validation and autoimmunity profiling [J].New Biotechnol,2016,33(5):582-592.
[3] Lashkari DA,DeRisi JL,McCusker JH.Yeast microarrays for genome wide parallel genetic and gene expression analysis [J].Proc Natl Acad Sci U S A,1997,94(24):13057-13062.
[4] Zhao X,Nampalli S,Serino AJ.Immobilization of oligodeoxyribonucleotides with multiple anchors to microchips [J].Nucleic Acids Res,2001,29(4):955-959.
[5] Bordoni R,Consolandi C,Castiglioni B.Investigation of the multiple anchors approach in oligonucleotide microarray preparation using linear and stem-loop structured probes [J].Nucleic Acids Res,2002,30(8):e34.
[6] Tähkä SM,Bonabi A,Nordberg ME,etal.Thiol-ene microfluidic devices for microchip electrophoresis:Effects of curing conditions and monomer composition on surface properties [J].J Chromatography A,2015,1426:233-240.
[7] Klimushina MV,Gumanova NG,Metelskaya VA.Direct labeling of serum proteins by fluorescent dye for antibody microarray [J].Biochem Biophy Res Commun,2017,486(3):824-826.
[8] Chang SY,Bong JH,Yoo G,etal.Activity control of autodisplayed proteins on the same outer membrane layer of E.coli by using Z-domain/streptavidin/and lipase/foldase systems [J].Enzyme Microbial Technology,2017,96:85-95.
[9] Sobek J,Bartscherer K,Jacob A,etal.Microarray technology as a universal tool for high-throughput analysis of biological systems [J].Comb Chem High Throughput Screen,2006,9(5):365-380.
[10] Hu Y,Uttamchandani M,Yao SQ.Microarray:a versatile platform for high-throughput functional proteomics [J].Comb Chem High Throughput Screen,2006,9(3):203-212.
[11] Charles PT,Goldnan ER,Rangasammy JG,etal.Fabrication and Characterization of 3D hydrogel microarrays to measure antigenicity and antibody functionality for biosensor applications [J].Biosens Bioelectron,2004,20(4):753-764.
[12] Arenkov P,Kukhtin A,Gemmdll A,etal.Protein microchips:use for immunoassay and enzymatic reactions [J].Anal Biochem,2000,278(2):123-131.
[13] Kiyonaka S,Sada K,yoshimural,etal.Semi-wet peptide/protein array using supramolecular hydrogel [J].Nat Mater,2004,3(1):58-64.
[14] 梅 茜,张春秀,唐祖明,等.蛋白质芯片研究进展[J].中国医药科大学学报,2001,32(5):329-332.
Mei Q,Zhang CX,Tang ZM,etal.Progress in protein microarray and its application[J].J China Pharm Univ,2001,32(5):329-332.
[15] Dawson ED,Reppert AE,Rowlen KL,etal.Spotting optimization for oligo microarrays on aldehyde-glass [J].Analytical Biochemistry,2005,34(2):352-360.
[16] 孟令芝,何永炳.有机波谱分析[M].武汉:武汉大学出版社,1997:31.
Meng LZ,He YB.Organic spectral analysis[M].Wuhan:Wuhan University press,1997:31.
[17] 费 嘉,马文丽,吴清华,等.介质表面修饰对蛋白质芯片固定率和反应性的影响[J].生命科学研究,2005,9(4):34l-345.
Fei J,Ma WL,Wu QH,etal.Comparison of two different surface modifications for the preparation of protein microarray[J].Life Sci Res,2005,9(4):341-345.

