JAK2-STAT3/STAT5 信号通路与儿童食物过敏CD4+T淋巴细胞亚群变化的相关性研究①
曾晓燕 胡 波 李传应 陈必全
(安徽医科大学第一附属医院儿科,合肥 230001)
儿童食物过敏又称小儿消化系统变态反应、食物变态反应或过敏性胃肠炎,即因为食品或其添加剂诱发的IgE或非IgE免疫反应,从而导致小儿消化系统甚至全身变态反应发生,出现腹痛、患儿烦躁不安、甚至肠道出血等严重现象[1,2]。根据临床流行病学统计,小儿食物过敏的临床发病率高达8%,牛奶是导致其发病的最重要因素,且由于现代儿童喂养和饮食特点的改变,其临床发病率有进一步升高趋势[3]。因此,针对儿童食物过敏的发生和治疗的研究具有重要意义和价值。CD4+T细胞作为机体最重要的免疫细胞之一,可分化为多种亚型,参与包括免疫监视、排斥、杀伤等重要过程。而JAK2-STAT3/STAT5信号通路参与多种细胞生长调控及免疫反应发生。故本研究将首先观察比较儿童食物过敏患儿和正常儿童外周血CD4+T淋巴细胞亚群的百分比变化,进一步针对JAK2-STAT3/STAT5信号通路进行分析,探讨二者是否与过敏存在相关性及潜在调控作用,现报道如下。
1 资料与方法
1.1临床资料 根据如下纳入标准和排除标准收集2015年1月至2017年3月来我院就诊的儿童食物过敏患儿78例,为过敏组;同期收集来我院体检的健康儿童78例,为对照组。过敏组:男42例,女36例,并根据年龄分组,A组≤1岁(27例),B组1~3岁(不包括1岁,22例),C组3~6岁(不包括3岁,14例),D组6~11岁(不包括6岁,15例),体重5.65~32.71 kg,平均体重(13.7±4.9)kg。对照组:男41例,女37例,A组≤1岁(25例),B组1~3岁(不包括1岁,22例),C组3~6岁(不包括3岁,14例),D组6~11岁(不包括6岁,17例),体重5.69~32.75 kg,平均体重(13.9±4.6)kg。两组患儿年龄、性别、体重均无统计学差异。
纳入标准:①患儿均为牛奶所致过敏性小肠结肠炎,表现为皮肤、黏膜充血水肿,恶心、呕吐、间歇性腹泻等典型过敏表现,并经血生化检验,血清特异性IgE检测确诊IgE所致小儿食物过敏;②患儿和正常儿童及家属均签署知情同意协议,愿意配合研究。
排除标准:①患儿存在其他过敏性疾病,如过敏性紫癜、哮喘或血液系统疾病,可影响CD4+T淋巴细胞亚群的检测;②患儿存在慢性炎症疾病、先天性疾病或其他疾病可影响JAK2-STAT3/STAT5信号通路的表达和活化;③患儿基础条件较差,难以配合治疗研究。
1.2方法 抽取两组儿童外周静脉血10 ml,分装2管,各5 ml,分别用肝素和肝素锂抗凝。
肝素锂抗凝血用于流式细胞仪检测,取1.5 ml肝素锂抗凝血,常规分离获得单核细胞并重悬,调整细胞悬液浓度至106ml-1,分别加入CD3-ECD、CD4-PE、CD8-perCP、CD24-FITC并留置对照管,加入同型IgG-FITC,同时给予细胞内染色,加入抗IFN-γ、IL-4、IL-17等特异性抗体,随后经流式细胞仪检测各组患儿外周血CD分子和细胞因子是否表达,及具体百分比。其中CD4+IFN-γ+代表Th1细胞、CD4+IL-4+代表Th2细胞、CD4+CD25+代表Treg细胞、 IL-17+代表Th17细胞。
肝素抗凝血用于qPCR检测JAK2-STAT3/STAT5 mRNA表达水平,首先离心分离外周血单核细胞,采用Trizol(Life technology,USA)提取细胞总RNA,采用反转录试剂盒(TaKaRa,Japan)构建cDNA,并经SYBR GreenⅡ(TaKaRa,Japan)行定量PCR,检测JAK2、STAT3、STAT5的表达水平。引物序列如下:JAK2:F:5′-TCTGGGGAGTATGT-TGCAGAA-3′;R:5′-AGACATGGTTGGGTGGATACC-3′;STAT3:F:5′-CAGCAGCTTGACACACGGTA-3′;R:5′-AAACACCAAAGTGGCATGTGA-3′;STAT5:F:5′-GCAGAGTCCGTGACAGAGG-3′;R:5′-CCACAGGT-AGGGACAGAGTCT-3′。
分析两组儿童上述CD4+T淋巴细胞亚群和JAK2、STAT3、STAT5表达水平的差异,采用Pearson相关性分析分析JAK2-STAT3/STAT5 信号通路和CD4+T淋巴细胞亚群的相关性。
1.3统计学处理 所有统计学分析均采用SPSS22.0软件。本研究计数资料采用卡方检验,计量资料采用t检验,两计量资料间相关性比较采用Pearson相关性分析,计算相关性系数r,若r>0,则两组间呈正相关性,反之负相关,且P<0.05,差异存在统计学意义。
2 结果
2.1CD4+T淋巴细胞亚群比较 根据表1可知,对照组A组、B组、C组儿童Th1、Treg淋巴细胞百分比及Th1/Th2、Treg/Th17比值均明显高于过敏组患儿A组、B组、C组,而Th2、Th17淋巴细胞百分比均小于过敏组所对应的同年龄段患儿,随儿童年龄增大,两组间差异均明显减小,但差异均有统计学意义(P<0.05)。对照组D组儿童和过敏组D组儿童上述指标差异均无统计学意义(P>0.05)。
2.2JAK2、STAT3、STAT5 的mRNA表达水平比较 根据表2可知,对照组JAK2、STAT3、STAT5的mRNA表达水平均明显低于过敏组,差异有统计学意义(P<0.05)。
2.3JAK2-STAT3/STAT5和CD4+T淋巴细胞亚群的相关性比较 由表3~6可知,针对JAK2和CD4+T淋巴细胞亚群水平进行相关性比较,A、B、C三组Th1、Treg、Th1/Th2、Treg/Th17的相关性系数均<0(P<0.05),而Th2、Th17的相关性系数均>0(P<0.05)。针对STAT3和CD4+T淋巴细胞亚群水平进行相关性比较,Th1、Treg、Th1/Th2、Treg/Th17的相关性系数均<0(P<0.05),而Th2、Th17的相关性系数均>0(P<0.05)。针对STAT5和CD4+T淋巴细胞亚群水平进行相关性比较,Th1、Treg、Th1/Th2、Treg/Th17的相关性系数均<0(P<0.05),而Th2、Th17的相关性系数均>0(P<0.05)。且上述三组的相关系数绝对值逐次减小,提示随患儿年龄增大,相关性逐渐减弱,同时,针对D组进行相关性分析,上述信号通路分子与CD4+T淋巴细胞亚群水平均无明显相关性。
表1两组儿童CD4+T淋巴细胞亚群比较
Tab.1ComparisonofCD4+Tlymphocytesubsetsintwogroups

GroupsControl group A(n=25)Allergic group A(n=27)Control group B(n=22)Allergic group B(n=20)Control group C(n=14)Allergic group C(n=16)Control group D(n=17)Allergic group D(n=15)Th1(%)15.42±3.519.03±2.171)15.49±3.2913.56±2.221)15.97±3.2810.23±2.571)16.59±3.2713.21±3.05Th2(%)0.73±0.161.22±0.241)0.77±0.121.12±0.231)0.75±0.150.93±0.211)0.79±0.120.98±0.25Th17(%)0.28±0.110.69±0.211)0.29±0.150.59±0.221)0.26±0.120.48±0.201)0.28±0.130.43±0.21Treg(%)10.87±2.937.21±1.861)10.99±2.947.98±1.821)10.98±2.958.36±1.821)10.05±2.569.23±1.93Th1/Th221.38±2.778.19±2.351)21.38±2.7710.12±2.631)21.56±2.7113.23±2.551)21.59±2.9618.26±2.66Treg/Th1738.68±3.1720.17±2.911)38.97±3.2623.19±2.921)38.98±3.1229.47±3.021)38.12±3.1935.19±2.52
Note:Compared with control group,1)P<0.05.
表2两组儿童JAK2、STAT3、STAT5的mRNA表达水平比较
Tab.2ComparisonofmRNAexpressionlevelsofJAK2,STAT3andSTAT5intwogroups
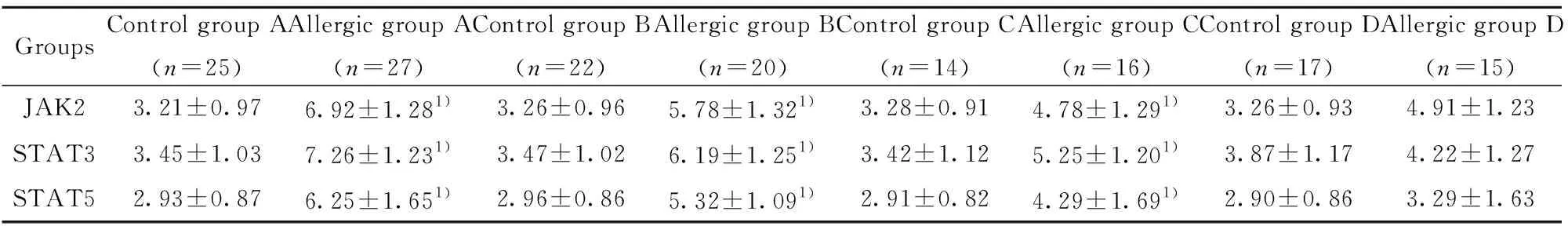
GroupsControl group A(n=25)Allergic group A(n=27)Control group B(n=22)Allergic group B(n=20)Control group C(n=14)Allergic group C(n=16)Control group D(n=17)Allergic group D(n=15)JAK23.21±0.976.92±1.281)3.26±0.965.78±1.321)3.28±0.914.78±1.291)3.26±0.934.91±1.23STAT33.45±1.037.26±1.231)3.47±1.026.19±1.251)3.42±1.125.25±1.201)3.87±1.174.22±1.27STAT52.93±0.876.25±1.651)2.96±0.865.32±1.091)2.91±0.824.29±1.691)2.90±0.863.29±1.63
Note:Compared with control group,1)P<0.05.
表3A组JAK2-STAT3/STAT5和CD4+T淋巴细胞亚群的相关性比较
Tab.3ComparisonofcorrelationbetweenJAK2-STAT3/STAT5andCD4+TlymphocytesubsetsingroupA

GroupsJAK2rPSTAT3rPSTAT5rPTh1(%)-0.923P<0.05-0.916P<0.05-0.812P<0.05Th2(%)0.918P<0.050.926P<0.050.895P<0.05Th17(%)0.865P<0.050.829P<0.050.917P<0.05Treg(%)-0.816P<0.05-0.178P<0.05-0.838P<0.05Th1/Th2-0.956P<0.05-0.931P<0.05-0.836P<0.05Treg/Th17-0.927P<0.05-0.928P<0.05-0.817P<0.05
表4B组JAK2-STAT3/STAT5和CD4+T淋巴细胞亚群的相关性比较
Tab.4ComparisonofcorrelationbetweenJAK2-STAT3/STAT5andCD4+TlymphocytesubsetsingroupB
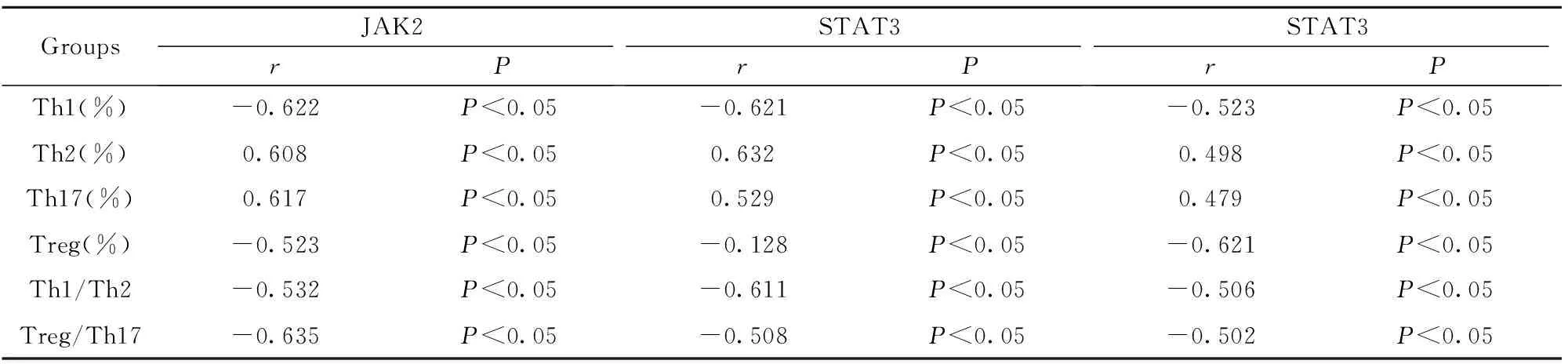
GroupsJAK2rPSTAT3rPSTAT3rPTh1(%)-0.622P<0.05-0.621P<0.05-0.523P<0.05Th2(%)0.608P<0.050.632P<0.050.498P<0.05Th17(%)0.617P<0.050.529P<0.050.479P<0.05Treg(%)-0.523P<0.05-0.128P<0.05-0.621P<0.05Th1/Th2-0.532P<0.05-0.611P<0.05-0.506P<0.05Treg/Th17-0.635P<0.05-0.508P<0.05-0.502P<0.05
表5C组JAK2-STAT3/STAT5和CD4+T淋巴细胞亚群的相关性比较
Tab.5ComparisonofcorrelationbetweenJAK2-STAT3/STAT5andCD4+TlymphocytesubsetsingroupC
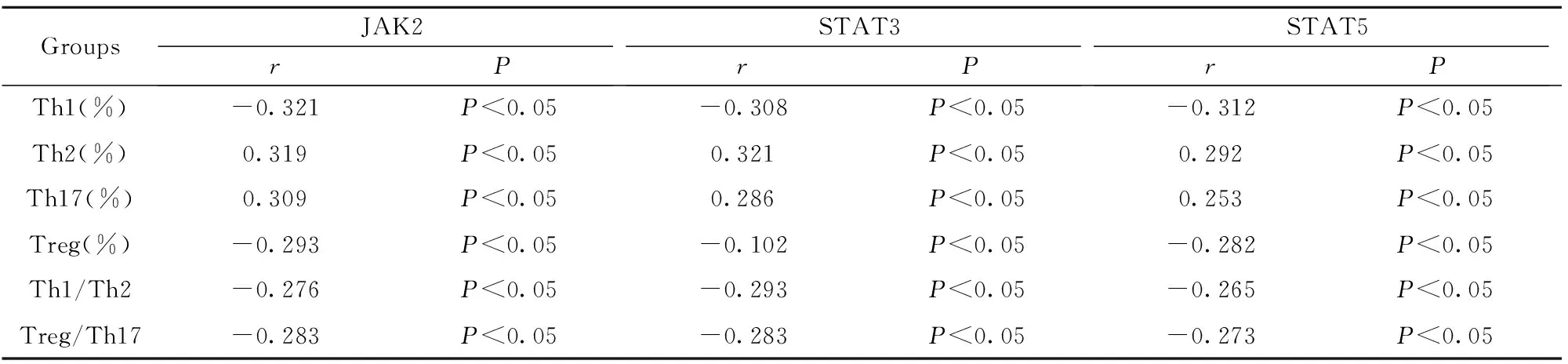
GroupsJAK2rPSTAT3rPSTAT5rPTh1(%)-0.321P<0.05-0.308P<0.05-0.312P<0.05Th2(%)0.319P<0.050.321P<0.050.292P<0.05Th17(%)0.309P<0.050.286P<0.050.253P<0.05Treg(%)-0.293P<0.05-0.102P<0.05-0.282P<0.05Th1/Th2-0.276P<0.05-0.293P<0.05-0.265P<0.05Treg/Th17-0.283P<0.05-0.283P<0.05-0.273P<0.05
表6D组JAK2-STAT3/STAT5和CD4+T淋巴细胞亚群的相关性比较
Tab.6ComparisonofcorrelationbetweenJAK2-STAT3/STAT5andCD4+TlymphocytesubsetsingroupD
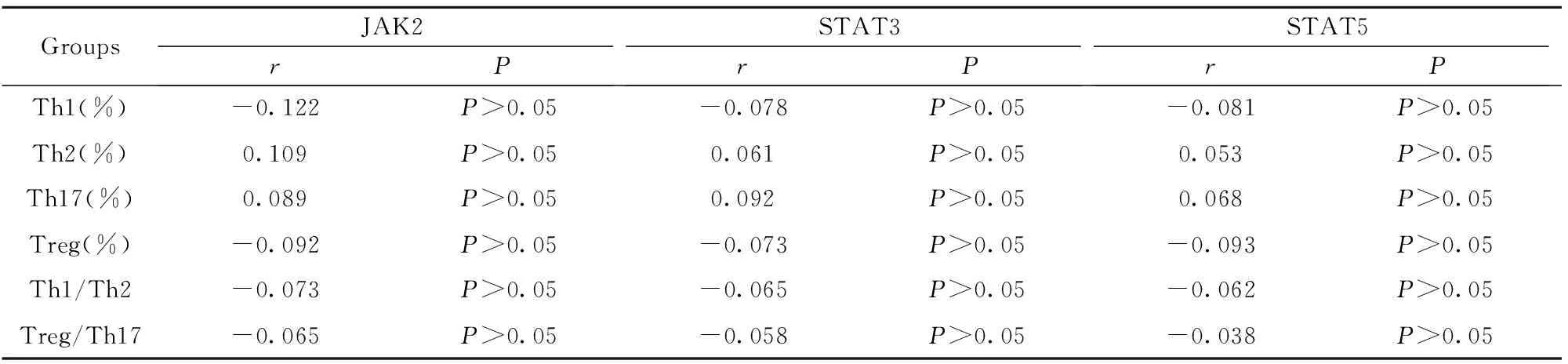
GroupsJAK2rPSTAT3rPSTAT5rPTh1(%)-0.122P>0.05-0.078P>0.05-0.081P>0.05Th2(%)0.109P>0.050.061P>0.050.053P>0.05Th17(%)0.089P>0.050.092P>0.050.068P>0.05Treg(%)-0.092P>0.05-0.073P>0.05-0.093P>0.05Th1/Th2-0.073P>0.05-0.065P>0.05-0.062P>0.05Treg/Th17-0.065P>0.05-0.058P>0.05-0.038P>0.05
3 讨论
近年来,随着儿童医疗水平的发展,各大器质性儿童疾病的临床治疗均取得了极大的进步[4]。但小儿过敏性疾病却日渐成为目前困扰儿童健康安全的常见疾病,如儿童过敏性哮喘、紫癜以及食物过敏等[5]。由于小儿基础条件较差,免疫功能发育不完善,小儿主要食物牛奶、鸡蛋、大豆等极易成为变态反应原,导致食物过敏现象的发生,不仅影响患儿的健康生活质量,甚至可对生命安全产生威胁[6]。
CD4+T淋巴细胞经刺激后可分化为Th1、Th2、Th17、Treg等亚群,其中Th1型可参与细胞免疫和IFN-γ的分泌,而Th2型主要参与体液免疫和IL-4的分泌[7]。在儿童各大过敏性反应中,Th2型CD4+T淋巴细胞的大量分化和IL-4的分泌可诱发并加重机体过敏反应[8]。此外,由于Th1/Th2型存在相互调控作用,在过敏性患儿体内,Th2的分化和IL-4的大量合成、分泌可抑制CD4+T淋巴细胞的Th1极化[9]。
Treg是最具代表性的具有抑制作用的免疫调节细胞,可广泛在机体内抑制自身免疫反应,诱导免疫耐受,儿童食物过敏患儿Treg的水平明显下调,从而导致免疫抑制失效,诱发和加重过敏现象[10]。此外,Th17作为新型的CD4+T淋巴细胞亚群,以IL-17的分泌为主要特征,较传统的Th1和Th2型,Th17在不同疾病的发生、发展中存在多种调控作用[11]。在多种过敏性疾病中,血清IL17的表达明显升高,且CD4+T淋巴细胞可表现为Th17的极化[12]。
JAK-STAT信号通路是近年来发现的一条新型信号通路,其信号通路虽然较为简单,但可参与细胞因子刺激的信号转导通路和细胞增殖、分化、侵袭、凋亡、免疫调控等多种重要的生物功能[13]。JAK2属于非受体酪氨酸激酶,而STAT3和STAT5均属于JAK2的底物,JAK2经受体结合活化后可磷酸化STAT3和STAT5,发挥信号调控作用,进而发挥免疫调控作用,调节CD4+T细胞亚群的分布[14,15]。
由于儿童年龄跨度较大,婴幼儿免疫力低下,随着患儿年龄的增长,其免疫系统日趋成熟和完善,故本研究针对患儿进一步采用年龄分组观察,发现对照组A组、B组、C组儿童Th1、Treg淋巴细胞百分比及Th1/Th2、Treg/Th17比值均明显高于过敏组患儿A组、B组、C组,而Th2、Th17淋巴细胞百分比均小于过敏组所对应的同年龄段患儿,随儿童年龄增大,两组间差异均明显减小。并针对患儿JAK2、STAT3、STAT5和CD4+T淋巴细胞亚群水平进行相关性比较,Th1、Treg、Th1/Th2、Treg/Th17的相关性系数均<0(P<0.05),而Th2、Th17的相关性系数均>0(P<0.05),且相关系数绝对值随患儿年龄增大明显减小。同时,对照组D组儿童和过敏组D组儿童上述指标差异均无统计学意义,信号通路分子与CD4+T淋巴细胞亚群水平在D组亦无明显相关性。证实低龄食物过敏儿童的JAK2-STAT3/STAT5信号通路存在明显活化和CD4+T淋巴细胞亚群改变现象,且JAK2-STAT3/STAT5信号通路可有效调控CD4+T淋巴细胞亚群的分布,但伴随患儿年龄增大和免疫力的成熟,上述差异和相关性均明显减弱,直至消失。
参考文献:
[1] Kim JS,Fengxiu O,Pongracic JA,etal.Dissociation between the prevalence of atopy and allergic disease in rural China among children and adults[J].J Allergy Clin Immunol,2008,122(5):929-935.
[2] 范长红,仰曙芬.维生素D与儿童食物过敏的研究进展[J].中国儿童保健杂志,2017,25(6):576-578.
Fan CH,Yang SF.Research progress on vitamin D and food allergy in children[J].Chin J Child Health Care,2017,25(6): 576-578.
[3] Zeng GQ,Luo JY,Huang HM,etal.Food allergy and related risk factors in 2540 preschool children: an epidemiological survey in Guangdong Province,southern China[J].World J Pediatr,2015,11(3):219-225.
[4] 苗 青,许 巍,皇惠杰,等.支气管哮喘并发过敏性鼻炎患儿外周血Th17细胞及其相关细胞因子表达[J].中华临床免疫和变态反应杂志,2016,10(4):313-319.
Miao Q,Xu W,Huang HJ,etal.Expression of Th17 cells and related cytokines in children with bronchial asthma complicated with allergic rhinitis[J].Chin J Clin Immunol Allergy,2016,10(4):313- 319.
[5] 李敏敏.儿童过敏性紫癜肾损害相关危险因素分析[J].中国地方病防治杂志,2016,31(9):1054.
Li MM.Analysis of risk factors related to renal damage in henoch-schonlein purpura in children[J].Chin J Control Endemic Dis,2016,31(9):1054.
[6] Wong GWK,Li J,Ma Y,etal.Comparative study of food allergy in urban and rural schoolchildren: the europrevall-INCO survey in China[J].J Allergy Clin Immunol,2011,127(2):AB34-AB34.
[7] Martino DJ,Bosco A,McKenna KL,etal.T-cell activation genes differentially expressed at birth in CD4+T-cells from children who develop IgE food allergy[J].Allergy,2012,67(2):191-200.
[8] Fu L,Peng J,Zhao S,etal.Lactic acid bacteria-specific induction of CD4+Foxp3+T cells ameliorates shrimp tropomyosin-induced allergic response in mice via suppression of mTOR signaling[J].Scientific Rep,2017,7(13):1265-1271.
[9] 李传应,秦 臻,王 震,等.游离氨基酸对牛奶蛋白过敏患儿CD4+T细胞功能影响[J].安徽医科大学学报,2017(10):1298-1302.
Li CY,Qin Z,Wang Z,etal.Effects of free amino acids on CD4+T cell function in children with milk protein allergy[J].J Anhui Med Univ,2017(10):1298-1302.
[10] Nagata Y,Yamamoto T,Hayashi M,etal.Improvement of therapeutic efficacy of oral immunotherapy in combination with regulatory T cell-inducer kakkonto in a murine food allergy model:[J].PLoS One,2017,12(1):1705-1713.
[11] Boyle RJ,Umasunthar T,Smith JG,etal.A brief psychological intervention for mothers of children with food allergy can change risk perception and reduce anxiety:outcomes of a randomised controlled trial[J].Clin Exp Allergy,2017,19(12):1932-1937.
[12] Kyburz A,Urban S,Altobelli A,etal.Helicobacter pylori and its secreted immunomodulator VacA protect against anaphylaxis in experimental models of food allergy[J].Clin Exp Allergy,2017,15(6):1219-1226.
[13] 廖亚彬,赵 波,崔晶晶,等.过敏性紫癜急性期患儿T淋巴细胞亚群变化情况及临床意义[J].临床研究,2017,25(3):97-98.
Liao YB,Zhao B,Cui JJ,etal.Changes and clinical significance of T lymphocyte subsets in children with acute anaphylactoid purpura[J].Clin Res,2017,25(3): 97-98.
[14] Muraro A,Jr RFL,Castells M,etal.Precision medicine in allergic disease-food allergy,drug allergy,and anaphylaxis-PRACTALL document of the European academy of allergy and clinical immunology and the american academy of allergy,asthma and immunology[J].Allergy,2017,72(7):1347-1355.
[15] 王 烨,梁庆红,张 莹,等.CD4+T淋巴细胞亚群在儿童过敏性紫癜病理机制中的调控作用[J].中华实用儿科临床杂志,2015,30(21):1614-1618.
Wang M,Liang Qh,Zhang Y,etal.The role of CD4+T lymphocyte subsets in the pathogenesis of childhood allergic purpura[J].Chin J Applied Pediatrics,2015,30(21):1614-1618.

