涂膜处理对灵武长枣低温贮藏期间抗氧化酶和PPO活性的影响
任玉锋,李壮桃,张冠楠
(北方民族大学生物科学与工程学院,宁夏银川 750021)
灵武长枣(Zizphusjujubamillcv.lingwuchangzao)为宁夏具有地方特色的优良鲜食枣品种,栽培历史源远流长[1]。其果实色艳个大、质地酥脆、酸甜适口。灵武长枣与其他多种优良品种的鲜食枣相似,由于果肉质地致密,含水量低,呼吸代谢旺盛等物理与生理特征,采后极易失水皱缩、软化、褐变和腐烂,使得灵武长枣的风味品质及营养品质遭到严重破坏,严重制约了灵武长枣产业的发展。目前,有关灵武长枣的研究主要集中在种质资源和品种选育[2-4]、栽培技术[5]、病虫害防治[6-7]、贮藏保鲜[8-9]、加工、化学成分提取、产业化发展[10-11]等方面,对灵武长枣果实抗氧化作用的研究仅有灵武长枣果实多糖抗氧化作用的研究[12-13],果实活性物质抗氧化作用研究较少,涂膜处理对低温贮藏期间抗氧化酶活性的影响研究鲜见报道。
涂抹处理是近几十年开发的一种有效果品保鲜方式,壳聚糖、海藻酸钠、普兰多糖是较常用的涂膜保鲜剂。涂膜处理能够延缓多种水果的后熟进程,达到较好的保鲜效果。研究表明,壳聚糖、海藻酸钠涂膜可以减少灵武长枣果实水分的散失,保持较高的果实硬度和Vc含量,同时减少了可溶性固形物和可滴定酸的消耗,从而延缓了灵武长枣的后熟进程[8-9]。普鲁兰多糖膜抑制过氧化酶POD活性,保持果肉颜色;壳聚糖维持CAT和SOD这2种抗氧化酶活性的较高水平,阻抑果实内、外气体交换,起到良好的保护作用。但采后涂膜处理对灵武长枣低温贮藏期间抗氧化酶活性的研究鲜见报道。笔者以灵武长枣为试材,探讨不同涂膜处理对灵武长枣在低温贮藏期间抗氧化酶活性的影响,以期为灵武长枣果实的采后贮藏保鲜及进一步开发利用提供理论依据。
1 材料与方法
1.1试验材料于9月下旬从宁夏回族自治区灵武市灵武采收灵武长枣半红果实(着色面达50%左右),挑选大小均一,无病、虫、伤的果实运回北方民族大学植物生理学实验室。
1.2试验方法
1.2.1涂膜处理。先将灵武长枣放置在1%氯化钙溶液中浸泡10 min,然后分成4等份,其中3份分别放置在1%的壳聚糖溶液、海藻酸钠溶液以及普鲁兰多糖溶液中浸泡10 min,另外一份做对照,果实贮藏在0~4 ℃冰箱中。每处理重复3次,贮藏期间每隔7 d取样测定果实指标,共取样8次。
1.2.2取样方法。用不锈钢刀片将灵武长枣的果肉与果皮分离,在研钵中将其磨碎,加入液氮使其速冻,放入-80 ℃超低温冰箱中贮藏备用。
1.3测定项目与方法酶液提取:参考李合生[14]的方法。称取2 g果肉加入50 mmol/L磷酸缓冲液(pH 7.8),在冰浴上研磨成匀浆后定容至8 mL,12 000 r/min 4 ℃离心20 min,取上清液用于酶活性测定。
超氧化物歧化酶(SOD):参照吉宏武[15]的方法并稍做修改;过氧化氢酶(CAT):参考Greenfield等[16]的方法并稍做修改。过氧化物酶(POD):参详高俊凤[17]的方法并稍做修改。多酚氧化酶(PPO):参考曹建康[18]的方法并略做修改。
1.4数据分析采用Excel进行数据处理,SPSS 17.0软件进行差异性结果分析。
2 结果与分析
2.1涂膜处理对灵武长枣低温贮藏期间SOD活性的影响由图1可知,在整个贮藏期间,灵武长枣果实中SOD活性总体呈下降趋势。对照组的SOD活性,由贮藏开始的1.28 U/gFW下降至贮藏末期(49 d)的0.29 U/gFW。与对照相比,海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理SOD活性的下降速度较为缓慢。海藻酸钠和壳聚糖涂膜处理的下降速度最缓慢,普鲁兰多糖涂膜处理次之,与对照组相比达极显著差异(P<0.01)。但海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理之间未达显著差异(P>0.05)。
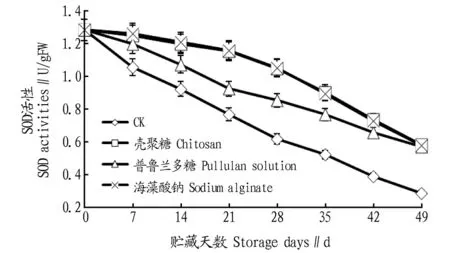
图1 涂膜处理对灵武长枣低温贮藏期间SOD活性的影响Fig.1 Effect of coating treatment on SOD activity of Zizphus jujubamill cv.lingwuchangzao during low temperature storage
2.2涂膜处理对灵武长枣低温贮藏期间CAT活性的影响由图2可知,在整个低温贮藏期间,灵武长枣CAT活性总体呈下降趋势。与对照组相比,海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理CAT活性下降速度较为缓慢。壳聚糖涂膜处理的下降速度最慢,海藻酸钠和普鲁兰多糖涂膜处理次之,与对照组相比达极显著差异(P<0.01);但海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理之间未达显著差异(P>0.05)。海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理均能有效地维持CAT较高的活性。

图2 涂膜处理对灵武长枣低温贮藏期间CAT活性的影响Fig.2 Effect of coating treatment on CAT activity of Zizphus jujubamill cv.lingwuchangzao during low temperature storage
2.3涂膜处理对灵武长枣低温贮藏期间POD活性的影响由图3可知,在整个低温贮藏期间,各处理灵武长枣POD活性总体呈下降趋势。贮藏开始,海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理的灵武长枣POD活性呈快速下降趋势;贮藏0~7 d时,对照组的POD活性呈上升趋势。与对照组相比,海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理POD活性维持在较低水平,与对照组相比达极显著差异(P<0.01),海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理之间未达显著差异(P>0.05)。在贮藏末期,涂膜处理组与对照组的POD活性均维持在最低水平。总体而言,海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理抑制了POD活性,壳聚糖涂膜处理的效果最好。
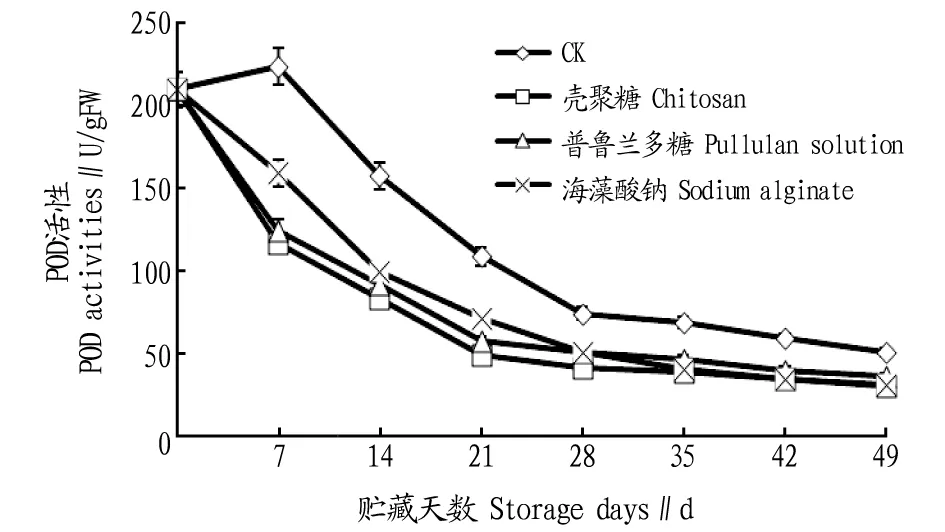
图3 涂膜处理对灵武长枣低温贮藏期间POD活性的影响Fig.3 Effect of coating treatment on POD activity of Zizphus jujubamill cv.lingwuchangzao during low temperature storage
2.4涂膜处理对灵武长枣低温贮藏期间PPO活性的影响由图4可知,在低温贮藏期间,其对照组的PPO活性呈先上升后下降的趋势,且PPO活性在贮藏14 d时达到第1个高峰,随后不断下降。而贮藏35~42 d时,普鲁兰多糖涂膜处理的灵武长枣PPO活性呈小幅缓慢上升趋势。海藻酸钠和普鲁兰多糖涂膜处理在贮藏后期开始缓慢上升并达到一个小高峰,壳聚糖涂膜处理一直处于较低水平,未出现高峰。

图4 涂膜处理对灵武长枣低温贮藏期间PPO活性的影响Fig.4 Effect of coating treatment on PPO activity during low temperature storage of Zizphus jujubamill cv.lingwuchangzao
海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理均能显著抑制灵武长枣PPO的活性,推迟PPO活性高峰期的出现,壳聚糖涂膜处理抑制PPO活性效果最为明显。涂膜处理组的PPO活性与对照组均达极显著差异(P<0.01),但海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理之间并未达显著差异(P>0.05)。
3 结论与讨论
SOD、POD、CAT等作为重要的保护酶,对维持植物体内
活性氧平衡、保持果蔬的最佳贮藏品质以及商品品质具有重要意义。SOD通过清除果蔬细胞内的超氧阴离子,保护果蔬组织细胞,进而延缓果蔬的衰老进程;CAT通过分解果蔬组织细胞中的H2O2,防止H2O2产生的羟基自由基与植物有机体的结合,避免对果蔬组织细胞造成一定的危害,进而对果蔬组织实施保护作用;POD通过清除脂质过氧化物,防止细胞膜的破坏,维持果蔬细胞膜的完整性,进而延缓果蔬的成熟衰老。PPO对酚类物质的代谢起到至关重要的作用,在果蔬贮藏中,PPO活性越高,酚类物质的降解越快,果蔬整体的抗氧化水平就越低。
该研究结果表明,在整个贮藏过程中,灵武长枣果实CAT、SOD、POD和PPO活性变化总体呈不同程度的下降趋势。与对照组相比,海藻酸钠、壳聚糖和普鲁兰多糖涂膜处理延缓了SOD和CAT活性的下降速度,加速了POD、PPO活性的下降速度,说明3种涂膜处理较好地维持了抗氧化酶活性。3种涂膜处理始终将POD和PPO活性维持在较低水平,尤其是在贮藏前期,空白对照组的PPO活性达到高峰,而3种涂膜处理组的PPO活性在较低水平,显著抑制了贮藏同期的酚类及总酚含量下降。这与前人利用涂膜处理维持果蔬的抗氧化能力研究结果一致。
[1] 喻菊芳,朱连成,魏卫东,等.宁夏(灵武)长枣考证[J].宁夏农林科技,2004(5):31-32.
[2] 吴龙军,赵世华.优良鲜食枣品种——灵武长枣[J].西北园艺,2002(3):38.
[3] 朱连成,陈卫军,魏卫东,等.枣中熟品种灵武长枣[J].中国果树,2002(2):53-54.
[4] 喻菊芳,魏天军,陈卫军,等.灵武长枣种质资源调查和品种选优研究[J].中国果树,2008(1):56-57,75.
[5] 李占文,李攀,郭迎华,等.宁夏灵武市毛乌素沙地南缘灵武长枣高效节水综合应用模式研究[J].黑龙江农业科学,2013(4):60-64.
[6] 任玉锋,马爱瑛,刘雅琴,等.灵武长枣采后主要病原真菌的鉴定[J].食品研究与开发,2012,33(9):128-130.
[7] 于洁,孙耀武,张爱萍.灵武长枣褐斑病及防控技术[J].山西果树,2013(2):27-28.
[8] 任玉锋,曾晓静,王春明.壳聚糖涂膜对灵武长枣低温保鲜效果的影响[J].安徽农学通报,2009,15(11):66-68.
[9] 任玉锋,马玉贤.海藻酸钠涂膜对灵武长枣低温保鲜效果的影响[J].安徽农业科学,2009,37(15):7175-7176,7213.
[10] 张晓波,苏伟东,章英才.灵武长枣研究进展[J].北方园艺,2014(22):200-203.
[11] 何世雄,付晓,苏淑霞.对设施灵武长枣产业发展的思考[J].宁夏农林科技,2012,53(4):31-32.
[12] 姜晓燕,胡云峰,崔翰元.酶法提取灵武长枣多糖及抗氧化作用的研究[J].食品工业,2009(6):31-33.
[13] 姜晓燕.灵武长枣中活性物质及总抗氧化能力的研究[D].天津:天津科技大学,2009.
[14] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:164-169.
[15] 吉宏武,何国祥,李剑昆,等.湛江海域14种主要海藻SOD含量与活力测定[J].食品研究与开发,2006,27(9):102-106.
[16] GREENFIELD R E,PRICE V E.Liver catalase.I.A manometric determination of catalase activity[J].The journal of biological chemistry,1954,209(1):355-361.
[17] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:159-160.
[18] 曹建康.果蔬采后生理生化实验指导[M].北京:中国轻工业出版社,2007.

