人参皂苷Re、Rg2对α-葡萄糖苷酶的活性抑制
毕云枫,李娜,姜珊,王溪竹,郑明珠,刘景圣
(吉林农业大学食品科学与工程学院,吉林长春130118)
糖尿病患者除了血糖水平增高外,蛋白质、脂肪和碳水化合物的代谢紊乱等并发症是这种慢性疾病最常见的综合征[1]。目前,糖尿病也是人类最重要的健康问题之一[2]。降低餐后高血糖症的最受欢迎的治疗方法之一是抑制α-糖苷酶,这是糖代谢和消化的重要原因[3]。由肠溶消化酶(α-糖苷酶)消化的复合多糖以葡萄糖的形式降解[4]。人体吸收后,这些葡萄糖会渗入血液,致使餐后高血糖。因此,通过抑制α-糖苷酶来减缓各种多糖的消化被认为是糖尿病治愈的关键治疗方法[5]。研究者发现使用含有多种多糖的天然产物可以降低餐后血糖浓度。在吸收和消化过程中可以通过抑制肠膜内的葡萄糖扩散来实现[6]。最近,使用没有任何副作用的天然治疗药物更多应用于这种慢性疾病的治疗[7]。由于天然产物的功效性及安全性,对天然产物衍生的α-葡萄糖苷酶抑制剂的研究也日益增多。相关文献总结了用于治疗2型糖尿病(Type 2 Diabetes-Mellitus,T2DM)的天然产物或医疗植物[8],说明天然产物是α-葡萄糖苷酶抑制剂的丰富来源。
人参是一种Panax属的多年生草本植物(Araliaceae family),也是一种高价值和受欢迎的药用植物。在中国、美国、俄罗斯、日本以及韩国和加拿大等多个国家,人参被大量栽培。人参植物根系用于传统东方医学几千年。其药理学特性主要归因于人参皂苷,不同人参皂苷的活性有所不同[9]。日本科学家早在20世纪20年代就已经证明了人参根皂苷对抗糖尿病有极大的作用。过去十几年,人参及其组分在降血糖疾病中的研究有显著增加。人参皂苷组分具有免疫调节和抗氧化活性,这也是其对高血糖疾病具有有效作用的决定因素。对人参皂苷的作用机理研究表明,它们确有降血压、降血糖、抗疲劳等功效。此后,人参皂苷在降血糖的领域被广泛研究。本文正是借鉴过往经验,深入对人参皂苷Re、Rg2对α-糖苷酶的抑制作用加以研究。
1 材料与仪器
1.1 材料
人参皂苷Re、Rg2,纯度>99%:吉林大学化学学院;α-葡萄糖苷酶(α-glucosidase 750 U/g):美国 Sigma公司;阿卡波糖:四川绿叶宝光药业有限公司;4-硝基酚-α-D-吡喃葡萄糖糖苷(4-Nitrophenyl α-D-glucopyranoside,PNPG):上海宝曼生物科技有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO):北京鼎国昌盛生物技术有限公司;其他试剂均为国产分析纯。
1.2 仪器
电热恒温水浴锅:上海新苗医疗器械制造有限公司;pH计:梅特勒-托利多仪器(上海)有限公司;电子天平(FA1004B):上海佑科仪器仪表有限公司;紫外分光光度计(UV-1800):Japan Kyoto。
2 方法
2.1 相关溶液的配制
2.1.1 磷酸盐缓冲液
磷酸盐缓冲液(phosphate buffered saline,PBS):称取磷酸二氢钠1.94 g、磷酸氢二钠1.92 g,用蒸馏水配制0.1 mol/L的磷酸盐缓冲液,并调为pH6.8,用微孔滤膜过滤,备用。
2.1.2 配制α-葡萄糖苷酶溶液
将冻干酶粉用0.1 mol/L的磷酸盐缓冲液(pH6.8)溶解,配置成6 U/mL的溶液。再将酶液分别稀释配制成 0.2、0.3、0.4、0.5、1.0 U/mL 的酶溶液,冷冻备用。
2.1.3 配制底物PNPG溶液
精确称取0.3766 g PNPG,加入适量0.1 mol/L的磷酸盐缓冲液(pH6.8)溶解,再用容量瓶准确定容到50 mL,配制成250 mmol/L的母液,将母液分别稀释成0.1、0.5、1.0、2.0、2.5、3.0、4.0、5.0 mmol/L 不同梯度的标准品溶液,备用。
2.2 确定反应体系
2.2.1 最佳酶液体积
在反应体系中分别加入α-葡萄糖苷酶酶液(0.3 U/mL)0、10、20、30、40 μL 反应 15 min 后,在波长405 nm下用紫外分光光度计测吸光度,决定酶液体积对葡萄糖生成量的影响,确定最佳加酶量。
2.2.2 反应时间的确定
在反应体系中加入酶液后,分别在 5、7、9、11、13、15、17 min后用紫外分光光度计测吸光度,确定反应的最佳时间。
2.2.3 做标准曲线
用磷酸盐缓冲液(pH6.8)配制为浓度1000 μmol/L的对硝基苯酚(p-nitrophenol,PNP),并稀释成 400、300、200、150、100、50、0 μmol/L 7 种不同的浓度,将不同浓度的PNP各取160 μL,加入80 μL Na2CO3(0.2 mol/L)混匀,在405 nm下用紫外分光光度计测吸光度OD1,测量3组平行试验后取平均值。将吸光度值OD作为纵坐标,对硝基苯酚浓度作为横坐标,绘制曲线。
酶活力单位定义:pH6.8、3℃的条件下,每分钟水解底物所产生的1 μmol对硝基苯酚所需的酶量,定义为1个酶活力单位(U)。
2.2.4 α-葡萄糖苷酶的活力测定
110 μL 磷酸盐缓冲液(pH6.8),加入 30 μL α-葡萄糖苷酶(0.3 U/mL)和1%的DMSO 8 μL放在37℃10 min(恒温)的条件下反应后,加入20 μL PNPG(2.5 mmol/L)放在37℃温度下继续反应10 min,最后加入Na2CO3(0.2 mol/L)80 μL终止反应,在波长405 nm下测吸光度OD2。做3组平行试验。
2.2.5 酶活性抑制率及计算
阿卡波糖的抑制:110 μL磷酸盐缓冲液(pH6.8),加入 30 μL α-葡萄糖苷酶(0.3 U/mL)、1%的 DMSO 8 μL和50 μL不同浓度的抑制剂,放在37℃10 min(恒温)的条件下反应后,加入 20 μL PNPG(2.5 mmol/L)放在37℃温度下继续反应10 min,最后加入Na2CO3(0.2 mol/L)80 μL终止反应,在波长405 nm下测吸光度OD3。做3组平行试验。
Re、Rg2的抑制:110 μL 磷酸盐缓冲液(pH6.8),加入 30 μL α-葡萄糖苷酶(0.3 U/mL)、1%的 DMSO 8 μL和50 μL不同浓度的抑制剂,放在37℃10 min(恒温)的条件下反应后,加入 20 μL PNPG(2.5 mmol/L)放在37℃温度下继续反应10 min,最后加入Na2CO3(0.2 mol/L)80 μL终止反应,在吸光度405 nm下测吸光值OD4。做3组平行试验。
空白组为①磷酸盐缓冲液+酶:用缓冲溶液补足到反应体积,测吸光度OD1。做3组平行试验;②磷酸盐缓冲液+抑制剂+酶:用缓冲溶液补足到反应体积,测吸光度OD3。做3组平行试验。
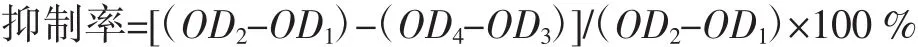
3 结果与讨论
3.1 标准曲线
用不同浓度的PNP进行反应,做出标准曲线,见图1。
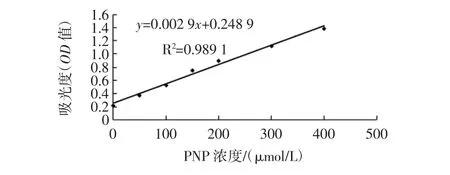
图1 对硝基苯酚光密度标准曲线Fig.1 Standard curve of optical density of p-nitrophenol
3.2 确定α-葡萄糖苷酶酶量对反应体系的影响
在以PNPG为底物与α-葡萄糖苷酶进行的反应体系中,最终测得PNP分解量的吸光度值随着酶量的增加而增大,这可以表现出α-葡萄糖苷酶的活性。在其他组分浓度不变的条件下,酶量越大反应速度越快,当酶浓度为0.3 U/mL,体积为30 μL时,酶量与反应产物呈现良好的线性反应关系,结果如图2所示。

图2 酶量对反应体系的影响Fig.2 Effect of enzyme volume on the reaction system
最终反应体系选定为酶量30 μL进行酶活性的测定。
3.3 反应时间对反应体系的影响
反应时间对反应体系的影响如图3所示。
在反应体系进行时,从第5分钟开始每隔2分钟测一下吸光度,当反应时间达到15 min时,吸光度值出现了平衡期,数值不再上升,因此我们判定反应体系的最佳时间即为10 min。
3.4 阿卡波糖对α-葡萄糖苷酶的活性抑制
阿卡波糖对α-葡萄糖苷酶的活性抑制见图4。

图3 反应时间对反应体系的影响Fig.3 Effect of reaction time on the reaction system

图4 阿卡波糖对α-葡萄糖苷酶的活性抑制Fig.4 Acaconose inhibition of α-glucosidase activity
采用不同浓度的阿卡波糖进行反应,其对α-葡萄糖苷酶的活性抑制作用呈现出良好的剂量关系,抑制曲线与阿卡波糖浓度成正比,尤其当浓度在2mg/mL~8 mg/mL的区间内,抑制率明显随着浓度增大而增大。
因此可以判断本实验体系符合α-葡萄糖苷酶体外抑制模型符合此次大规模的筛选需要。
3.5 不同浓度的人参皂苷Re、Rg2对α-葡萄糖苷酶的活性抑制
测量不同浓度的人参皂苷Re、Rg2对α-葡萄糖苷酶的活性抑制,以人参皂苷Re、Rg2浓度(mg/mL)为横坐标,抑制率(%)为纵坐标,绘制的曲线,结果如图5、图6所示。

图5 人参皂苷Re对α-葡萄糖苷酶的抑制曲线Fig.5 Inhibition curve of ginseng extract Re on α-glucosidase

图6 人参皂苷Rg2对α-葡萄糖苷酶的抑制曲线Fig.6 Inhibition curve of ginseng extract Rg2on α-glucosidase
当浓度在2 mg/mL~8 mg/mL时,人参皂苷Re、Rg2对α-葡萄糖苷酶的活性抑制有着良好的量效关系,抑制曲线与皂苷浓度成正比。这两种人参皂苷均对α-葡萄糖苷酶的活性有明显抑制作用,当浓度较低时,Re对α-葡萄糖苷酶活性的抑制率要比Rg2高,反之,则Rg2对α-葡萄糖苷酶活性的抑制率要比Re高,然而同阳性对照阿卡波糖相比较,这两种人参皂苷对α-葡萄糖苷酶活性的抑制作用都有所不及。
4 结论
随着社会的发展、进步,人类生活水平的日益提升,T2DM的患病率不可避免的与日俱增。T2DM具体特征表现为胰岛素抵抗和胰腺β细胞功能障碍,且是一种复杂的异种多发性疾病。由于胰腺β细胞的死亡或功能的丧失,会引起餐后胰岛素分泌受损,致使高血糖且随后胰岛素敏感性下降。因此,迫切需要更好的治疗方法和T2DM的新型预防策略。为解决这一难题,科研人员开始建立适当的体内和体外模型。迄今为止,一些实验模型可用于研究T2DM,然而,通过调整现有方法或通过开发新方法或两者的组合,来继续追求建立T2DM更好实验模型是更好的途径。虽然有个别几种药物对治疗糖尿病有很好的疗效,但都具有极大的副作用或不良反应。因此,近些年大量研究人员开始寻求天然产物或饮食干预来预防或治疗T2DM。数千年来,随着医学实践,中医药传统医学系统积累了大量宝贵的经验。截至目前,人参成为了治疗糖尿病最有效替代药物之一。人参在我国是特有的一种珍贵药材,几千年来食用人参的传统一直得以延续。而糖尿病可以导致各种各样的疾病及代谢紊乱,是一种顽固的疾病且在全球年发病率一直持续增加[10]。在人体中,葡萄糖耐受作用在高血压发生之前即受到抑制[11-12],广泛用作检测糖尿病的临床指标。人参的药理作用主要归因于人参皂甙,主要分为原人参二醇型人参皂苷(protopanaxdiolcas,PDG),如人参皂甙 Rb1,Rb2,Rc,Rd,Rg3和 Rh2以及原人参三醇型人参皂甙(protopanaxatriol,PTG),如人参皂苷 Rg1。PDG 组中的糖部分连接到C-3位,而PTG基团连接在C-6位上。以前的大量研究已经可以证明人参皂苷Rb1对降血糖具有良好的作用。而本试验则是首次利用人参皂苷Re、Rg2进行的体外实验,并且通过数据结果显示,最终达到了预期效果。
酶活性的影响因素有很多,为了有一个良好的反应体系,此试验优化了酶量和反应时间。结果表明,酶量用30 μL,反应时间10 min为最佳状态,这其中不足之处就是人参皂苷Re、Rg2的最大溶解度是8 mg/mL,否则将会有更好的抑制效果。人参皂苷能有效抑制α-葡萄糖苷酶的体外活性,由于体内抑制和体外抑制两者之间具有很大差异,所以还需进行体内实验,进一步通过体内模型来研究人参皂苷的抑制效果,并提供一些体内降血糖的理论依据。
[1]Bremer AA,Mietus-Snyder M,Lustig RH.Toward a unifyinghypothesis of metabolic syndrome[J].Pediatrics,2012,129(3):557-570
[2]Modak M,Dixit P,Londhe J,et al.Indian herbs and herbal drugs used for the treatment of diabetes[J].J Clin Biochem Nutr,2007,40(3):163-173
[3]Rang H,Dale MM,Ritter JM,et al.Pharmacology[M].NewYork:Churchill Livingstone,2003
[4]RosendaleDI,Blatchford PA,Sims IM,et al.Characterizing kiwifruit carbohydrate utiliza-tion in vitro and its consequences for human faecal microbiota[J].J Proteome Res,2012,11(12):5863-5875
[5]Shodehinde SA,Ademiluyi AO,Oboh G,et al.Contribution of Musa paradisiaca in the inhibition of a-amylase,a-glucosidase and Angiotensin-I converting enzyme in streptozo-tocin induced rats[J].Life Sci,2015,133:8-14
[6]Jenkins DJ,Leeds AR,Gassull MA,et al.Decrease in postprandial insulin and glucose concentrations byguar and pectin[J].Ann Intern Med,1977,86(1):20-23
[7]Dorai AA.Wound care with traditional,complementary andalternative medicine[J].Indian J Plastic Surg Official Publ AssocPlastic Surg India,2012,45(2):418-424
[8]Ríos JL,Francini F,Schinella GR.Natural products for the treatment of type 2 diabetes mellitus[J].Planta Med,2015,81(12/13):975-994
[9]AtteleAS,Wu JA,Yuan CS.Multiple constituents and multiple actions[J].Ginseng pharmacology,1999,58(11):1685-1693
[10]Soriguer F,Goday A,Bosch-Comas A,et al.Prevalence of diabetes mellitus and impaired glucose regulation in Spain:the Di@bet.es Study[J].Diabetologia,2012,55(1):88-93
[11]Jordan SD,Kruger M,Willmes DM,et al.Obesity-induced overexpression of miRNA-143 inhibits insulin-stimulated AKT activation and impairs glucose metabolism[J].Nat Cell Biol,2011,13(4):434-436
[12]Caesar R,Reigstad CS,Backhed HK,et al.Gut-derived lipopolysaccharide augmentsadipose macrophage accumulation but is not essential for impaired glucose or insulin tolerance in mice[J].Gut,2012,61(12):1701-1707

