3种基因型芹菜修复DDT老化污染农田土壤初探
郑学昊,孙丽娜, ,马欣雨,刘克斌,王辉,张鸿龄,王晓旭,桑淑婷,李福臣
滴滴涕(Dichloro diphenyl trichloroethane,DDT),化学式为(ClC6H4)2CH(CCl3),分子量为354.5,存在4种衍生物,具有污染持久性、生物富集性和长距离迁移性等特点,作为首批持久性有机污染物被列入《斯德哥尔摩持久性有机污染物控制公约》。20世纪,DDT作为农药杀虫剂在世界范围内被广泛应用,但由于喷洒技术的限制,大部分DDT直接落入土壤,与土壤颗粒络合并逐渐老化,长期存在于土壤中难以去除。农作物在含有 DDT污染的土壤中生长会富集 DDT,使其进入食物链。有研究表明,DDT等有机氯农药对动物生殖系统、神经系统、内分泌系统都会产生重大影响(高艳菲,2011),在人类母乳、脐带血中皆发现了DDT及其代谢产物的存在(屈伟月,2007),这意味着人体内的 DDT甚至可以通过哺乳行为从母体传递给幼体,对人类健康造成极大危害。截至目前,中国虽已经禁用DDT农药长达30余年,但其在土壤中依然有较高的检出率(陈苏等,2016)。近年来,一种被广泛使用的新型杀虫剂三氯杀螨醇中也含有DDT杂质,这使得土壤中的DDT及其衍生物有了新的来源(Wang et al.,2017)。
传统的物理和化学方法修复有机污染土壤虽已形成较为规范的技术路线和管理模式,但在施工时需要消耗较大的人力物力(郑学昊等,2017;USEPA,1997),其主要修复目标为高污染水平的工业区,不适用于农田污染土壤修复。目前化学强化植物-微生物联合修复方法因目标性强,无二次污染等特色而成为 DDT污染农田土壤修复的主要研究方向,其中植物筛选是构成联合修复方法的基础性工作,而中国目前在该方面所筛选出的植物种类比较单一,主要集中在苜蓿(Medicago sativa)、黑麦草(Lolium perenne)等豆科、禾本科植物上(张娟,2016)。近年来,有研究发现芹菜对多环芳烃类有机污染物具有较好的去除效果(Wei et al.,2017),多环芳烃和DDT同属芳香烃类污染物,其开环氧化过程及过程参与酶皆有许多相似之处,同时也有研究通过对大量蔬菜样品进行农药残留调查发现芹菜产品中有机氯农药检出率较高(Wu et al.,2016),这些研究结果可能预示着芹菜对土壤中 DDT污染物存在良好去除效果。由于土壤存在异质性,实验室研究所得出的结论可以作为研究基础但难以在实际工程中直接应用。因此,本研究以设施农田为实验场地,通过现场实验的方式,以芹菜作为修复植物对老化 DDT污染土壤进行修复,同时对比了芹菜在不同污染水平下对 DDT的富集情况,最终以酶活性作为微生态指标表征修复后对土壤的扰动程度,旨在为未来工程性修复土壤DDT污染时提供更多的可选植物。
1 材料方法
1.1 试验场地
试验场地为辽宁省沈阳市沈北新区某花卉生产基地,基地土地被分割成1 m×1 m样方,相邻样方内设置20 cm高的隔离带以避免交叉污染。据调查,该基地有长年施用 DDT农药的历史,土壤类型为粉砂质黏土,pH值为 7.18,有机质(SOM)含量为50.62 g·kg-1,土壤阳离子交换量(CEC)为13.10 cmol·kg-1。
1.2 试验设计
选用3种芹菜,分别为西芹(Apium graveolens Linn,X)、美国红芹(Rubrum apium,H)、中华药芹(Libanotis seseloides Turcz,Z)作为供试植物对DDT污染土壤进行修复,以不栽种任何植物处理为对照试验(自然去除率),前期采集供试样地土样,进行污染物背景值测定,在两个污染水平的样方内直接进行3种芹菜实际修复实验,芹菜先期育苗后栽种于样方内,保持温度,定期浇水,使芹菜正常生长。实验始于2017年6月15日,芹菜生长3个月后,采集根际土,同时采集植物样品,测定芹菜体内(地上/地下)DDT富集量。芹菜根际土采集方法参照Garcia et al.(2005),编号处理及背景值详见表1,低污染地块DDT质量分数为(46.0±2.8) μg·kg-1, 高 污 染 水 平 为 (72.2±3.0)μg·kg-1。采集土壤样品后自然风干研磨过60目筛,进行DDT质量分数定量分析。植物样品采集后反复冲洗干净,分为地上部分(茎叶部分)和地下部分(根部),自然风干后使用高速粉碎机粉碎过60目筛,超声提取植物体内 DDT。每组处理设置 3次重复,根际土与植物体内DDT质量分数皆以干重计算。
1.3 分析方法
参照王晓旭等(2016)的方法,使用加速溶剂萃取-磺化法对土壤DDT进行提取净化。参照吕良禾(2017)的方法,使用超声萃取-磺化法对植物体内DDT进行提取和净化采用气相色谱-电子捕获检测器(GC-ECD)对土壤样品和植株样品中的DDT进行定量分析(王晓旭等,2016)。多酚氧化酶与转化酶均采用比色法测定(关松荫,1986)。
1.4 实验材料
实验中所使用的主要仪器包括:加速溶剂萃取仪(美国戴安公司,ASE300型)、气相色谱(美国瓦里安公司,CP-3800型)、超声清洗仪(昆山超声仪器有限公司,KQ-300VDB型)、旋转蒸发仪(上海亚荣生化仪器厂,RE-52AA型)、万能高速粉碎机(香港欧凯莱芙实业公司,RRHP-100型)、无油真空泵(天津市恒奥科技发展有限公司,HPD-25型)。化学试剂主要包括:丙酮、二氯甲烷(分析纯,天津市富宇精细化工有限公司)、正己烷(山东禹王实业有限公司化工分公司)、DDT标样(百灵威科技有限公司)。

表1 处理编号及供试土壤DDT背景值Table 1 The treatments and initial concentrations of DDT in soils
1.5 数据分析
运用Excel 2016进行数据计算;运用Origin 8.5进行绘图;运用SPSS11进行Pearson双变量相关性分析、ANOVA方差分析与t检验。
2 结果分析与讨论
2.1 芹菜对根际土的修复效果
3种芹菜在两种DDT污染水平下对根际土壤的修复作用如图 1所示,CK1、X1、H1、Z1、CK2、X2、H2、Z2 处理 DDT去除率分别为 2.1%、48.80%、33.96%、31.92%、1.7%、39.41%、35.14%、26.60%,其中西芹的修复效果最好,经t检验成对分析表明,其种间差异较低,但西芹与中华药芹的差异显著性水平(Sig.)达到0.087,同时ANOVA方差分析表明,芹菜在不同污染水平下对根际土中DDT去除率有显著性差异(P<0.05),当 DDT污染水平升高时,西芹和中华药芹对DDT的去除率有所下降,美国红芹在DDT污染土壤修复过程中表现较为稳定。

图1 不同基因型芹菜对DDT去除率Fig. 1 The degradation rates of DDT with different celery cultivarsCK1 means no celery planted in low concentration; X1 means A.graveolens planted in low concentration; H1 means R. apium planted in low concentration; Z1means R. apium planted in low concentration; CK2 means no celery planted in high concentration; X2 means A. graveolens planted in high concentration; H2 means R. apium planted in high concentration; Z2means R. apium planted in high concentration.n=3. The same below
植物对污染物的去除机制在于植物萃取和根系分泌物氧化,此外,植物与根际微生物构成的植物-微生物修复体系对污染物去除也有明显的强化作用(Mansouri et al.,2017)。对于植物修复DDT污染土壤的研究,前人已经进行过植物筛选工作,例如Lunney et al.(2004)对比了西葫芦(Cucurbita pepo)、高羊茅(Festuca elata)、苜蓿(Medicago Sativa)等植物对DDT的去除效果,并认为修复效果与植物本身的蒸腾能力、生物量和根际分泌物组成相关,同时对于不同基因型的蓖麻(Ricinus communis)、南瓜(Cucurbita moschata)进行研究发现,不同基因型的同种植物,其去除DDT的能力存在较大差异(Huang et al.,2011;朱治强,2012)。本试验的供试植物虽同属芹菜科,但西芹根际土壤的DDT去除率最高可达到48.80%,其他两种芹菜的去除率低于西芹,由此可见,西芹自身具有一定的DDT修复能力。有研究表明,芹菜根系分泌的亚油酸、亚麻酸直接发挥了去除有机污染物的作用(Yi et al.,2007),而目前有机酸被认为是污染土壤修复过程中的一项重要强化措施,其可以通过活化有机污染物、土壤微生物和土壤酶而加速有机污染物去除,许多实验证明在使用有机酸修复有机污染土壤中都有较好效果(王亚男等,2016;Agnello et al.,2015)。因此,推测根际分泌物对根际环境的优化行为与直接对污染物的氧化过程可能是芹菜去除DDT的原因之一。
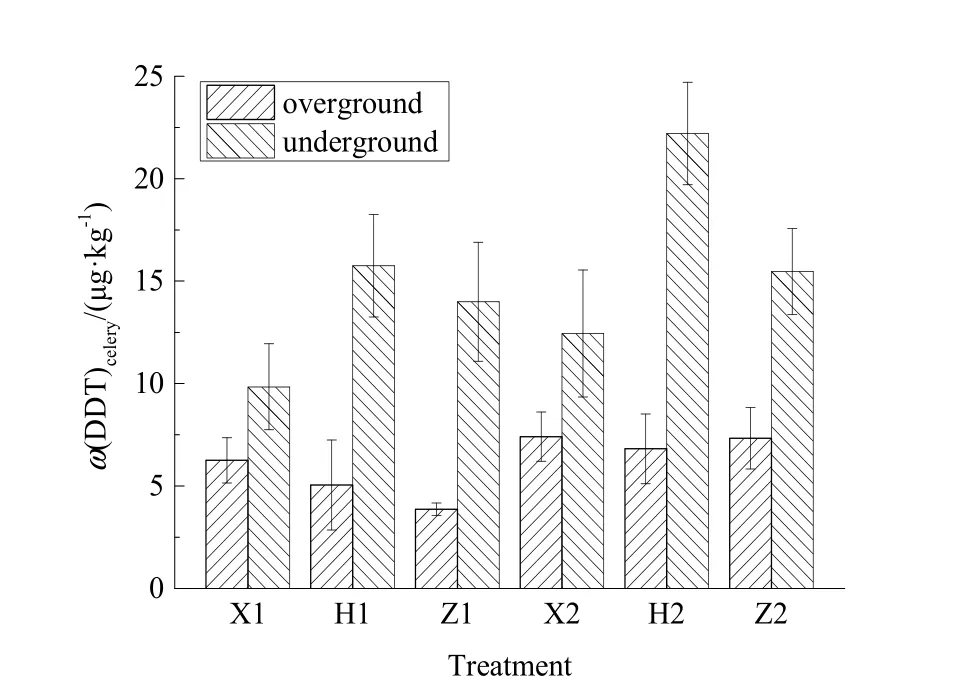
图2 不同基因型芹菜富集DDT情况Fig. 2 The bioconcentration of DDT by different celery cultivars
2.2 芹菜修复过程中对污染物富集情况
芹菜修复3个月后,芹菜地上部分(茎/叶,干重)和地下部分(根部,干重)中 DDT的质量分数如图2所示。不同种类芹菜地上部分DDT的质量分数表现为西芹>美国红芹>中华药芹,地下部分中DDT的富集量表现为美国红芹>中华药芹>西芹,经ANOVA方差分析,芹菜地上部分与地下部分(干重)中的DDT质量分数存在显著性差异(P<0.05),高水平污染土壤中生长的芹菜,其体内 DDT含量显著高于低水平污染土壤中生长的芹菜,因此,土壤中DDT质量分数升高可能促进芹菜富集DDT。美国红芹对DDT的富集能力最强,其根部的DDT质量分数最高,为 22.2 μg·kg-1,但未达到 GB18406.1—2001农产品安全质量无公害蔬菜安全要求中规定的限值(100 μg·kg-1)。伴随土壤中DDT污染水平提高,美国红芹体内污染物质量分数相对于其他两种芹菜有较高的提升,说明美国红芹可能更具作为 DDT富集植物的潜力,可以在今后的研究中对美国红芹的最大 DDT耐受程度及富集能力作进一步研究。
前人研究发现,植物地下部分 DDT的质量分数普遍高于地上部分,根/茎叶(干重)中DDT质量分数比甚至可达到10倍(王玉红,2006),研究者们一般认为其原因在于植物根部一旦吸收有机污染物就会通过木质化作用将其储存至植物组织中(王亚男等,2016),而叶片中的DDT主要来自于根部吸收扩散。本试验中,虽然芹菜地下部分DDT质量分数较高,但地上部分作为可食用部分,较低的 DDT富集能力可能预示着利用芹菜修复DDT污染土壤时不影响农田的生产功能,由于具备绿色经济的特点,可将其纳入“边修复边生产”的绿色修复理念体系。此外,有学者指出可以通过施加表面活性剂和构建植物-专性降解菌体系以阻控污染物在作物-土壤体系中的迁移(朱利中,2012),在后续研究中可以通过施加适当调控措施阻控DDT进入芹菜根部以完善该植物修复技术。
2.3 修复后对土壤酶活性影响及与去除率相关性分析
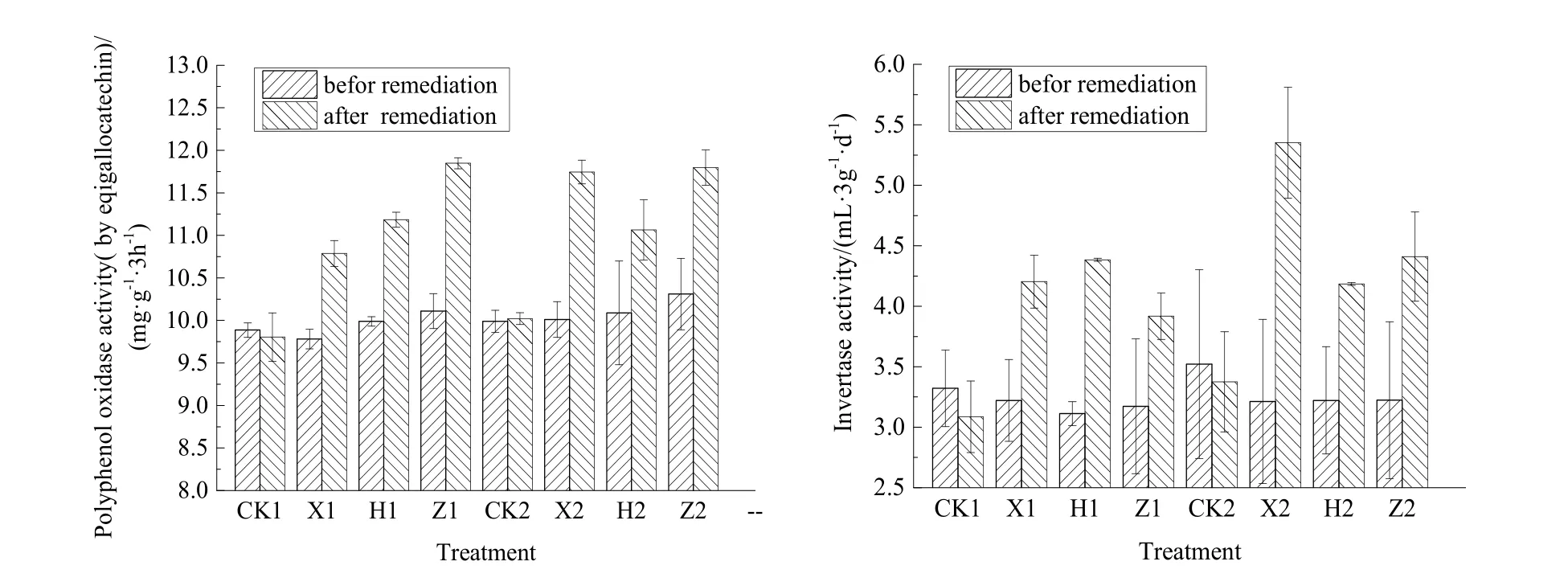
图3 不同基因型芹菜对土壤酶影响Fig. 3 The enzyme activities in soil grown different celery cultivars
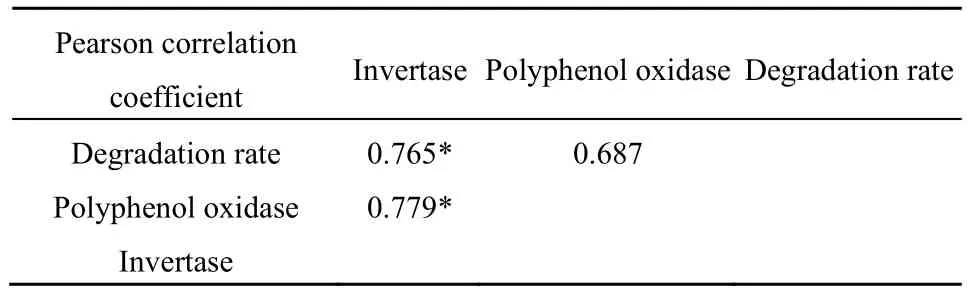
表2 DDT去除率与酶活性的Pearson相关系数Table 2 Pearson correlation coefficient among the degradation rateof DDT and the soil enzymes activities
在芹菜种植前后,芹菜根际土壤多酚氧化酶和转化酶活性变化如图3所示。多酚氧化酶活性与转化酶活性在90 d的修复期后均升高,经ANOVA方差检验,芹菜根际土中的转化酶变化达到显著性差异(P<0.05),芹菜根际土中多酚氧化酶变化的显著性水平达到0.084。在多酚氧化酶的活性表现上,中华药芹为最优的芹菜品种,而美国红芹在激活土壤多酚氧化酶的能力上表现较为稳定,西芹在高水平污染的土壤中具有更高的多酚氧化酶活性。在转化酶方面,西芹有助于提高转化酶活性,在高水平污染胁迫时,西芹和中华药芹根际土中转化酶的活性更高,美国红芹亦表现为较为稳定的转化酶活性。对DDT去除率、多酚氧化酶活性、转化酶活性进行 Pearson双变量相关性分析,结果如表2所示,发现转化酶分别与DDT去除率和多酚氧化酶存在较显著相关性(P<0.05),DDT去除率与多酚氧化酶相关性不强,但相关系数r达到0.687。
在研究土壤修复过程中土壤酶活性变化对表征土壤修复过程具有较为实用的价值,前人研究将土壤酶作为指示土壤修复过程的微生态指标(王洪等,2011)。本研究选取了 1种氧化酶(多酚氧化酶)和1种还原酶(转化酶)对芹菜修复DDT污染土壤情况进行指示,多酚氧化酶是 DDT污染物去除过程中的重要参与酶(孙丽娜等,2016),在芳香烃化合物的开环继而氧化成酚的过程中发挥了重要作用(侯梅芳等,2014)。本研究表明,3种芹菜本身都具备提高多酚氧化酶活性的能力,在污染物质量分数升高过程中,美国红芹的多酚氧化酶活性较为稳定,其可能具备更大的 DDT污染耐受范围。在Pearson双变量相关性分析结果中,多酚氧化酶与 DDT去除率相关性较弱,但在之前的研究中多酚氧化酶活性与 DDT去除率存在显著正相关关系(郑学昊等,2018),其中原因可能是,在表面活性剂等多种措施强化下,土壤微生物对污染土壤进行快速修复,土壤酶是共代谢作用的主要作用物质,而在简单的植物修复中污染物去除更趋向于慢性的蚕食过程。因此,多酚氧化酶与去除率的相关性可能存在差异,土壤酶活性变化是一个复杂的生态过程,同时,不同种酶活性之间也存在一定相关性。这与王洪等(2011)的研究结果相似,其认为其中原因为微生物之间的相互作用,而本研究中,由于修复条件较为简单,则认为两种酶的来源相同是其具有良好相关性的主要原因。
根际微生物代谢对是植物修复有机污染土壤的重要机理之一(吕良禾等,2017),而转化酶是表征土壤微生物活性的重要酶类(王辉等,2017),相关性分析发现转化酶与 DDT去除率存在一定相关性,说明在植物修复 DDT污染土壤过程中,根际微生物活性是其较高去除率的原因之一且其作用可能更优于多酚氧化酶的代谢。
3 结论与展望
(1)芹菜在不同污染水平下对 DDT的去除效果达到显著性差异,其对 DDT的富集区域主要集中在根部,地上部分对 DDT的富集性较低,芹菜根际土中的多酚氧化酶与转化酶活性都呈现持续升高的态势且与去除率都有一定的相关性,相对于多酚氧化酶的氧化作用,转化酶所代表的微生物活性更有助于DDT的去除。
(2)西芹对 DDT的去除效果最好,且无显著富集性,配合污染物的土壤-根系组控技术可应用于构建“边修复边生产”的绿色修复体系。美国红芹对 DDT的富集能力较高,且去除效果和酶活性激活能力对不同污染水平具有较为稳定的响应,可在后续研究中作为富集植物对其最大耐受程度作进一步研究。
AGNELLO A C, HUGUENOT D, HULLEBUSCH E D V, et al. 2015. Citric acid- and Tween 80-assisted phytoremediation of a co-contaminated soil:alfalfa (Medicago sativa L.) performance and remediation potential [J].Environmental Science & Pollution Research International, 23(9): 1-12.
GARCIA C, ROLDAN A, HEINANDEZ T, 2005. Ability of diあerent plant species to promote microbiological processes in semiarid soil [J].Geoderma, 124(1): 193-202.
HUANG H G, YU N, WANG L J, et al. 2011. The phytoremediation potential of bioenergy crop Ricinus communis for DDT and cadmium co-contaminated soil [J]. Bioresource Technology, 102(23):11034-11038.
LUNNEY A I, AND B A Z, REIMER K J. 2004. Uptake of Weathered DDT in Vascular Plants: Potential for Phytoremediation [J]. Environmental Science & Technology, 38(22): 6147-6154.
MANSOURI A, CREGUT M, ABBES C, et al. 2017. The Environmental Issues of DDT Pollution and Bioremediation: a Multidisciplinary Review [J]. Applied Biochemistry and Biotechnology, 181(1):309-339.
WANG X, SUN L, WANG H, et al. 2017. Surfactant-enhanced bioremediation of DDT and PAHs in contaminated farmland soil [J].Environmental Technology, 39(13): 1733-1744.
WEI J, ZHANG X, LIU X, et al. 2017. Influence of root components of celery on pyrene bioaccessibility, soil enzymes and microbial communities in pyrene and pyrene-diesel spiked soils [J]. Science of the Total Environment, 599-600: 50-57.
WU L P, ZHOU X L, ZHAO D Y, et al. 2016. Seasonal variation and exposure risk assessment of pesticide residues in vegetables from Xinjiang Uygur Autonomous Region of China during 2010—2014 [J].Journal of Food Composition and Analysis, 58: 1-9.
YI H, CROWLEY D E. 2007. Biostimulation of PAH Degradation with Plants Containing High Concentrations of Linoleic Acid [J].Environmental Science & Technology, 41(12): 4382-4388.
陈苏, 单岳, 晁雷, 等. 2016. 表面活性剂-微生物联合修复滴滴涕污染土壤的研究[J]. 生态环境学报, 25(9): 1522-1527.
高艳菲. 2011. 六六六和滴滴涕污染场地土壤的修复[D]. 南京: 南京农业大学.
GB18406.1—2001. 2005. 农产品安全质量无公害蔬菜安全要求[S]. 北京: 中国标准出版社.
关松荫. 1986. 土壤酶及其研究方法[M]. 北京: 中国农业出版社.
侯梅芳, 潘栋宇, 黄赛花, 等. 2014. 微生物修复土壤多环芳烃污染的研究进展[J]. 生态环境学报, 23(7): 1233-1238.
吕良禾, 张鸿龄, 陈宗聪, 等. 2017. 表面活性剂强化油菜-微生物联合修复滴滴涕污染农田土壤研究[J]. 生态与农村环境学报, 33(8):755-761.
吕良禾. 2017. DDT污染土壤表面活性剂强化植物—微生物联合修复技术研究[D]. 沈阳: 沈阳大学.
屈伟月. 2007. 广东省特殊人群血液和母乳中多溴联苯醚、有机氯农药和多氯联苯的初步研究[D]. 广州: 中国科学院研究生院广州地球化学研究所.
孙丽娜, 吕良禾, 张鸿龄. 2016. 滴滴涕污染土壤的生物修复技术[J]. 沈阳大学学报: 自然科学版, 28(6): 446-451.
王洪, 李海波, 孙铁珩, 等. 2011. 生物修复PAHs污染土壤对酶活性的影响[J].生态环境学报, 20(4): 691-695.
王辉, 王晓旭, 孙丽娜, 等. 2017. 血粉刺激修复 DDT污染农田土壤的现场实验[J].中国环境科学, 37(2): 654-660.
王晓旭, 孙丽娜, 吴昊, 等. 2016. 表面活性剂强化球形节杆菌修复DDT污染农田土壤的现场实验[J].环境工程学报, 10(11): 6768-6774.
王亚男, 程立娟, 周启星. 2016. 萱草修复石油烃污染土壤的根际机制和根系代谢组学分析[J]. 环境科学, 37(5): 1978-1985.
王亚男, 程立娟, 周启星. 2016. 植物修复石油烃污染土壤的机制[J]. 生态学杂志, 35(4): 1080-1088.
王玉红. 2006. 紫花苜蓿 (Medicago sativa) 对有机氯农药DDT污染土壤的修复研究[D]. 南京: 南京林业大学.
杨乐巍, 黄国强, 李鑫钢. 2006. 土壤气相抽提(SVE)技术研究进展[J].环境保护科学, 32 (6): 62-65.
张娟, 刘燕. 2016. 植物修复多环芳烃污染土壤研究进展[J]. 环境科学与技术, 39(6): 110-116.
郑学昊, 孙丽娜, 刘克斌, 等. 2018. 根际促生菌及木质素对持久性有机污染土壤修复的调控和酶活性的影响[J]. 生态学杂志, 37(6):1807-1814.
郑学昊, 孙丽娜, 王晓旭, 等. 2017. 植物-微生物联合修复PAHs污染土壤的调控措施对比研究[J]. 生态环境学报, 26(2): 323-327.
朱利中. 2012. 有机污染物界面行为调控技术及其应用[J]. 环境科学学报, 32(11): 2641-2649.
朱治强. 2012. Cd-DDT复合污染土壤的植物与微生物联合修复及机理[D]. 杭州: 浙江大学.

