锰化厂土壤重金属污染及微生物群落结构特征
蔡茜茜 ,袁勇,余震,裴东辉,黄雷,周巍
重金属污染尤其是土壤重金属污染已成为危害全球环境质量以及人类生存和发展的主要问题之一(陈欣瑶等,2017)。工业生产过程中未能对重金属进行合理处理,使其通过各种途径排放到环境中,是土壤重金属污染的主要来源(Tapase et al.,2017;刘庆,2008)。受到重金属污染的土壤,往往富集多种耐重金属的微生物(Gupta et al.,2017),它们可通过生物固定、转化、溶解、氧化还原或吸附等方式影响土壤重金属的毒性及其迁移与释放(Pacwa et al.,2018;杨金水等,2017)。由于土壤微生物对重金属胁迫具有敏感性,可通过微生物群落结构的变化来反映土壤的健康状况(陈欣瑶等,2017)。土壤重金属污染与微生物群落之间的关系也一直是土壤重金属污染生态学研究的热点问题(刘云国等,2007)。因此,从微生物群落结构及多样性、均匀性方面揭示土壤功能,能深刻阐明土壤微生物对重金属胁迫的敏感程度及其变化趋势,为改进土壤微生物修复重金属污染技术提供理论依据。
本研究主要对锰化厂受重金属污染的土壤进行研究分析,该工厂历史悠久,在过去生产中没有采取有效环保措施,致使重金属泄露(熊云武等,2017)。本研究主要分析该锰化厂重金属锰(Mn)、铬(Cr)、镍(Ni)、铜(Cu)、锌(Zn)、砷(Zn)、镉(Cd)、汞(Hg)、铅(Pb)污染的土壤剖面分布情况,探索锰化厂周边污染土壤中重金属的垂直分布机理,为防止该污染对地下水造成污染提供科学依据。长时间受重金属污染的锰化厂的土壤中,存在大量具有抵抗和转化重金属的潜在高效的微生物资源,因此本研究还分析了土壤的微生物群落结构的剖面变化情况,旨在揭示土壤微生物与土壤重金属之间的关系,为抗重金属优良菌种的选育提供依据。
1 材料与方法
1.1 土壤样品采集及样品处理
锰化厂位于广东省东北部,属于亚热带季风气候区,全年气温高,光照充足,雨水丰富,年均气温21.7 ℃,年均降水量1289.3 mm。采取钻孔、多点混合取样法(同一采样单元采 5~10个样品)对锰矿尾渣堆放区周围污染点进行垂直深层(>0.2 m)取样(程东祥等,2009),深度分别为0.3~0.5、1.0~1.5、2.0~2.5、3.0~3.5 m,并且对应编号为 H1、H2、H3和 H4。采集的土样带回实验室并储存于-20 ℃待后续实验与分析。
1.2 土样化学性质测试方法
将采集的样品进行风干,研磨后过100目筛,干燥保存待理化性质分析。以下测试每个样品做 3个平行。
重金属测试消解方法参考《土壤和沉积物王水提取金属元素-电感耦合等离子体质谱法》(HJ 803—2016,中华人民共和国环境保护部,2016)。用电感耦合等离子体质谱仪(ICP-MS/CASCQTSA0004)进行检测。
pH的测定参考《土壤pH的测定方法》(NY/T 1377—2007,中华人民共和国农业部,2007),用pH计(PHS-25型数显pH计)测量。
1.3 土壤总DNA的提取
土壤DNA提取采用土壤微生物DNA强力提取试剂盒(Power Soil® DNA Isolation Kit)提取。提取后,使用质量分数为0.8%的琼脂凝胶电泳检测DNA提取成功与否。每个样品进行3个重复,提取后置于离心管中,-80 ℃条件下保存待生物检测。
1.4 群落分析(Caporaso et al.,2010)
16 rDNA测序采用Hiseq Rapid SBS kit v2试剂盒,借助Illumina测序分析平台研究土壤微生物群落组成和多样性,并在门、纲、目、科、属水平上,分析比较该污染区域土壤垂直方向上微生物群落组成的变化。文库构建使用TruSeq DNA PCR-Free Sample Prep Kit。
1.5 土壤质量评价及数据统计分析
1.5.1 内梅罗综合污染指数
土壤质量评价中的重金属评价参考《土壤环境质量标准》(GB15618—1995,国家环境保护总局,1995)中的二级标准,该标准为保障农业生产,维护人体健康的土壤限制值。采用内梅罗综合污染指数法可以大体确定重金属污染程度(王振中等,1994):

式中,P为综合污染指数;n为土壤中污染物质的种类数;Pi为单项污染指数(张金莲等,2015);Ci为污染物实测值;Si为污染物评价标准。污染级别的评价标准为:P<1.0,未污染;1.0<P<2.0,轻污染;2.0<P<3.0,中污染;P>3,重污染。根据该方法可判别该锰化厂的主要污染因子及土壤受重金属污染的程度。
1.5.2 显著性分析
采用 SPSS(Statistical product and service solutions)对垂直方向上的受试土壤性质进行显著性相关分析。对于两变量之间,r值代表假设检验的显著水平:r<0.01,两者呈极显著相关;0.01<r<0.05,两者呈显著相关;r>0.05,无显著相关关系。其中,相关性系数p代表相关程度:∣p∣≥0.8,两变量间高度相关;0.5≤∣p∣<0.8时,中度相关;0.3≤∣p∣<0.5,低度相关;∣p∣<0.3,基本不相关。
1.5.3 典范对应分析
以微生物属分类分别与采样点、重金属含量作为数据来源,采用Canoco 4.5对锰化厂土壤重金属和群落种群进行典型对应分析(Canonical correspondence analysis,CCA),步骤如下:(1)通过去趋势对应分析(Detrended correspondence analysis,DCA)得到排序轴梯度长度,长度小于3或介于3~4之间则选用线性模型CCA分析;(2)以微生物丰度为物种数据,以各重金属含量为环境数据,导入软件,进行CCA分析;(3)运用CanoDraw绘制微生物与重金属的CCA二维排序图。
2 结果与讨论
2.1 锰污染土重金属含量及污染评价
表1所示为锰化厂污染土壤样品的特性及重金属含量测试结果,结果表明,该污染地不同深度的土壤均为酸性,pH值介于4.71~5.14之间。锰(Mn)在土壤3.5 m以上深度的含量均远远超过广东土壤背景值,其中2.5 m以上土壤Mn含量是背景含量的两三百倍,已远远超出正常范围,能直接对人体造危害。铬(Cr)、镍(Ni)、铜(Cu)、锌(Zn)、砷(As)、镉(Cd)、汞(Hg)、铅(Pb)等重金属元素也有不同程度的污染,3.5 m以上土壤重金属浓度均大大超过了土壤背景值,说明该锰化厂在过去生产中没有采取有效环保措施,以上重金属元素超标主要来自外部非自然条件的长期累积。同时,该区重金属污染中,只有Cr、Ni、Hg符合二级土壤质量标准,其他重金属均不同程度地超过了该标准。对于重金属污染的部分,H1~H4综合污染指数分别为12.66、9.650、1.400和0.560。结果表明,H1、H2属于重度污染,其中,Cu(P=27.600、17.200)、Zn(P=14.400、16.200)、As(P=28.400、15.950)、Cd(P=17.200、16.400)和 Pb(P=11.800、10.660)单因子污染指数已达到重度污染程度,对土壤环境质量产生严重的危害;H3为轻度污染,其中,Cu(P=1.500)、As(P=1.820)、Cd(P=1.550)单因子污染指数为轻度污染,Zn(P=3.500)单因子污染指数为重污染;H4为影响较小的未污染区,其中Zn(P=1.210)单因子污染指数为轻污染程度。由此可见,该锰化厂土壤存在严重Mn污染,在土壤深度3.0 m以上还伴有多种重金属复合污染,对该区土壤生态环境存在潜在威胁。
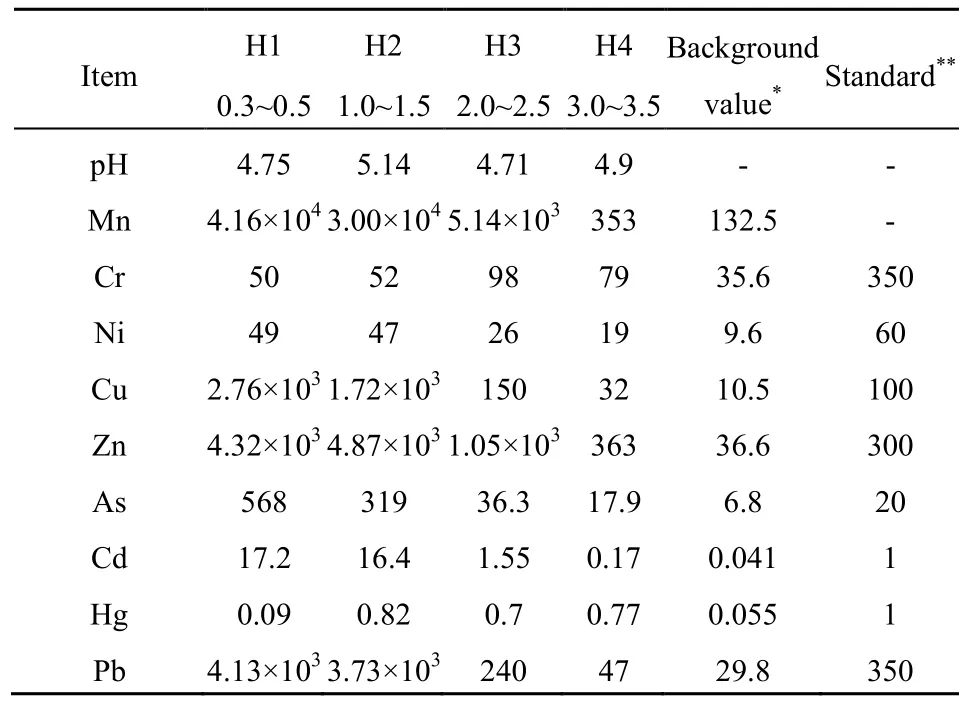
表1 锰污染土壤样品特性及重金属含量Table 1 The characteristics and concentration of heavy metals in manganic contaminated soil mg∙kg-1
从以上污染元素在土壤剖面中最大值的分布可以看出,对于污染历史悠久的锰化厂来说,表层Mn、Cu、Zn、Pb含量明显高于深层,表明这4种元素主要集中在土壤表层,向下迁移的程度较低,这可能与这几种元素在土壤中的有效性程度较低有关。运用SPSS对以上元素含量与所处的深度进行相关性分析能更加明确该区重金属的垂直迁移规律。其中,Mn(r=0.029,p=-0.971)、Ni(r=0.041,p=-0.959)、Cu(r=0.043,p=-0.957)、As(r=0.049,p=-0.951)与土壤深度呈显著负相关,说明以上元素随采样深度增加,其全量逐渐减少,且递减规律显著;Cr、Zn、Cd、Hg以及Pb随采样深度的增加其全量呈上下波动状态或相关性不显著。
2.2 不同程度污染土壤中微生物多样性及群落组成分析
2.2.1 微生物多样性分析
微生物对环境扰动(污染)十分敏感,不同种类微生物对环境扰动的敏感程度不同,因此重金属污染可能引起微生物的种类组成和丰度发生明显变化。经测序获得各采样土层细菌的丰富度和多样性指数(表 2),可见:(1)chao1数及 ACE显示H1~H3细菌物种总数随着深度增加而减少,而H4物种总量最高,结合4个土壤深度重金属污染情况可知,土壤重金属含量与微生物数量大体呈负相关,与李小林等(2011)报道的重金属污染程度与土壤微生物数量呈负相关的结论一致;(2)Shannon指数与Simpson指数显示,微生物群落多样性及均匀性总体上随着取样深度增加而有所减少,与文献报道一致,土壤综合污染较轻时土壤微生物多样性指数较高,随着重金属综合污染指数的增加,达到中度到高度污染时,微生物多样性指数迅速下降(杨济龙等,2003)。
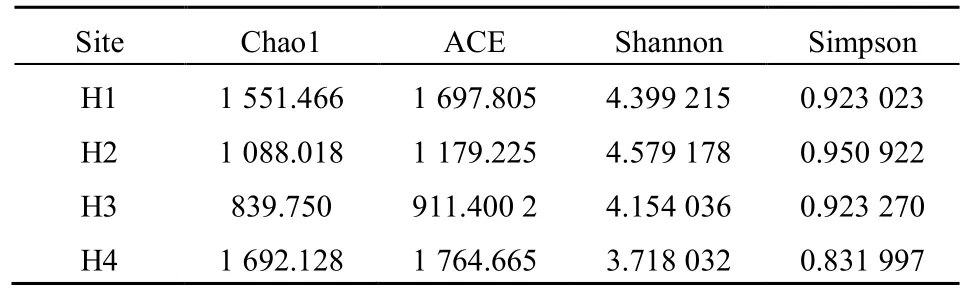
表2 4个采样点的锰污染土高通量测试多样性指数Table 2 Phylotype richness and diversity estimators of the bacterial communities in four sampling points of manganic contaminated soil
2.2.2 微生物群落组成分析
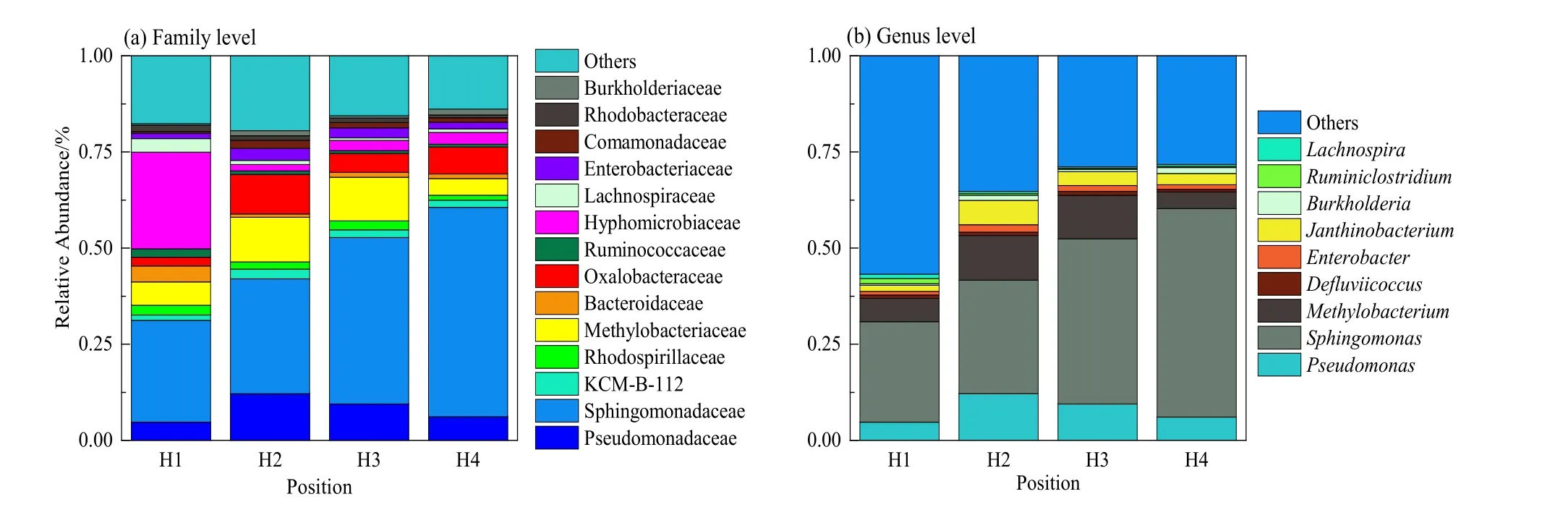
图1 不同深度的锰污染土的群落组成分析Fig. 1 Microbial community structures analysis associated with vertical soil profile of manganic contaminated soils:the phylogenetic distributions
不同程度污染土壤中微生物群落组成分析如图1,图中展示了科和属水平中丰度大于1%的群落组成。微生物结构和丰度分析表明,土壤剖面上不同位置的重金属含量不同致使所含微生物结构、分布和丰度有一定差异性。通过在属水平的细菌多样性比较,能够初步确定各个土壤深度的优势菌属,Sphingomonas在锰化厂重金属污染的样品中的丰度最高,而且分布较广泛,之前有报道称重度污染土壤中Sphingomonas为优势菌(丁淑兰,2015),对 Zn(王慧萍等,2010)、Cd(Sun et al.,2010)、As(田海霞,2014)等具有抗性,能通过细胞吸附作用降低环境重金属浓度(Chen,2012)。其次,Pseudomonas和Methylobacterium含量也较高,有研究者在土壤中接种 Pseudomonas,显著增加了生物有效态Cr、Cd的浓度(Braud et al.,2008);也有研究者以该菌作为生物吸附剂处理含 Cu2+或Ni2+城市废水,使重金属含量降低至微量级(吴晓林等,2004);同时,Pseudomonas对Pb也具有抗性(谭贵娥等,2008)。Methylobacterium 对环境的适应力也很强,被建议应用于修复Cd污染的土(陈美标等,2012);也被认为具备还原土壤中Cr6+的能力,被鉴定为六价铬耐受菌(肖文丹等,2017);能影响土壤中有效态Cd含量,提高植物对Cd的修复作用(邓平香,2016)。在科水平丰度图中,除了以上丰度较高菌所属科,Oxalobacteraceae在H2~H4取样点丰度较高,有报道称草酸杆菌在Cu污染土壤中为优势菌,并能参与土壤反硝化过程(Feng et al.,2012),对降低植物根际铜毒及维持氮素循环具有重要作用(Gaspar et al.,2016)。再者,在H1取样点生物群落中,Hyphomicrobiaceae丰度很高,该菌在有氧条件下,可同时参与 Fe、Mn和氨氮的去除过程(Gaspar et al.,2016),因此生丝微菌在H1中的丰度高可能是由于所处深度含氧量较其他深度高。
2.2.2.1 显著性检验结果
以上微生物群落分析表明,锰化厂污染土壤中的微生物大部分与重金属的脱毒转化过程相关,同时随土壤深度的变化而发生演替。运用SPSS对锰化厂高锰高重金属污染土壤中优势种群与锰等重金属各环境因子进行相关性分析,相关性大小可以反映微生物种群对土壤环境中重金属含量变化敏感程度,相关性越大,则微生物对其变化越敏感(程东祥等,2009)。结果发现,Sphingomonas、未分类Acidithiobacillaceae与多种重金属呈显著负相关,相关性分别为 Mn(r=0.038,0.043;ρ=-0.957,-0.957)、Ni(r=0.017,0.016;ρ=-0.983,-0.984)、Zn(r=0.050,0.050;ρ=-0.950,-0.950)、Cd(r=0.049,0.049;ρ=-0.951,-0.951),说明虽然 Sphingomonas作为锰化厂污染土壤中的优势菌,对重金属重度污染区H1、H2微生物有一定的毒害作用,可通过适当提高土壤中 Sphingomonas的相对丰度来提高土壤抵抗外界重金属污染的能力,从而使重金属胁迫下的土壤保持相对稳定;未分类Acidithiobacillaceae具有脱硫功能,常被用于金属电镀污泥的生物处理过程,可释放污泥中有害重金属元素(Bayat et al.,2010)。Lachnospira、未分类Bacteroidaceae、未分类Ruminococcaceae、未分类Hyphomicrobiaceae与土壤中 Hg含量呈显著负相关,r分别为 0.046、0.002、0.032、0.007,p 分别为-0.954、-0.998、-0.968、-0.993,说明以上微生物随 Hg含量的变化趋于一致,可作为Hg含量的指示性菌种。
2.2.2.2 不同土壤深度微生物群落与重金属典范对应分析
通过对微生物群落进行 DCA排序,决定采用何种排序模型来分析不同采样深度土壤微生物与重金属间的关系。排序后得到排序轴的梯度长度为0.473(<3),因此可采用CCA线性模型进行分析,得到重金属对微生物丰度差异性解释量(见表3)。微生物丰度在第一、第二轴的解释量分别为84.6%和13.5%,前两轴可保留微生物丰度数据总方差的98.1%,且微生物丰度与重金属含量关系的累积解释量为98.1%。由此可知,大部分微生物丰度情况可被本研究所选的9种重金属所解释,且第一轴起决定性作用。
由表4可知,CCA第一排序轴与Ni、Zn、Cd、Pb、Mn的相关性较高,相关系数分别为-0.9693、-0.9517、-0.9197、-0.9140;第二排序轴与 Hg的相关性最高,相关系数为-0.8168;第三排序轴和第四排序轴反映的重金属环境因子不明显,以上结果表明锰化厂污染土壤中影响微生物群落的重金属主要为Ni、Zn、Cd、Pb、Mn、Hg,与显著性分析结果基本一致。
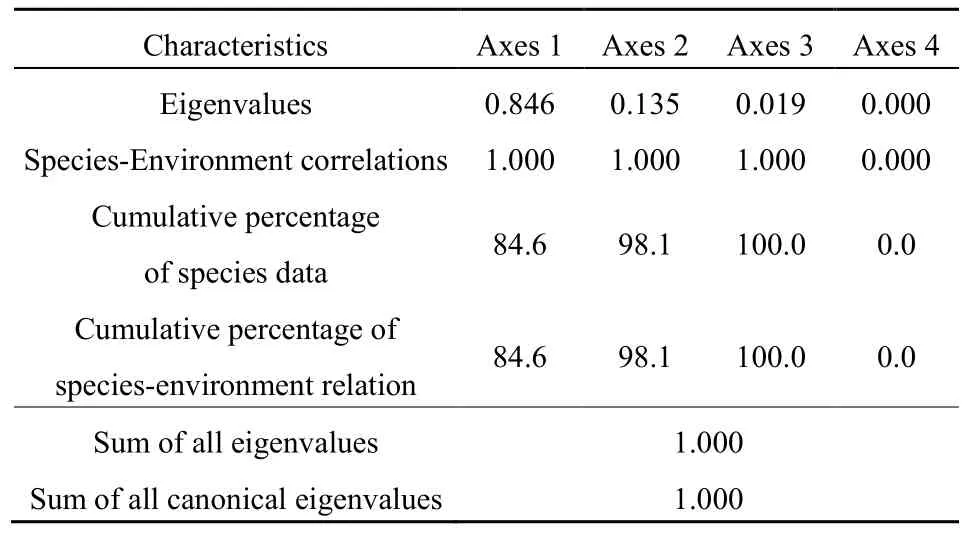
表3 重金属对微生物差异性解释变量典范对应分析Table 3 CCA of heavy metals and microorganisms
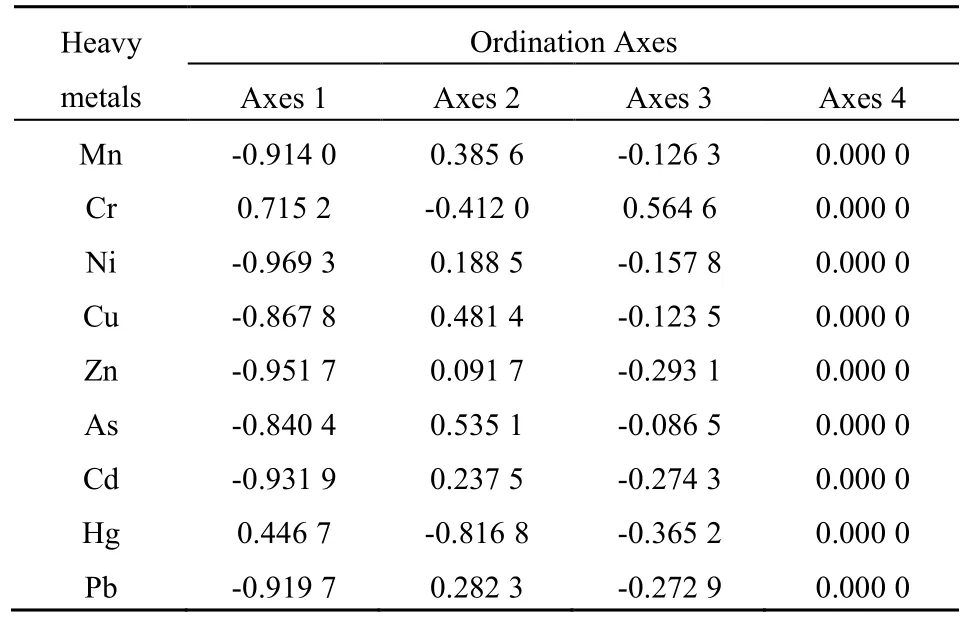
表4 重金属与排序轴的相关性Table 4 Correlationship between soil heavy metals and the environmental axes
CCA将微生物群落和重金属排序表示在一个图上(图 2b),重金属用带箭头的连线表示,箭头的长度代表着该金属与微生物相关程度的大小,三角符号到箭头的垂直距离代表该微生物受重金属影响程度的大小,两个箭头之间的夹角余弦值代表着两种重金属间相关性程度,箭头和排序轴的夹角代表重金属与排序轴相关性。由图2b可知,As、Cu、Mn、Pb、Cd、Ni、Zn箭头间夹角较小,它们彼此之间有很强的关联性,表现出极显著的正相关关系,与其在土壤中的垂直分布情况具有一致的趋势,从而可以判断出它们在土壤中的迁移速率具有相关性,或它们影响土壤微生物群落方面可能表现出协同作用;Sphingomonas和Burkholderia与Cr箭头位于同一象限,说明这两种菌受 Cr的影响较大,且呈正相关,同理,Enterobacter、Pseudomonas和 Janthinobacterium 与Hg正相关,Defluviicoccus和Methylobacterium与As、Cu、Mn、Pb、Cd、Ni、Zn 呈正相关。Enterobacter、Pseudomonas、Janthinobacterium、Methylobacterium 4种菌彼此之间的关联性较好,且它们到重金属箭头的垂直距离相对较短,说明这 4种菌受重金属影响较大,由图2a可知,这4种菌在H3取样点出现的概率大于其他采样点,因此在分离重金属降解菌时可以选择 H3深度下的土壤作为研究对象。通过CCA排序图上重金属箭头的象限分布与采样点关于微生物群落的分析看出,锰化厂土壤属于多种重金属复合污染土壤,H3位置易富集重金属抗性菌,可为寻找重金属污染的“核心微生物”奠定一定的理论与实验基础。
3 结论
以广东省某锰化厂受重金属污染土壤为研究对象,利用高通量测序技术对微生物群落结构及丰度进行分析,以探究不同深度重金属污染下土壤微生物的变化。
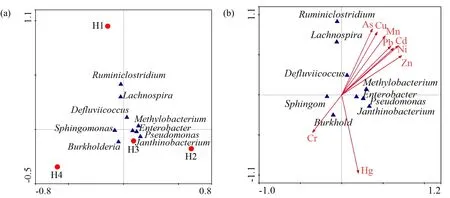
图2 取样点与微生物(a)或微生物与重金属关系(b)的典范对应分析排序图Fig. 2 Biplot of CCA for (a) sampling point and microorganisms; (b) microorganisms and heavy metals
(1)对锰化厂土壤污染评价:各采样点土壤中Mn、Cr、Ni、Cu、Zn、As、Cd、Hg 和 Pb 均超过广东省土壤相应背景值。土壤深度1.5 m以上属于重金属重度污染,其中Cu、Zn、As、Cd、Pb单因子污染指数已达到重度污染;土壤深度 2.0~2.5 m属于重金属轻度污染,其中Cu、As、Cd单因子污染指数为轻度污染,Zn单因子为重度污染;深度3.0~3.5 m属于未污染区。Mn、Ni、Cu、As含量与土壤深度呈负相关,且递减规律显著。
(2)显著性分析结果:Sphingomonas、未分类Acidithiobacillaceae与 Mn、Ni、Zn、Cd呈显著负相关;Lachnospira、未分类Bacteroidaceae、未分类Ruminococcaceae、未分类Hyphomicrobiaceae与土壤中Hg含量呈显著负相关。
(3)CCA分析结果:Sphingomonas和Burkholderia受 Cr的影响较大,且呈正相关;Enterobacter、Pseudomonas和Janthinobacterium与Hg呈正相关,Defluviicoccus和 Methylobacterium与 As、Cu、Mn、Pb、Cd、Ni、Zn呈正相关;Enterobacter、Pseudomonas、Janthinobacterium、Methylobacterium 4种菌彼此之间的关联性较好,且4种菌受重金属影响较大;H3位置较易富集重金属抗性菌。
BAYAT B, SARI B. 2010. Bioleaching of dewatered metal plating sludge by Acidithiobacillus ferrooxidans using shake flask and completely mixed batch reactor [J]. African Journal of Biotechnology, 9(44): 7504-7512.BRAUD A, JEZEQUEL K, BAZOT S. 2008. Enhanced phytoextraction of an agricultural Cr-, Hg-, and Pb-contaminated soil by bioaugmentation with siderophore-producing bacteria [J]. Chemosphere, 74(2): 280-286.CAPORASO J G, KUCZYNSKI J, STOMBAUGH J et al. 2010. QIIME allows analysis of high-throughput community sequencing data [J].Nature Methods, 7(5): 335-336.
CHEN W B. 2012. The Study of Bioremediation on heavy metal of cultured seawater by Sphingomonas sp. XJ2 immobilized Sphingomonas strain[J]. Advanced Materials Research, 347(353): 1436-1441.
FENG S, XIE S, ZHANG X. 2012. Ammonium removal pathways and microbial community in GAC-sand dual media filter in drinking water treatment [J]. Journal of Environmental Science, 24(9): 1587-1593.
GASPAR H, RUI F, GONZALEZ J M. 2016. Influence of temperature and copper on oxalobacteraceae in soil enrichments [J]. Current Microbiology, 72(4): 1-7.
GUPTA S, SINGH D. 2017. Role of genetically modified microorganisms in heavy metal bioremediation [M]. Singapore: Springer: 197-214.
PACWA-PLOCINICZAK M, PLOCINICZAK T, YU D. 2018. Effect of silene vulgarisand heavy metal pollution on soil microbial diversity in long-term contaminated soil [J]. Water Air & Soil Pollution,229(1): 13.
SUN L N, ZHANG Y F, HE L Y. 2010. Genetic diversity and characterization of heavy metal-resistant-endophytic bacteria from two copper-tolerant plant species on copper mine wasteland [J]. Bioresour Technol, 101(2): 501-509.
TAPASE S R, KODAM K M. 2017. Assessment of arsenic oxidation potential of Microvirga indica S-MI1b sp. nov. in heavy metal polluted environment [J]. Chemosphere, 6(195): 1-10.
陈美标, 郭建华, 姚青, 等. 2012. 大宝山矿区耐Cd2+细菌的分离鉴定及其生物学特性[J]. 微生物学通报, 39(12): 1720-1733.
陈欣瑶, 杨惠子, 陈楸健, 等. 2017. 重金属胁迫下不同区域土壤的生态功能稳定性与其微生物群落结构的相关性[J]. 环境化学, 36(2):356-364.
程东祥, 张玉川, 马小凡, 等. 2009. 长春市土壤重金属化学形态与土壤微生物群落结构的关系[J]. 生态环境学报, 18(4): 1279-1285.
邓平香. 2016. Cd污染下两种生态型东南景天内生细菌多样性的比较[D]. 广州: 华南农业大学.
丁淑兰. 2015. 重金属胁迫对刺槐—根瘤菌共生体系的根系分泌物及土壤微生物多样性的影响[D]. 咸阳: 西北农林科技大学.
国家环境保护总局. 1995. 土壤环境质量标准[M]. 北京: 中国标准出版社.
李小林, 颜森, 张小平, 等. 2011. 铅锌矿区重金属污染对微生物数量及放线菌群落结构的影响[J]. 农业环境科学学报, 30(3): 468-475.
刘庆. 2008. 大宝山矿周边污染土壤重金属与微生物剖面分布的研究[D]. 广州: 华南农业大学.
刘云国, 周海舟, 冯宝莹, 等. 2007. 锰污染稻田土壤微生物群落结构和遗传多样性研究[J]. 湖南文理学院学报(自科版), 19(4): 62-65.
谭贵娥, 何池全, 陆晓怡. 2008. 外源微生物强化蓖麻对铅的吸收与积累研究[J]. 农业环境科学学报, 27(1): 82-85.
田海霞. 2014. 抗砷菌的筛选及工业污泥中砷生物转化行为的研究[D].武汉: 华中农业大学.
王慧萍, 谢学辉, 柳建设. 2010. 抗锌细菌 Sphingomonas sp. DX-T3-03分离、鉴定及性质[J]. 微生物学通报, 37(10): 1495-1500.
王振中, 胡觉莲, 张友梅, 等. 1994. 湖南省清水塘工业区重金属污染对土壤动物群落生态影响的研究[J]. 地理科学, 14(1): 64-72.
吴晓林, 王磊, 桂晓琳, 等. 2004. 优化细胞表面组分与结构以提高P.putida 5-x细胞的重金属吸附能力[J]. 工业微生物, 34(4): 23-28.
肖文丹, 叶雪珠, 孙彩霞, 等. 2017. 铬耐性菌对土壤中六价铬的还原作用[J]. 中国环境科学, 37(3): 1120-1129.
熊云武, 林晓燕, 裴东辉, 等. 2017. 锰化厂土壤重金属含量及景观植物吸收特征[J]. 安徽农业科学, 45(11): 63-66.
杨济龙, 祖艳群, 洪常青, 等. 2003. 蔬菜土壤微生物种群数量与土壤重金属含量的关系[J]. 生态环境学报, 12(3): 281-284.
杨金水, 杨扬, 孙良明, 等. 2017. 铅锌矿区土壤真菌响应重金属污染的群落组成变化[J]. 北京大学学报(自然科学版), 53(2): 387-396.
张金莲, 丁疆峰, 卢桂宁, 等. 2015. 广东清远电子垃圾拆解区农田土壤重金属污染评价[J]. 环境科学, 36(7): 2633-2640.
中华人民共和国农业部. 2007. 土壤 pH的测定[M]. 北京: 中国农业出版社.
中华人民共和国环境保护部. 2016. 土壤和沉积物 12种金属元素的测定王水提取-电感耦合等离子体质谱法[M]. 北京: 中国环境科学出版社.

