耐药性癫痫患者外周血铁调节转运体-1基因及蛋白表达的研究
陈海燕, 黄建敏, 李雪斌, 蒙兰青, 郭灿收, 蒋勇明
癫痫是神经系统常见病更是中国目前的重大疾病之一。约70%的癫痫患者经正规的AEDs治疗后能控制发作,但仍有30%患者对各种AEDs不敏感而发生耐药,发展为DRE[1]。DRE之所以治疗困难,最重要的原因是发病机制不清楚,无法根据发病具体途径和关键环节来确定有效治疗方案或研发有效新药物,同时缺乏DRE形成的早期生物学标志物,给临床早期诊断带来很大困难。
研究表明[2],IREG1能将细胞内无毒的三价铁离子转运到细胞外成为有害的二价铁离子,使铁离子代谢异常发生过氧化反应导致神经元死亡或凋亡,参与DRE的发生和发展。这一观点已经得到了以动物模型及癫痫患者脑组织作为标本的实验结果支持。但是目前有关IREG1与DRE的相关性以外周血作为标本的相关研究资料尚未见报道。故本研究通过检测DRE患者外周血中IREG1基因及其蛋白的表达,来探讨IREG1在DRE发病机制中的作用,并探讨其作为生物学标志物的临床意义。
1 资料与方法
1.1 研究对象 2015年5月-2017 年1月在右江民族医学院附属医院神经内科门诊及住院收治的癫痫患者62例。癫痫诊断参照1989年国际抗癫痫联盟制定的癫痫和癫痫综合征的分类标准[3]。排除标准:(1)眩晕、低血糖、晕厥等发作性疾病;(2)有进行性中枢神经系统疾病或占位性病变;(3)有严重心、肝、肾疾病患者及不规律服药和生活不规律的患者;(4)妊娠及哺乳期妇女;(5)精神病或智力障碍患者。DRE诊断标准[1]:按照癫痫发作类型,合理选择并正确使用至少两种耐受性好的AEDs,经足够的疗程及剂量治疗(单药治疗或联合用药),癫痫无发作未达到治疗前最长发作间隔时间的3倍或1 y,即耐药。AEDs控制良好诊断标准:符合2010年ILAE制定的“无发作”标准[1],即选用1~2种一线AEDs正规治疗,癫痫无发作长于3倍治疗前最长发作间期或无发作长于1 y。根据DRE诊断标准分为耐药组和AEDs控制良好组。其中耐药组32例,男17,女15例,年龄7~68岁,平均年龄(30.8±15.6)岁;AEDs控制良好组30例,男12例,女18例,年龄4~62岁,平均年龄(38.8±15.6)岁。选取同期来院体检的34名健康人作为正常组,其中男16例,女18例,年龄14~62岁,平均年龄(34.2±13.5)岁。3组在性别及年龄上的差异,无统计学意义(P>0.05)。所有研究对象在抽血前均签署知情同意书,此研究已通过本单位的伦理委员会批准。
1.2 主要试剂及仪器 血液RNA提取试剂盒(北京百泰克公司),逆转录试剂盒、荧光定量扩增试剂盒(TaKaRa公司),全血蛋白提取试剂盒(上海贝博生物有限公司),抗IREGl一抗(武汉三鹰生物技术有限公司),GAPDH、标记HRP的抗兔二抗、抗鼠二抗(北京中杉金桥生物技术有限公司)等试剂。主要仪器有荧光定量PCR仪(瑞士Roche公司),PTC-200普通梯度PCR仪、蛋白电泳仪、蛋白转膜仪、全自动凝胶成像系统(美国BIO-RAD公司),5424R-台式冷冻离心机(德国Eppendorf公司),微量紫外分光光度计Nono-200(杭州奥盛仪器有限公司)等。
1.3 方 法
1.3.1 实时荧光定量PCR检测外周血中IREG1基因的相对表达量 抽取受检者清晨空腹静脉血3 ml,于EDTA抗凝管中,置-80 ℃保存,以备用。实验过程:(1)引物设计与合成:由TaKaRa生物科技有限公司设计合成,引物序列如下:IREG1上游引物:5’-AAGGGCAAGAATCCCAATTTAACTC-3’;下游引物:5’ -TTCTACATGTAACTTGCCAGGCTGA-3’; 扩增片段大小: 100 bp。GAPDH上游引物:5’-TGATGACATCAAGAAGGTGG-3’;下游引物:5’-TTACTCCTTGGAGGCCATGT -3’;扩增片段大小:138 bp。(2)提取RNA和合成cDNA。每0.7 ml全血中加入裂解液2 ml,参照Trizol试剂盒的方法提取总RNA,紫外分光光度计测定RNA浓度,在冰上操作,按照逆转录试剂盒进行逆转录,反应总体系为20 μl。(3)检测IREG1基因的表达:PCR反应体系为20 μl,其中SYBR Premix混合液10 μl,cDNA2 μl,上下游引物各0.8 μl,加双蒸水至20 μl。放置荧光定量PCR仪中,循环数为40,进行扩增。采用2-△△CT法进行数据的相对定量分析,计算出各样品的目的基因的相对表达量。
1.3.2 蛋白免疫印迹技术检测患者外周血中IREG1蛋白的相对表达量 每500 μl全血样本,加入500 μl蛋白提取液和2 μl蛋白酶抑制剂,充分混匀后离心取上清液内含提取蛋白,BCA法蛋白定量为1.5 mg/ml,加蛋白上样缓冲液,变性后保存。进行聚丙烯酰胺凝胶电泳,每个泳道蛋白上样量为20 μg,电泳结束后进行转膜,将蛋白条带转到PVDF膜上,封闭液封闭,室温摇床震荡1 h,孵育一抗(内参为GADPH,目的抗体为IREG1,稀释比例均为 1∶1000),4 ℃摇床过夜。TBST洗膜,加入二抗(内参为羊抗鼠,目的为羊抗兔,稀释比例均为 1∶5000),常温孵育2 h,TBST洗膜后暗室曝光。使用Image J图像处理软件分析,将IREG1目的条带灰度值与GADPH的灰度值相比,得出IREG1蛋白的相对表达水平。
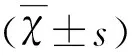
2 结 果
2.1 荧光定量PCR结果 耐药组IREG1 mRNA相对表达量为(1.326±0.102),良好组为(1.001±0.051),正常组为(0.643±0.012),3组间的IREG1基因相对表达水平的差异,具有统计学意义(F=80.5,P=0.000)。经LSD法进行两两比较,耐药组显著高于良好组(P=0.001);而良好组又显著高于正常组(P=0.001)(见表1、表2)。
2.2 蛋白免疫印迹结果 耐药组IREG1蛋白相对表达量为(2.092±0.020),良好组为(1.779±0.084),正常组为(1.399±0.083),3组间的IREG1蛋白相对表达水平的差异,具有统计学意义(F=50.06,P=0.005)。经LSD法进行两两比较,耐药组显著高于良好组(P=0.02);而良好组又显著高于正常组(P=0.012)(见图1、表3、表4)。

表1 3组 IREG l mRNA相对表达量比较

表2 3组IREG1 mRNA相对表达量多重比较

表3 3组IREG1蛋白表达量比较

表4 3组IREG1蛋白表达量多重比较

A:正常组;B:良好组;C:耐药组
3 讨 论
DRE治疗效果差,容易反复发作,甚至出现癫痫持续状态,结果常伴有智能障碍或神经功能缺损症状,致残率和致死率都很高,严重威胁了患者的身体健康和生活质量。因此探讨DRE的发病机制并寻找其耐药性形成的早期生物学标志物,对早期诊断和确定可行有效的治疗方案,避免耐药性的发生具有十分重要的临床意义。
IREG1是在 2000年由Donovan等[4]最先从斑马鱼中克隆出,编码基因SLC40A1位于2号染色体上,其mRNA的5’末端非翻译区含有一个典型的铁反应元件,能够与铁调节蛋白相结合调节铁离子的转运[5]。在脑内铁离子通过参与线粒体氧化反应,DNA、RNA、蛋白质和多种单胺类神经递质的合成等生物代谢过程来维持神经细胞的功能,为此铁离子内环境的稳定是大脑功能稳定的重要因素。研究发现生理剂量的铁蓄积也会诱导基因过度表达发生过氧化反应诱发疾病[6]。IREG1是将铁离子从细胞内转向细胞外最重要的蛋白,病理情况下,IREG1 mRNA和蛋白表达增加,使细胞内大量无毒性的三价铁离子转移到细胞外变为有毒性的亚铁离子,导致铁代谢紊乱,从而诱导多种疾病的发生发展。
实验表明[7]在大鼠额叶皮质、蛛网膜下腔、杏仁体注射铁离子均能导致癫痫发生,均发现海马区有神经元细胞丢失。Guo等[8]通过皮质注射氯化亚铁可成功建立外伤性癫痫动物模型,大鼠注射氯化亚铁后出现癫痫发作,脑电图表现出尖波、棘波、棘慢波等多种形式癫痫样放电,病理结果显示氯化亚铁注射区大量神经元缺失,胶质细胞增生,以及异常的神经元放电环路。实验证实了铁离子导致局部神经细胞过度凋亡,进而导致癫痫的发生。 Zhang等[9]研究对癫痫患者行头部MRI扫描,发现其大脑皮质出现了弥漫性铁沉积,提示异常增加的铁离子通过脂质过氧化途径参与癫痫的发生。国内学者柯贤军等[2]通过基因芯片技术及RT-PCR方法,对35例DRE患者癫痫切除灶中IREG1 mRNA表达的研究,发现IREG1 mRNA在DRE患者术后脑组织中存在高表达,提示IREG1在DRE发病中起着重要的作用。以上研究均证实铁离子代谢异常参与癫痫的形成,IREG1可以通过铁离子代谢途径参与癫痫的发生与发展。但这些研究以动物模型及手术切除的癫痫患者脑组织为标本,因存在取材困难、费用高、创伤大等不足,大大限制了临床研究。因此,本研究通过对DRE患者与AEDs控制良好患者及健康人外周血中IREG1 mRNA及其蛋白表达的检测来研究IREG1与DRE发病的相关性。结果显示IREG1 mRNA及其蛋白在DRE患者外周血中均显著高于AEDs控制良好患者及健康人。从而证实了IREG1参与DRE的发生与发展,并在耐药机制中起重要作用。IREG1参与DRE的发病机制可能是:(1)IREG1将无毒的三价铁离子从细胞内转移到细胞外成为有毒的二价铁离子[10],二价铁离子与过氧化氢、分子氧等作用而产生自由基,过量的自由基攻击脂类、DNA和蛋白质,引起细胞发生严重的氧化损伤,诱导组织损伤[11]。(2)蓄积的二价铁离子通过诱导炎性细胞因子生成的途径引发神经元的损伤,如催化脂质过氧化花生四烯酸释放、前列腺素的启动和白三烯级联作用等引起神经元变性、死亡[12]。(3)细胞外过多的二价铁离子还可以通过诱导凋亡相关蛋白生成的途径进一步引发神经元的损伤,如激活细胞外信号传导激酶(ERK),影响骨架蛋白tau的磷酸化[13],导致神经元形态改变及突触重构,诱导苔藓纤维芽生,形成异常兴奋性网络,促进DRE的发生和发展。(4)IREG1参与DRE的发病还可能与铜蓝蛋白 (ceruloplasmin,CP)的表达异常有关。CP可氧化二价铁离子成为三价铁离子,只有三价铁离子才能与转铁蛋白结合被脑组织摄取,当缺乏CP,IREG1单独无法发挥血脑屏障铁转运的功能[14]。Zou X等[15]的实验发现在皮下注射铁螯合剂(去铁胺),可有效控制氯化亚铁诱导癫痫模型大鼠癫痫症状发作,显著降低癫痫模型大鼠大脑皮质神经元线粒体内的铁沉积,减轻线粒体氧化应激损伤的程度,减少神经元死亡。提示调控铁代谢紊乱可有效控制癫痫发作,即调控IREG1过度表达,有望成为DRE治疗新药开发的一个新靶点。
综上所述,本项目研究发现IREG1基因及其蛋白在DRE患者外周血中表达明显增加,推测正是这种高表达才使细胞内大量无毒性的三价铁离子转移到细胞外变为有毒性的亚铁离子,导致铁代谢紊乱发生过氧化反应从而诱导癫痫的发生与发展,同时提示IREG1可作为预测癫痫耐药的外周生物学指标之一。
[参考文献]
[1]Kwan P,Arzimanoglou A,Berg AT,et al.Definition of drug resistant epilepsy:consensus proposal by the ad hoc Task Force of the ILAE Commission on Therapeutic Strategies[J].Epilepsia,2010,51(6):1069-1077.
[2]柯贤军,郭珍立,王学峰,等.铁调节转运体1 mRNA与耐药性癫痫[J].中国临床神经外科杂志,2007,12(6):354-357.
[3]Proposal for revised classification of epilepsies and epileptic syndromes.Commission on Classification and Terminology of the International League Against Epilepsy[J].Epilepsia,1989,30(4):389-399.
[4]Donovan A,Brownlie A,Zhou Y,et al.Positional cloning of zebrafish ferroportin1 identifies a conserved vertebrate iron exporter[J].Nature,2000,403(6771):776-781.
[5]Donovan A,Lima CA,Pinkus JL,et al.The iron exporter ferroportin/Slc40a1 is essential for iron homeostasis[J].Cell Metab,2005,1(3):191-200.
[6]Alexandrov PN,Zhao Y,Pogue AI,et al.Synergistic effects of iron and aluminum on stress-related gene expression in primary human neural cells[J].J Alzheimers Dis,2005,8(2):117-127.
[7]杜 鹏,木依提,栾新平,等.不同部位诱发癫痫动物模型对比研究[J].中风与神经疾病杂志,2013,30(6):542-544.
[8]郭燕春,李 沐,谢泽宇,等.皮质注射氯化亚铁建立外伤性癫痫动物模型致痫机制的探讨[J].神经损伤与功能重建,2015,10(2):113-115.
[9]Zhang Z,Liao W,Bernhardt B,et al.Brain iron redistribution in mesial temporal lobe epilepsy:a susceptibility-weighted magnetic resonance imaging study[J].BMC Neurosci,2014,15:117.
[10]Duck KA,Connor JR.Iron uptake and transport across physiological barriers[J].Biometals,2016,29(4):573-591.
[11]Gonzalez-Cortes C,Salinas-Lara C,Gomez-Lopez MA,et al.Iron porphyrinate Fe(TPPS) reduces brain cell damage in rats intrastriatally lesioned by quinolinate[J].Neurotoxicol Teratol,2008,30(6):510-519.
[12]Wang XS,Ong WY,Connor JR.Increase in ferric and ferrous iron in the rat hippocampus with time after kainate-induced excitotoxic injury[J].Exp Brain Res,2002,143(2):137-148.
[13]Lu LN,Qian ZM,Wu KC,et al.Expression of iron transporters and pathological hallmarks of Parkinson’s and Alzheimer’s diseases in the brain of young,adult,and aged rats[J].Mol Neurobiol,2017,54(7):5213-5224.
[14]Jeong SY,David S.Glycosylphosphatidylinositol-anchored ceruloplasmin is required for iron efflux from cells in the central nervous system[J].J Biol Chem,2003,278(29):27144-27148.
[15]Zou X,Jiang S,Wu Z,et al.Effectiveness of deferoxamine on ferric chloride-induced epilepsy in rats[J].Brain Res,2017,1658:25-30.

