24例成人发作性睡病伴快速眼动睡眠期行为异常患者临床及多导睡眠图分析
张 晓, 刘 畅, 孙海燕, 赵丹阳, 潘 雪, 王 赞, 吕玉丹
发作性睡病是一种慢性睡眠障碍疾病,临床表现为睡眠-觉醒节律不稳定、发作性猝倒、睡瘫、入睡前或醒前幻觉[1,2]。发病高峰为儿童及青少年,患者白天难以控制的多睡、注意力不集中、记忆力下降,严重影响学习和生活质量。发作性睡病患者常合并呼吸暂停-低通气等情况、REM期睡眠行为异常(REM Behavior Disorders,RBD)[3]、周期性腿动等夜间睡眠障碍。临床上常常因为症状不典型容易漏诊,症状叠加而误诊。我们收集我中心诊治的24例成年起病的发作性睡病合并RBD的患者,对其临床及多导睡眠图特征进行分析,以提高临床医师对此类睡眠障碍疾病的认识。
1 资料和方法
1.1 一般资料 2015年12月-2017年2月就诊于吉林大学第一医院神经内科的诊断为发作性睡病同时合并RBD的患者24例,其中男21例,女3例,发病年龄18~69岁。24例患者均因白天不能控制的过度嗜睡就诊,详细进行病史采集后,5例存在夜间睡眠中打鼾、憋醒;3例存在夜间睡眠中拍打同床人;2人曾经有梦境扮演经历,所有患者均签署知情同意书。发作性睡病诊断标(ICSD-2):(1)白天过度嗜睡症状至少持续3个月;(2)伴或不伴猝倒发作(猝倒发作为强烈情绪变化诱发的短暂的肌张力下降);(3)MSLT:平均睡眠潜伏时间小于等于8 min,且大于等于两次快速眼动睡眠起始的睡眠(sleep onset rapid eye movement,SOREM),MSLT的前夜行PSG监测,且保证大于6 h睡眠期;(4)无其他睡眠障碍、内科或神经系统疾病、药物或物质滥用能解释的嗜睡症状。RBD诊断标准:(1)REM睡眠期肌张力迟缓缺失:持续或多发短暂的颏肌电增高,或多发时相性颏肌电或(上肢或下肢)颤搐;(2)存在睡眠相关性损伤行为史或PSG监测到REM期异常行为;(3)REM睡眠期的异常行为同期EEG无癫痫样活动,也不是其他REM期的异态睡眠;(4)不能用其他睡眠疾病、内科或神经精神疾病解释。
1.2 方法 所有患者行PSG监测,采用Somnoscreen plus eeg32多导睡眠监测仪采集数据,脑电按照国际10-20系统安放(F3、F4、C3 、C4、O1、O2)电极,参考电极安放在双侧乳突,同时记录眼电、颏肌电、腿动、血氧饱和度、热敏、鼾声、体位等信号,次日行5次多次睡眠潜伏期试验。按照AASM 2.3版本睡眠分期及相关事件判读标准分析数据,对相关指标及监测过程中的异常情况归纳总结。
2 结 果
2.1 临床特点 白天不能控制的过度嗜睡24例(100%);睡眠相关性幻觉6例(25%)其中4例为睡前幻视、2例为醒后幻视;5例存在睡眠瘫痪(18.75%);3例伴随猝倒发作(12.5%);5例存在夜间睡眠中打鼾、憋醒(18.75%); 3例存在夜间睡眠中拍打同床人(12.5%);2人曾经有梦境扮演经历(6.25%)。
2.2 多导睡眠图分析 目前国际上普遍使用的是Rechtschaffen和Kales提出的睡眠分期规则(1968)。睡眠分为觉醒期、非快速眼动睡眠期(NREM)和快速眼动睡眠期(REM)。其中NREM又可分为Ⅰ期、Ⅱ期、Ⅲ期Ⅳ期。(1)清醒期:一般为连续的α节律,同时伴有慢眼动;(2)非快速眼动睡眠期(NREM) Ⅰ期:α波节律性变差,频率亦有减慢,可见顶尖波,下劾肌电维持一定肌电活动;(3)NREM期II期:可见到K-综合波和纺锤波,肌电进一步减弱、眼动减弱或消失;(4)NREM期Ⅲ-Ⅳ期:深睡期,脑波变慢、演变为δ波;(5)REM期:脑电图上低幅混合频率、可见锯齿波,肌张力消失。
通过对24例睡眠结构分析结果如下:N1期睡眠时间增加24例(100%);N2期睡眠时间减少18例(75%); N3期睡眠时间减少或消失18例(75%);12例REM睡眠时间延长且片段化(50%);9例(37.5%)存在呼吸暂停-低通气情况(AHI>5次/时);15例(62.5%)存在周期性肢体运动(根据ICSD-2分级标准PMLS指数>15次/时);24例伴随颏肌电持续或间断增高(100%)(见图1)。其中持续性颏肌电增高者10例,间断性颏肌电增高者14例。MSLT分析:24例平均睡眠潜伏时间均小于8 min,同时大于或等于两次REM起始睡眠(100%)(见图2)。
2.3 同步视频分析 同步视频监测过程中,5例患者监测到睡瘫情况,即在刚睡着或刚醒来的时候,意识清醒,但身体无法动弹,他人轻推后缓解。3例患者在大笑、情绪激动时出现突然猝倒发作。15例患者监测到REM睡眠期异常行为:颜面部或肢体异常活动者12例(见图3),表现为一系列动作如,搓手指、打手势、抓摸被子、摇头、躯干扭动、挥拳、拍打动作、踢腿;表现为发声者3例,如说话、呻吟、喊叫。
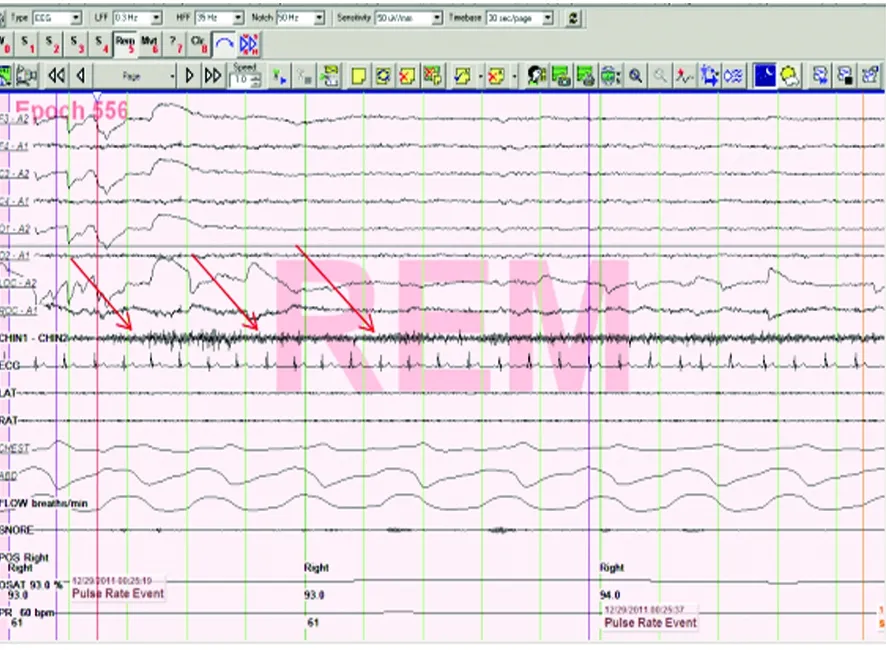
图1 RBD患者多导睡眠监测显示持续性颏肌电增高

图2 多导睡眠监测显示平均睡眠潜伏时间均小于8 min,3次REM起始睡眠起始

图3 起始于REM期的睡眠行为异常的导睡眠监测
3 讨 论
发作性睡病常发生在儿童及青少年,临床表现为四联症:(1)白天难以抑制的多睡,可发生在日常活动时,伴有注意力不集中、疲惫等,小睡可暂时缓解嗜睡;(2)猝倒:发作性睡病可伴猝倒发作,多由情绪激动诱发,肌张力突然减低或消失而倒地,持续时间数秒钟至数分钟,发作过程意识清楚,伴猝倒发作的患者大部分脑脊液下丘脑分泌素-1水平降低;(3)睡瘫,刚入睡或刚睡醒时意识已清醒,但部分或全身瘫痪;(4)睡眠相关性幻觉:入睡前或刚睡醒时幻觉,幻视常见,患者主诉可看见陌生人、伴有鲜明的色彩等。
除了发作性睡病的典型四联症外,可合并其他临床表现包括:(1)肥胖、体重指数增加引起阻塞性睡眠呼吸暂停低通气综合征(Obstructive Sleep Apnea Hypopnea Syndrome OSAHS)的发生,患者因夜间频繁觉醒、睡眠质量差,次日可出现继发性嗜睡。因此主诉为“白天嗜睡”的患者,需排除OSAHS继发性嗜睡的可能。当OSAHS得以充分治疗及改善症状后,如患者仍存在白天过度嗜睡,考虑发作性睡病的可能,应行多次睡眠潜伏时间试验;(2)周期性肢体运动:发作性睡病患者常合并睡眠中周期性肢体运动,如本组收集病例中62.5%存在周期性肢体运动,且主要发生于REM期。频繁的周期性腿动,引起觉醒次数增加,睡眠片段化,导致白天继发性嗜睡。值得注意的是,若REM期周期性腿动指数较高时,应注意是否合并RBD;(3)RBD,高发年龄在50岁左右,RBD是一种REM期睡眠行为障碍,多见于神经系统退行性变,如帕金森病、痴呆、多系统萎缩等,继发于脑干病变、α突触核蛋白病等[4,5]。临床表现为REM期肌张力迟缓缺失、暴力性质的异常运动、梦境扮演等,醒后对梦境可回忆,整夜视频PSG对RBD 的诊断意义很大。
综上,发作性睡病合并RBD从疾病发生机制上也具有相关性。发作性睡病的产生主要由于下丘脑分泌素(Hypocretin)的分泌异常及REM期的异常闯入相关。人类中Hypocretin神经元丢失造成了下丘脑分泌素缺乏,与发作性睡病密切相关,既往研究表明,在伴有猝倒的发作性睡病患者中,下丘脑分泌素缺乏的患者占90%以上[6~8]。Hypocretin神经元主要位于下丘脑外侧的穹窿周区,广泛投射至大脑皮质、丘脑、下丘脑、脑干、蓝斑及嗅球、结节乳头核、中缝核、延髓网状结构,尤其在蓝斑投射比较密集。相应地调控去甲肾上腺素、组胺、5-羟色胺、多巴胺的分泌。在睡眠调控中,多巴胺和组胺维持觉醒状态,去甲肾上腺和5-羟色胺调节进入快速动眼睡眠期的时相[6,9]。下丘脑分泌素通过G蛋白偶联受体激活它所支配的单胺神经递质系统,其缺乏会导致以上系统的功能紊乱,进而导致快速动眼睡眠时相异常和过度睡眠[10]。此外,Ouvet等[6,10]研究发现,当电损毁或细胞损毁猫的脑桥背外侧部可抑制REM睡眠的产生[11,12,9],且猫的桥脑被盖部蓝斑旁核是参与形成REM睡眠的重要部位。同样在人类中,控制REM期的“开关”位于脑桥被盖部,其接受下丘脑Hcrt神经元的纤维投射。“关”主要与单胺能神经元较多的蓝斑相关,去甲肾上腺素能神经元属于此类;“开”主要与胆碱能神经元较多的蓝斑下核相关,γ- 氨基丁酸(γ-aminobutyric acid,GABA)属于此类。脑桥蓝斑核及脑桥抑制区与肌肉张力的调控密切相关,刺激蓝斑核使肌张力增高,刺激脑桥抑制区则使REM期肌张力迟缓。故脑桥蓝斑核-脑桥抑制区的功能异常或神经递质异常(如单胺神经递质、胆碱能神经递质)均可引起RBD的产生。由此可见,脑桥、下丘脑及Hcrt神经元是控制发作性睡病、RBD的关键核团及神经元,发作性睡病患者Hcrt神经元减少,Hypocretin下降,降低了脑桥抑制区对REM期肌张力降低的抑制作用,因此发生了RBD[13,14]。此外,一些发作性睡病伴猝倒者服用抗抑郁药(如三环类或选择性5-羟色胺再摄取抑制剂)治疗猝倒发作,同时会导致RBD的产生。
综上所述,成人发作性睡病患者常合并睡眠呼吸暂停-低通气综合征,继发性嗜睡症状需与原发性嗜睡相鉴别,应对原发疾病治疗后复查PSG明确;发作性睡病者常合并RBD,此类患者需行PSG及MSLT,计算平均睡眠潜伏期及REM睡眠潜伏期,帮助诊断发作性睡病,同时异常动作并非每夜都发生,PSG同步视频可发现微小的异常动作或肌电活动,帮助疾病诊断RBD;发作性睡病常合并周期性肢体运动,且分布在REM睡眠期较多时,需注意是否同时存在RBD可能。
[参考文献]
[1]Dauvilliers Y,ArnulfI,Mignot E.Narcolepsy with cataplexy[J].Lancet,2007,369:499-511.
[2]Colombo PP,Zaccagni M,Ubertini C,et al .Narcolepsy[J].Riv Psichiatr,2009 ,44(1):15-27.
[3]Wierzbicka A,Wichniak A,Waliniowska E,et al.REM sleepbehaviour disorder in narcolepsy[J].Neurol Neurochir Pol,2009,43(5):421-427.
[4]Miyamoto T,Miyamoto M,Iwanami M,et al.Idiopathic REM sleep behavior disorder:implications for the pathogenesis of Lewy body diseases[J].Parkinsons Dis,2011,2011:91286.
[5]周明珠,刘振国,吴佳英,等.帕金森病患者快速眼球运动睡眠行为障碍的回顾分析及前瞻性研究[J].中华神经科杂志,2010,43:858-862.
[6]KrahnLE,Pankratz VS,Oliver L,et al.Hypocretin (orexin) levels in cerebrospinal fluid of patients with narcolepsy:relationship tocataplexyand HLADQB 10602 status[J].Sleep,2002,25:733-736.
[7]Hong S,Lin L,Jeong J,et al.A study of the diagnos ticutility of HLA typing,CSF Hypocretin 1 measurements,and MSLT testing for the diagnosis of narcolepsy in 163 Koreanpatients with unexplained excessive day time sleepiness[J].Sleep,2006,29:1429-1438.
[8]Thannickal TC,Moore RY,Nienhuis R,et al.Reduced number of hypocretin neurons in human narcolepsy[J].Neuron,2000,27(3):469-474.
[9]Sutcliffe JG,deLecea L.The hypocretins:Excitatory neuromodulatory peptides for multiple homeostatic systems,including sleep and feeding[J].J Neurosci Res,2000,62(2):161-168.
[10]Thorpy M.Therapeutic advances innarcolepsy[J].Sleep Med,2007,8:427-440.
[11]Hungs M,Fan J,Lin L,et al.Identification and functionalanalysis of mutations in the hypocretin(orexin)genes of narcoleptic canines[J].Genome Res,2001,11:531-539.
[12]Willie JT,CHemelli RM,Sinton CM,et al.Distinctnarcolepsy syndromes in Orexinnull micemolecu largenetic dissection of NonREM and REM sleepregulatory processes[J].Neuron,2003,38:715-730.
[13]Knudsen S,Gammeltoft S,Jennum PJ.Rapid eye movement sleep behavior disorder in patients with narcolepsy is associated with hypocretin-1 defciency[J].Brain,2010,2(133):568-579.
[14]Kiyashchenko LI,Mileykovskiyc BY,Lai YY,et al.Increased and decreased muscle tone with orexin (hypocretin) microinjections in the locus coeruleus and pontine inhibitory area[J].Neurophysio,2001,85(2):2008-2016.
文章编号:1003-2754(2018)06-0545-03中图分类号:R743.4
治疗

