基于基因芯片技术研究氯化锂-匹罗卡品致痫小鼠海马组织miRNA-187的表达及GO和KEGG分析
吴 琼, 汪顺贵, 郭雪峰, 李华琼, 陈爱玲, 刁丽梅2,, 仇小强
癫痫(Epilepsy,EP)是由于大脑神经元异常放电引起的短暂性中枢神经系统功能失常的神经系统疾病,表现为突发意识丧失和全身强直抽搐。世界卫生组织报告目前全世界约有5000万癫痫患者,其中约90%患者来自发展中国家[1]。我国约有900万癫痫患者,每年新发40~70万例,对社会、家庭构成了巨大的负担[2]。生物信息学是近年来随着计算机信息处理技术与人类基因组工程等生物医学研究的快速进展而发展起来的新学科[3],其中基因本体(Gene Ontology,GO)是一个系统化注释基因及基因产物功能的规范化科学分类体系。京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)是一个整合了基因组、化学和系统功能信息的数据库,把从已经完整测序的基因组中得到的基因目录与更高级别的细胞、物种和生态系统水平的系统功能关联起来。生物信息学从基因芯片数据中挖掘有用信息,利用网络数据库对结果进行归纳整理,系统分析海量基因数据中可能涉及的最为相关的生物学功能。本课题组采用基因芯片技术挖掘差异基因,并对差异基因进行生物信息学分析,研究其在癫痫中可能参与的调控机制,为下一步实验研究提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性昆明小鼠100只,清洁级,约25~30 g。其中80只用于实验,另外20只用于替换实验中造模失败的小鼠。昆明小鼠由广西医科大学动物实验中心购买。
1.1.2 实验试剂 氯化锂(中国医药集团上海试剂公司)、盐酸匹罗卡品(美国Sigma公司)、硫酸阿托品注射液(郑州铃锐制药有限公司)、水合氯醛(青岛宇龙海藻有限公司)、0.9%氯化钠注射液(北京双鹤药业有限公司)、Agilent RNA 6000 Nano Kit(美国Agilent公司)、FlashTag Biotin HSR RNA Labeing Kit(美国Affymetrix公司)、GeneChip Hybridizatin Wash and Stain Kit(美国Affymetrix公司)、AxyPrep总RNA提取试剂盒(美国Axygent公司)、miRNAs RT-PCR Quantitation Kit(上海吉玛制药技术有限公司)、反转录试剂盒及引物(上海吉玛制药技术有限公司),Mmu-miRNA-187引物序列:上游引物序列CTTCTTCGTGTCTTGTGTTGCAG,下游引物序列TATGGTTGTTCTCGACTCCTTCAC。内参U6 snRNA引物序列:上游引物序列ATTGGAACGATACAGAGAAGATT,下游引物序列GGAACGCTTCACGAATTTG。
1.1.3 实验仪器 Thremo Nanodrop 2000(美国 Thremo公司)、Aglient 2100 Bioanalyzer(美国Agilent公司)、GeneChip Hybridization Oven 645(美国Affymetrix公司)、GeneChip Fluidics Station 450(美国Affymetrix公司)、GeneChip Scanner 3000(美国Affymetrix公司)、GeneAmp PCR System 9700(美国 Applied Biosystems公司)、StepOnePlus Real-Time PCR System(美国 Applied Biosystems公司)。
1.1.4 靶基因预测工具 (1)TargetScan 7.1版在线预测网站,网址为http://www.targetscan.org/,是预测miRNA靶基因假阳性率较低的软件,TargetScan通过搜索与每个miRNA的种子区域相匹配的保守8 mer,7 mer和6 mer位点的存在来预测miRNA的生物靶点[4];(2)miRBase在线预测网站,网址为http://mirdb.org/,可提供miRNA注释、基因组坐标以及预测和验证的miRNA目标位点数据库,并可以按顺序,关键字,参考文献和组织表达搜索条目;(3)rna22在线预测工具,网址为https://cm.jefferson.edu/rna22/,由悉尼大学医学院计算医学中心创建,rna22提出一种鉴定miRNA结合位点及相应异源双链的方法进行miRNA靶基因的预测。
1.1.5 筛选靶基因的标准 (1)miRNA5’端“种子序列”与靶基因3’端UTR序列的完全互补配对;(2)miRNA5’端结合的mRNA3’端UTR的位点数目;(3)miRNA与mRNA结合位点的不同类型;(4)miRNA与mRNA结合位点上下游碱基组成;(5)基于mRNA3’端UTR高度保守序列优先排序等[5]。
1.1.6 GO分析和KEGG分析工具 DAVID 6.8版(The Database for Annotation,Visualization and Integrated Discovery)是一个在线综合分析工具,网址https://david.ncifcrf.gov/。
1.2 方法
1.2.1 氯化锂-匹罗卡品致痫小鼠模型制备 采用氯化锂-匹罗卡品的化学点燃方法制作癫痫小鼠模型:昆明小鼠腹腔注射氯化锂(127 mg/kg),18~24 h后注射阿托品1 mg/kg,30 min后腹腔注射匹罗卡品(10 mg/kg)。如未出现癫痫持续状态,则每隔 30 min 继续腹腔注射匹罗卡品(10 mg/kg),直至小鼠出现癫痫持续状态后停止注射。待癫痫持续状态出现60 min,腹腔注射10% 的水合氯醛(300 mg/kg)终止发作。每隔2 d,进行上述造模实验一次,共进行5次,注射后观察小鼠行为变化60 min,每次达Ⅳ级以上发作为成功的癫痫发作模型,3次未达到Ⅳ级以上发作的弃用。
1.2.2 实验动物癫痫发作Racine分级[6]0级:无发作反应;Ⅰ级:节律性口角、耳或面部肌肉抽搐阵挛;Ⅱ级:点头并伴随更严重的面部肌肉抽动阵挛;Ⅲ级:出现前肢阵挛但不伴随直立;Ⅳ级:双侧后肢表现为站立,双侧前肢表现为抽搐;Ⅴ级:四肢强直、抽搐、角弓反张。癫痫持续状态:出现连续Ⅵ级以上发作,时间超过 30 min。
1.2.3 实验动物分组及干预措施 将制备成功的癫痫小鼠模型按随机数字表法随机分为4组:造模组 (A)、空白对照组(B)、造模组(C)、空白对照组(D),每组各20只。(1)A组和B组取小鼠海马组织用于基因芯片实验,筛选癫痫组和空白对照组差异基因;(2)C组和D组取小鼠海马组织用于q-PCR实验,验证基因芯片实验中的差异基因的表达。
1.2.4 基因芯片实验 (1)取30 mg小鼠海马组织,采用Trizol法进行样品的总RNA抽提纯化,经NanoDrop 2000仪器和Agilent Bioanalyzer 2100仪器质检;(2)将提取的总RNA,由RNA合成双链cDNA,用FlashTag Biotin HSR RNA Labeing Kit试剂盒把荧光染料Cy5和Cy3接dUTP 上;(3)在GeneChip Hybridization Oven 645仪器中将已片段化的cRNA 在GeneChip Fluidics Station 450仪器中洗脱和染色探针阵列;(4)用GeneChip Scanner 3000扫描仪扫描杂交后芯片,然后提取数据进行计算。根据实验设计的要求,筛选出有显著差异的基因。
1.2.5 q-PCR实验 (1)取30 mg小鼠海马组织,采用Trizol法进行样品的总RNA抽提,经NanoDrop 2000和Agilent Bioanalyzer 2100质检;(2)取上步提取的总RNA加入miRNA-187和内参基因U6引物混合物逆转录反应体系,并放入ABI GeneAmp PCR System 9700仪器进行逆转录,制备成cDNA;(3)取上步制备的cDNA 加入miRNA-187 Primer set 制成定量PCR反应体系。同法制备内参基因U6的定量PCR反应体系。放入ABI StepOnePlus real-Time PCR System仪器中进行实时定量分析。
1.2.6 靶基因预测 采用靶基因预测工具TargetScan 7.1版在线预测软件,miRBase在线预测网站、rna22在线预测工具。选择物种为小鼠,输入miRNA-187运行后导出靶基因预测结果,并把3个靶基因预测工具预测出的靶基因取交集。
1.2.7 GO分析和KEGG分析 利用DAVID数据库,以小鼠基因组为背景对照,利用“Functional AnnotationChart” 功能模块下的基因本体论对差异表达基因的分析,将差异表达基因按功能分为3大类:生物学过程、细胞组分和分子功能3类,并利用KEGG分析功能进行通路分析。
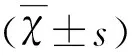
2 结 果
2.1 筛选出差异基因 根据实验设计的要求,计算两两实验样本间的荧光讯号log2比值及P-value,筛选|FC|≥ 1.5。最终筛选出下调miRNA共18个:miRNA-193b、miRNA-187、miRNA-365、miRNA-125b、miRNA-543、miRNA-495、miRNA-6995、miRNA-383、miRNA-345、miRNA-1982、miRNA-31、miRNA-7668、miRNA-134、miRNA-193b、miRNA-6360、miRNA-431、miRNA-6540、miRNA-204,上调miRNA共10个:miRNA-669l、miRNA-468、miRNA-1946a、miRNA-7004、miRNA-5620、miRNA-1941、miRNA-3470a、miRNA-6933、miRNA-1946b、miRNA-466c。在此基础上对差异表达miRNA进行聚类分析(见图1),每个小方格表示每个基因,其颜色表示该基因表达量大小,表达量越大颜色越深,红色为上调,绿色为下调。
2.2 q-PCR验证miRNA-187表达 通过查阅相关文献及基因芯片的筛选结果[7~9]。本课题组选择miRNA-187作为目标基因,并运用q-PCR实验验证基因芯片miRNA-187表达,结果:癫痫造模组(C)中小鼠海马组织的miRNA-187的相对表达量低于空白对照组(D)(P<0.05),差异有统计学意义。结果表明miRNA-187的表达趋势在基因芯片和q-PCR两种检测方法中表现出一致性,说明基因芯片数据具有生物学意义上的可重复性,结果是可信的(见图2)。
2.3 miRNA-187靶基因预测结果 利用TargetScan预测靶基因4133个,miRBase在线预测网站预测靶基因251个、rna22在线预测工具预测靶基因6986个,对3种软件预测出的靶基因取交集得到107个共同的靶基因。
2.4 miRNA-187靶基因GO分析结果 通过DAVID综合分析工具进行GO富集分析,选取显著差异的靶基因进行注释(P< 0.05),主要富集于19个基因功能,按生物学过程、细胞组分和分子功能3类基因功能分类(见表1)。
2.5 miRNA-187靶基因KEGG富集分析结果 KEGG通路分析显示miRNA-187靶基因主要富集在在7条通路中(见表2)。
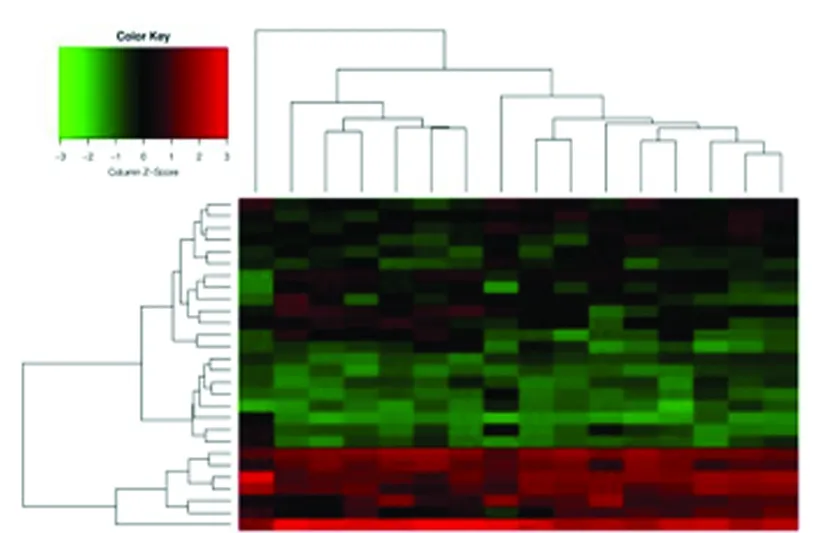
图1 差异miRNA表达趋势分析

造模组(C)与空白对照组(D)比较差异有统计学意义*P=0.02
图2 造模组(C)和空白对照组(D)miRNA-187的表达量

表1 miRNA-187靶基因GO富集分析结果

表2 miRNA-187靶基因KEGG通路分析结果
3 讨 论
通过对miRNA-187靶基因的功能注释及GO富集,发现miRNA-187靶基因富集在与调节神经细胞突触可塑性、神经细胞轴突髓鞘形成等相关的基因功能上。现有研究已表明[7,8],神经元细胞重塑、突触联系重建以及神经胶质纤维细胞增生可以导致异常兴奋性突触环路,引起癫痫反复发作。Haenisch等[9]研究也发现miRNA-187在大鼠癫痫模型的慢性期表达增加,通过介导KCNK10/TREK-2钾离子通道在大鼠癫痫模型中发挥抑制神经元异常放电的作用。miRNA-187所调控的靶基因富集与此相关,综合GO分析的结果可以推测,miRNA-187可能是通过调控神经细胞突触可塑性、神经细胞轴突髓鞘形成影响癫痫的发生发展过程。
在KEGG通路分析中提示miRNA-187靶基因富集于Wnt信号通路的包括:CSNK1A1、TBL1XR1、MAPK8、AXIN2、CTNNB1。Wnt 信号通路作为多细胞真核生物中的重要信号通路,不仅参与神经干细胞的增殖、分化、轴突形成等过程,还调控突触发生、突触囊泡循环等生理过程。最近的一些研究发现,Wnt 的部分配体Wnt3a、GSK-3β在小鼠海马神经元的突触可塑性方面发挥着一定作用[10,11]。Wnt7a参与成熟海马神经元的突触囊泡循环和突触传递过程[12]。Rubio等[13]研究发现电刺激点燃癫痫模型激活Wnt /β-catenin通路,Theilhaber等[14]观察到在低氧性癫痫发作中Wnt/β-catenin通路基因的表达增加。Qu等[15]发现了Wnt3a /β-catenin信号通路作为异常神经发生与海马组织内基础重构之间的联系。Wnt信号通路中关键调节因子β-catenin、Wnt3a和cyclin D1的表达水平在注射红藻氨酸诱导的急性癫痫中上调,Wnt信号通路被激活,促进异常神经发生。异常神经发生会引起海马硬化并伴随大量神经元丢失和严重神经胶质增生,引起颞叶癫痫。而通过敲减β-catenin阻断由红藻氨酸注射诱导的Wnt信号,可减弱的异常神经发生,提示Wnt/β-catenin信号通路可调控海马神经元发生,抑制海马神经元异常放电环路重塑,减少癫痫的发作。Huang等[16]研究发现由于Wnt/β-catenin通路的失调,在癫痫急性期海马神经发生显着增加,而在癫痫的慢性阶段神经发生减少,Dkk-1、GSK-3b和β-catenin作为调节Wnt信号通路的关键,成为潜在研制治疗癫痫活性的药物的重要靶点。
越来越多的证据表明神经炎症在癫痫持续状态的发病机制中起着关键作用。Srivastava等[17]通过Meta分析发现,在癫痫发生期间失调的miRNA的靶基因功能多富集在与神经炎症有关的分子过程。Alsharafi等[18]实验发现miRNA-187在颞叶癫痫动物模型和慢性颞叶癫痫患者的海马组织中显着降低,miRNA-187的这种下降与IL-10的表达水平成反比,miRNA-187在潜伏期处于最高水平并且在IL-10最大的慢性期下降。在癫痫持续状态后,使用miRNA-187的拮抗剂可抑制癫痫发作早期IL-10水平。Bot和Rossato等[19,20]研究显示在癫痫动物模型中随着癫痫的持续发作,炎症反应产生的IL-10增加,而miRNA-187的表达减少。癫痫发作后引起的不良的神经重塑和神经炎症是癫痫慢性化的关键,miRNA通过调控干预神经细胞相关炎症因子,减少不良的神经重塑和神经炎症发生,预防癫痫慢性发展[21]。
miRNA与其靶基因的研究分为生物信息学预测和试验验证两部分。基于基因芯片结合生物信息学方法分析得到的与癫痫关系密切的基因功能信息,需要进一步实验研究验证,但本研究结果的部分内容与已证实、已发表文献相符,提示本研究获得的通路及靶基因功能信息具有研究价值。课题组将在以后的研究中对本文预测出的与癫痫相关靶基因和通路进一步完善实验研究。
[参考文献]
[1]秦 兵,廖卫平,臼井直敬,等.癫痫:全球重点防治的神经精神疾病[J].实用医学杂志,2012,28(13):2109.
[2]凌小林.癫痫患者婚姻生育情况国内研究现状[J].现代医药卫生,2013,29(14):2160.
[3]郭 政,李 霞.生物信息学[M].哈尔滨:哈尔滨出版社,2001.1.
[4]Lewis BP,Burge CB,Bartel DP.Conserved seed pairing,often flanked by adenosines,indicates that thousands of human genes are microRNA targets[J].Cell,2005,120(1):15-20.
[5]Friedman RC,Farh KK,Burge CB,et al.Most mammalian mRNAs are conserved targets of microRNAs[J].Genome Res,2009,19(1):92-105.
[6]Racine RJ.Modification of seizure activity by electrical stimulation:ⅡMotor seizures[J].Electroencephalogr Clin Neurophysiol,1972,32(3):281-294.
[7]Letellier M,liramah S,Ondin M,et al.miR-92a regulates expres-sion of synaptic Glu A1-containing AMPA receptors during homeostaticscaling[J].Nat Neurosci,2014,7(8):1040-1042.
[8]Vezzani A,French J,Bartfai T,et al.The role of inflammation in epilepsy[J].Nat Rev Neurol,2011,7(1):31-40.
[9]Haenisch S,von Raden EL,Wahmkow H,et al.miRNA-187-3p-mediated regulation of the KCNK10/TREK-2 potassium channel in a rat epilepsy model[J].ACS Chem Neurosci,2016,7(11):1585-1594.
[10]Chen J,Ark CS,Ang SJ.Activity-dependent synaptic Wnt releaseregulates hippocampal long term potentiation[J].J Biol Chem,2006,81(17):11910-11916.
[11]Hooper C,Arkevich V,lattner F,et al.Glycogen synthasekinase-3 inhibition is integral to long-term potentiation[J].Eur J Neurosci,2007,5(1):81-86.
[12]Cerpa W,Odoy JA,lfaro I,et al.Wnt-7a modulates the synapticvesicle cycle and synaptic transmission in hippocampal neurons[J].J Biol Chem,2008,283(9):5918-5927.
[13]Rubio C,Rosiles-Abonce A,Trejo-Solis C,et al.Increase signaling of wnt/β-catenin pathway and presence of apoptosis in cerebellum of kindled rats[J].CNS Neurol Disord Drug Targets,2017,16(7):772-780.
[14]Theilhaber J,Rakhade SN,Sudhalter J,et al.Gene expression profiling of a hypoxic seizure model of epilepsy suggests a role for mTOR and Wnt signaling in epileptogenesis[J].PLoS One,2013,8(9):e74428.
[15]Qu Z,Su F,Qi X,et al.Wnt/β-catenin signalling pathway mediated aberrant hippocampal neurogenesis in kainic acid-induced epilepsy[J].Cell Biochem Funct,2017,35(7):472-476.
[16]Huang C,Fu XH,Zhou D,et al.The role of Wnt/beta-catenin signaling pathway in disrupted hippocampal neurogenesis of temporal lobe-epilepsy:a potential therapeutic target[J].Neurochem Res,2015,40(7):1319-1332.
[17] Srivastava PK,Roncon P,Lukasiuk K,et al.Meta-analysis of microRNAs dysregulated in the hippocampal dentate gyrus of animal models of epilepsy[J].Neuro,2017,4(6):1551-1562.
[18]Alsharafi WA,Xiao B,Abuhamed MM,et al.Correlation between IL-10 and microRNA-187 expression in epileptic rat hippocampus and patients with temporal lobe epilepsy[J].Front Cell Neurosci,2015,9(14):466.
[19]Bot AM,Debski KJ,Lukasiud K.Alterations in miRNA levels in thedentate gyrus in epileptic rats[J].PLoS One,2013,8:e76051.
[20]Rossato M,Curtale G,Tamassoa N,et al.IL-10 induced microRNA-187 negatively regulates TNF-α,IL-6 and IL-12p40 production in TLR4-stimulated monocytes[J].Proc Natl Acad Sci,2012,109:3101-3110.
[21]Ambrogini P,Albertini MC,Betti M,et al.Neurobiological correlates of alpha-tocopherol antiepileptogenic effects and microRNA expression modulation in a rat model of kainate-induced seizures[J].Mol Neurobiol,2018,2(22):1553-1561.

