褐藻多糖硫酸酯减轻尿酸性肾病大鼠肾小管上皮细胞损伤的作用机制
邓蓉, 谢丽芬, 成杏芳, 陈美艳, 陈伟坚, 聂晓莉,2
(1.南方医科大学中医药学院,广东广州510515;2.南方医科大学南方医院 中医科,广东广州510515)
尿酸性肾病(uric acid nephropathy,UAN)是指由于尿酸盐沉积于肾脏所引起的肾脏损伤.近年来随着高尿酸血症(hyperuricemia,HUA)患病率逐年增高,UAN患病率也随之升高[1],然而目前国内外尚无理想的治疗药物.褐藻多糖硫酸酯(fucoidan polysaccharide sulfate,FPS)是从海洋生物褐藻中提取的一种高度支链化的α-L-岩藻糖-4-硫酸酯聚合成的天然硫酸酯多糖,具有抗凝血、抗肿瘤、抗病毒、抗炎、抗氧化及免疫调节等作用[2],在临床治疗慢性肾衰竭方面有较好的疗效[3],本课题组前期实验表明FPS能改善单侧输尿管梗阻大鼠肾间质纤维化[4].但是 FPS防治UAN的研究仍然较少.因此,本研究采用氧嗪酸钾和腺嘌呤联合给药建立UAN实验大鼠模型,探讨FPS对UAN大鼠肾保护的作用机制,为FPS防治UAN提供实验依据.
1 材料和方法
1.1 材料
1.1.1 药品与试剂
褐藻多糖硫酸购自吉林辉南长龙生化药业股份有限公司,别嘌呤醇、腺嘌呤、氧嗪酸钾购自阿拉丁生化科技股份有限公司,TUNEL染色试剂盒购自Roche公司,大鼠活性氧(ROS)ELISA试剂盒购自北京拓英时代科技有限公司.
1.1.2 实验动物
健康雄性SD大鼠60只,体质量(200±20)g,购于南方医科大学实验动物中心(动物许可证号:SYXK(粤)2011-0074),本研究通过南方医科大学实验动物伦理委员会批准.
1.1.3 仪器
RS-20Ⅲ型低温冷冻离心机购自日本TOMY SEIKO公司;贝克曼AU4802购自美国BECKMAN COULTER公司;透射电子显微镜购自日本HITACHI公司;正置光学显微镜、成像系统购自日本尼康公司;包埋机、冻台、组织摊片机购自武汉俊杰电子有限公司;电镜专用切片机购自武汉谷歌生物公司.
1.2 方法
1.2.1 UAN大鼠模型的制备、分组及给药
大鼠适应性饲养7 d后随机分为正常对照组、模型组、别嘌呤醇组、FPS低质量分数组(每天给质量分数50 mg/kg)、中质量分数组(每天给质量分数100 mg/kg)、高质量分数组(每天给质量分数200 mg/kg),每组10只,除正常对照组予以等体积蒸馏水外,其余4组均每天予以质量分数100 mg/kg腺嘌呤和质量分数250 mg/kg氧嗪酸钾灌胃给药,连续2周造模.别嘌呤醇组、FPS组大鼠在造模后同时分别每天给予别嘌呤醇(质量分数5 mg/kg)、低中高质量分数 FPS灌胃,正常对照组和模型组大鼠同时予等量蒸馏水,连续给药2周.
1.2.2 样本采集
末次给药后1 h,所有大鼠麻醉后腹腔静脉采血,5 000×g离心10 min获取血清样本.在冰台上迅速分离肾脏组织,于-80℃保存待测.
1.2.3 血清生化指标检测
采用全自动生化分析仪检测大鼠血尿酸(uric acid,UA)、血清肌酐 (serum creatinine,SCr)、血清尿素氮(blood urea nitrogen,BUN).
1.2.4 肾组织病理形态学观察
经体积分数为10%中性甲醛固定的肾组织常规脱水、透明、包埋,制成3μm切片,行苏木素伊红染色(haematoxylin-eosin stain,HE),光镜下观察肾脏病理改变情况.
1.2.5 肾小管上皮细胞透射电镜观察
经体积分数为2.5%戊二醛溶液固定的肾脏组织用PBS冲洗3次,15 min/次,加入体积分数为1%饿酸处理直至样品变黑后PBS冲洗3次,15min/次;4℃下,组织经乙醇梯度脱水后于室温中加入丙酮,作用3次,15 min/次,纯丙酮+包埋液(体积比为2∶1)室温包埋4 h后纯丙酮+包埋液(体积比为2∶1)包埋24 h,之后用包埋液在37℃包埋3 h;37℃聚合过夜,45℃聚合12 h,60℃聚合48 h后切成60 nm切片,用体积分数为2%醋酸铀、枸橼酸铅染色15 min,干燥后上机观察.
1.2.6 TUNEL免疫组化染色观察肾小管上皮细胞凋亡
经体积分数为10%中性甲醛固定的肾组织常规脱水、透明、包埋,制成石蜡切片,按TUNEL说明书操作.光学显微镜下观察每组肾小管上皮细胞凋亡情况,正常细胞核显蓝色,凋亡阳性细胞核呈棕黄色,应用Image-Pro Plus 6.0软件(Media Cybernetics,Inc.,Rockville,MD,USA)分析图片,计算每200倍放大视野凋亡阳性细胞数目与细胞总数的百分比(阳性细胞数/总细胞数×100%)即为凋亡率(%).
1.2.7 酶联免疫法(ELISA)测定肾脏组织中ROS水平
肾脏组织质量0.5 g置PBS中匀浆,在水浴中用匀浆器制备质量比为1∶10的匀浆,4℃下12 000×g离心15 min,取上清液,按照试剂盒方法测定ROS的量.
1.3 统计学方法
采用SPSS 20.0软件进行统计学处理,计量资料以(均数±标准误差)(±s)表示,均数比较采用t检验,多组间的比较用单因素方差分析,P<0.05为有统计学差异.
2 结果
2.1 FPS对大鼠一般状况及血尿酸、肾功能指标影响
实验过程中模型组死亡大鼠4只,FPS低质量分数组死亡2只,别嘌呤醇组、FPS中质量分数组各死亡1只,正常对照组、FPS高质量分数组无死亡(图1).与正常对照组相比,模型组大鼠精神萎靡,反应能力下降,饮水量和尿量增加,毛色欠光泽,检测血清UA、BUN、SCr水平显著升高(P<0.01),表明UAN实验大鼠模型造模成功.别嘌呤醇组和FPS中、高质量分数组大鼠一般状况较模型组显著改善,且大鼠血清尿酸、尿素氮和肌酐水平较模型组均显著降低(P<0.01).结果表明质量分数为100 mg/kg的腺嘌呤和250 mg/kg的氧嗪酸钾连续灌胃2周可建立UAN大鼠模型,FPS能降低UAN大鼠血清UA水平、改善肾功能损伤(表1).
表1 FPS对UAN大鼠血尿酸、肾功能指标的的影响Table 1 Effect of FPS on SUA and renal function indexes in rats with UAN(±s)

表1 FPS对UAN大鼠血尿酸、肾功能指标的的影响Table 1 Effect of FPS on SUA and renal function indexes in rats with UAN(±s)
与模型组比较:1)P<0.01;与正常对照组比较:2)P<0.01,3)P<0.05.
正常对照组 10 - 102.5±30.41) 4.0±1.01) 20.0±2.11)模型组 6 - 632.2±83.92) 8.6±2.12) 82.1±5.52)别嘌呤醇组 9 5 108.7±31.71) 4.4±2.51) 25.4±1.91)FPS低质量分数组 8 100 130.4±28.31),3) 5.1±2.31) 27.6±3.51)FPS中质量分数组 9 200 110.3±29.31) 4.7±1.71) 22.3±2.11)FPS高质量分数组 10 300 103.3±17.91) 4.1±1.31) 20.1±1.61)
2.2 FPS对UAN大鼠肾脏外观及组织病理学影响
肉眼观察可见,模型组大鼠肾脏体积增大,颜色苍白,表面颗粒状较多,与模型组相比,FPS中、高质量分数组及别嘌呤醇组肾脏体积略小,表面颗粒减少,而FPS低质量分数组与模型组相似.HE染色组织病理学可见,模型组肾小管内皮细胞萎缩,管腔扩大,肾小管内大量黄褐色尿酸盐结晶沉积,肾小管间质较多炎性细胞浸润,肾间质纤维增生样改变.与模型组相比,FPS中、高质量分数组及别嘌呤醇组炎性细胞浸润、肾小管萎缩及肾间质纤维化有不同程度减轻,而FPS低质量分数组改善不明显.结果表明UAN大鼠主要表现为肾小管损伤,FPS可以显著改善肾小管损伤(图2,图3).

图2 各组大鼠肾脏外观观察(×20)Fig.2 Appearance observation on kidney of rats in each group(×20)
2.3 FPS对肾小管上皮细胞凋亡的影响
与正常对照组比较,模型组肾小管上皮细胞凋亡明显(P<0.01).与模型组比较,FPS低、中、高质量分数组和别嘌呤醇组肾小管上皮细胞凋亡均有显著减少(P<0.01,P<0.05,图4、表 2).结果表明肾小管上皮细胞凋亡是UAN大鼠肾脏损伤重要的病理机制,FPS可显著抑制UAN大鼠肾小管上皮细胞凋亡.

图4 FPS对UAN大鼠肾小管上皮细胞凋亡的影响(×20)Fig.4 Effect of FPS on apoptosis of renal tubular cells in rats with UAN(×20)
表2 FPS对UAN大鼠肾小管上皮细胞凋亡的的影响Table 2 Effect of FPS on apoptotic indexes of renal tubular cells in rats with UAN(±s)
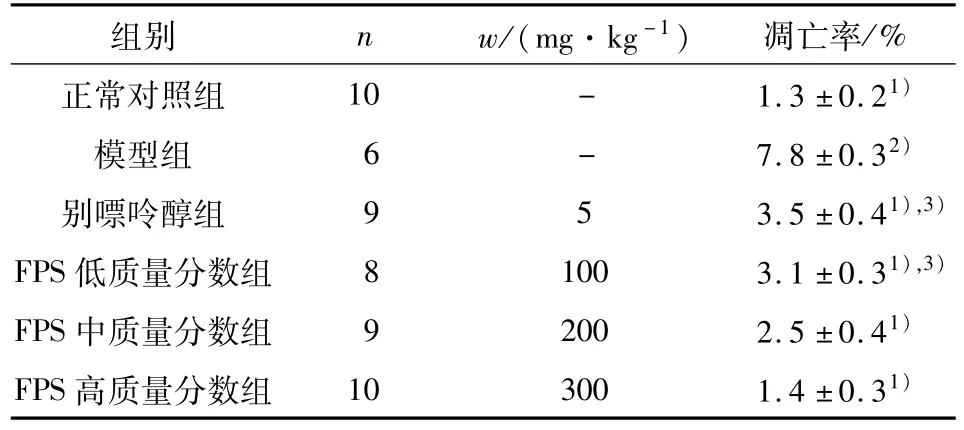
表2 FPS对UAN大鼠肾小管上皮细胞凋亡的的影响Table 2 Effect of FPS on apoptotic indexes of renal tubular cells in rats with UAN(±s)
与模型组比较:1)P<0.01;与正常对照组比较:2)P<0.01,3)P<0.05.
正常对照组 10 - 1.3±0.21)模型组 6 - 7.8±0.32)别嘌呤醇组 9 5 3.5±0.41),3)FPS低质量分数组 8 100 3.1±0.31),3)FPS中质量分数组 9 200 2.5±0.41)FPS高质量分数组 10 300 1.4±0.31)
2.4 FPS对UAN大鼠肾小管上皮细胞微结构的影响
电镜观察可见,模型组肾小管上皮细胞膜结构不清,微绒毛排列紊乱,线粒体肿胀,基底部可见大量溶酶体和自噬体形成.与模型组相比,FPS各治疗组肾小管上皮细胞微结构损害均有不同程度恢复(图5).结果表明HUA可诱导UAN大鼠肾小管上皮细胞线粒体损伤、细胞过度自噬,而FPS显著改善肾小管上皮细胞线粒体损伤及细胞过度自噬.

图5 各组大鼠肾小管上皮细胞电镜观察(×20 000)Fig.5 Electron Microscope observation on renal tubular epithelial cells of rats in each group(×20 000)
2.5 FPS对肾脏组织ROS水平影响
与正常对照组比较,模型组大鼠肾组织ROS水平显著升高(P<0.01),而 FPS低、中、高质量分数组和别嘌呤醇组ROS较模型组均显著降低(P<0.01).结果表明FPS可显著降低肾脏组织中ROS水平(表3).
表3 FPS对UAN大鼠肾脏组织ROS的影响Table 3 Effect of FPS on ROS of kidney tissues in rats with UAN(±s)
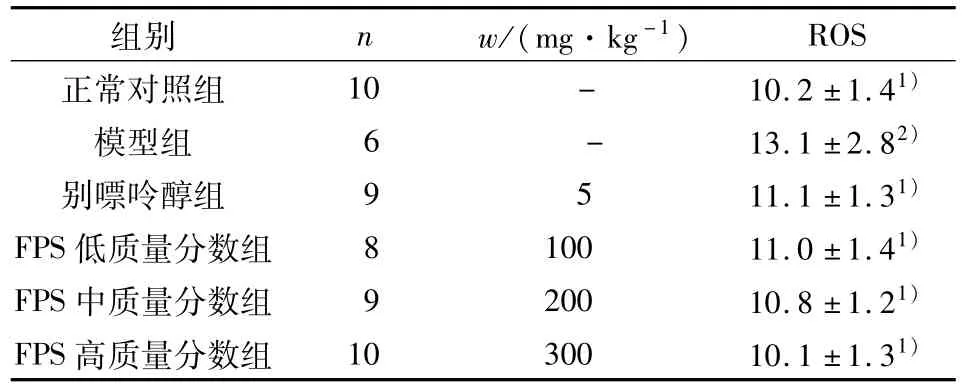
表3 FPS对UAN大鼠肾脏组织ROS的影响Table 3 Effect of FPS on ROS of kidney tissues in rats with UAN(±s)
与模型组比较:1)P<0.01;与正常对照组比较:2)P<0.01.
正常对照组 10 - 10.2±1.41)模型组 6 - 13.1±2.82)别嘌呤醇组 9 5 11.1±1.31)FPS低质量分数组 8 100 11.0±1.41)FPS中质量分数组 9 200 10.8±1.21)FPS高质量分数组 10 300 10.1±1.31)
3 讨论
HUA是由于人体内嘌呤生成代谢紊乱所致机体内血尿酸生成过多的一种代谢性疾病.流行病学调查显示,血尿酸水平是慢性肾脏病、心血管疾病、高血压及代谢综合征等疾病进展的独立危险因素[5].目前临床上用于治疗HUA的药物如别嘌醇、苯溴马隆等药物具有明确的降尿酸作用,但常出现药物过敏、肝肾损害等副作用[6],而新型降尿酸药物由于价格昂贵、缺乏足够的试验数据,其疗效和安全性需要进一步完善,所以并没有在临床上广泛使用[7].因此,探寻更为安全有效的降尿酸药物具有重大的临床及社会意义.
研究表明褐藻多糖硫酸酯具有广泛的生物学活性,如抗凝血、抗氧化、调节免疫、降血脂等,而且各种活性之间相互关联,可通过多途径、多靶点发挥肾脏保护作用[8].Wu等[9]发现 FPS可通过促进肾组织中表面有机阳离子转运蛋白-2表达,上调蛋白激酶表达,抑制肾脏细胞凋亡,明显减轻经腺嘌呤诱导的 UAN,减轻肾损伤.Wang[10]研究发现FPS具有抗氧化作用,通过提高抗氧化酶活性,可抑制细胞脂质过氧化,并有效缓解腺嘌呤诱导的肾小管间质及肾小球系膜区域的病理损害.Josephine等[11]研究发现FPS能抑制细胞中ROS生成,降低氧化应激反应,减轻细胞内线粒体损伤,缓解环孢霉素A诱导的肾小管损伤.本实验采用氧嗪酸钾联合腺嘌呤诱导建立UAN大鼠模型,并用不同浓度的FPS进行干预,结果表明FPS具有确切有效地降低UAN大鼠血尿酸水平、改善肾功能的作用.
细胞凋亡是细胞在生理或病理状态下发生的一种自发性、程序性死亡的过程,与细胞增殖共同维持正常的生命活动,两者调节失控可引起多种疾病发生[12].肾脏损伤时由内源或浸润细胞线粒体损伤会产生过量ROS可导致生物膜和大分子物质发生脂质过氧化损伤,引起组织病变及多器官功能的损伤[13].研究表明,HUA大鼠多种组织细胞均有氧化应激加强,线粒体功能障碍,ATP水平降低[14-15],而高尿酸体外培养肾小管上皮细胞可上调NADPH氧化酶 NOX4蛋白表达,促进ROS生成,诱导细肾小管细胞凋亡[16],并且ROS的增加可能是诱导Parkin/PINK1依赖性线粒体自噬的重要因素[17].UAN肾脏损伤的主要病理基础是肾小管上皮细胞损伤,本研究中肾脏组织免疫组化、电镜观察及ELISA检测ROS含量等结果进一步提示,UAN大鼠肾小管上皮细胞线粒体损伤导致细胞中ROS生成过多,大量ROS可诱导UAN大鼠肾小管上皮细胞发生程序性凋亡、自噬相关性死亡等病理变化,而FPS可显著减轻UAN肾小管上皮细胞线粒体损伤、减少细胞过度自噬、抑制肾小管上皮细胞凋亡,这提示FPS改善UAN肾损伤的作用机制与调控细胞凋亡及自噬过度相关.
综上所述,UAN的发生发展与HUA损伤肾小管上皮细胞线粒体,产生大量ROS诱导细胞凋亡及自噬性死亡相关,而FPS可通过降低ROS水平、减轻细胞线粒体损伤、抗肾小管上皮细胞凋亡等作用,从而有效减轻UAN肾小管上皮细胞损害,本研究为FPS防治UAN提供了基础药理学依据,下一步将在FPS防治UAN的分子机制进行深入研究.
[1]LIU H,ZHANG X M,WANG Y L,et al.Prevalence of hyperuricemia among Chinese adults:a national crosssectional survey using multistage,stratified sampling[J].Journal of Nephrology,2014,27(6):653-658.
[2]VEENA C K,JOSEPHINE A,PREETHA S P,et al.Renal peroxidative changes mediated by oxalate:the protective role of fucoidan[J].Life Sci,2006,79(19):1789-1795.
[3]FITTON J H,STRINGER D N,KARPINIEC S S.Therapies from Fucoidan:An Update[J].Mar Drugs,2015,13(9):5920-5946.
[4]雷作熹,罗仁,李咏梅,等.羊栖菜对UUO大鼠肾间质纤维化的影响[J].中药药理与临床,2006,22(1):46-48.LEIZ X,LUO R,LIY M,et al.Sargassum fusiforme(Harv) Setchell ameliorates renal interstitial fibrosis caused by unilateral ureteral obstruction [J].Pharmacology and Clinics of Chinese Materia Medica,2006,22(1):46-48.
[5]CHOIH K,FORD E S.Prevalence of the metabolic syndrome in individuals with hyperuricemia[J].Am J Med,2007,120(5):442-447.
[6]杨媛,李静,甄健存,等.抗痛风药别嘌呤醇、苯溴马隆及秋水仙碱不良反应报告分析[J].中国医院药学杂志,2013,33(15):1296-1297.YANG Y,LI J,ZHEN JC,et al.Analysis of adverse drug reactions of antigout drugs allopurinol,benzbromarone,and colchicine[J].China Journal of Hospital Pharmacy,2013,33(15):1296-1297.
[7]李鑫德,李长贵.促进尿酸分解药物的疗效与安全性评价[J].药品评价,2015,12(7):55-60.LIX D,LIC G.Evaluation on the safety and efficacy of drugs promote the decomposition of uric acid[J].Drugs and Clinic,2015,12(7):55-60.
[8]FITTON J H, STINGER D N, KARPINIEC S S.Therapies from Fucoidan:An Update[J].Marine Drugs,2015,13(9):5920-5946.
[9]WU X L,YAN M,LIU T,et al.Fucoidan elevates surface organic cation transporter 2 expression via upregulation of protein kinase A in uric acid nephropathy[J].Experimental and Therapeutic Medicine,2017,14(5):4153-4159.
[10]WANG J, WANG F, YUN H, et al. Effect and mechanism of fucoidan derivatives from Laminaria japonica in experimental adenine-induced chronic kidney disease[J].JEthnopharmacol,2012,139(3):807-813.
[11]JOSEPHINE A,AMUDHA G,VEENA C K,et al.Beneficial effects of sulfated polysaccharides from Sargassum wightii against mitochondrial alterations induced by Cyclosporine A in rat kidney[J].Mol Nutr Food Res,2007,51(11):1413-1422.
[12]卢晓晔,钟雪云.Caspases与细胞凋亡(综述)[J].暨南大学学报(自然科学与医学版),2000,21(6):121-124.LU X Y,ZHONG X Y.Caspases and apoptosis[J].Journal of Jinan University(Natural Science&Medicine Edition),2000,21(6):121-124.
[13]秦涛余,陈志伟.机体内活性氧生理功能研究进展[J].生命科学器,2008,6(2):12-16.QIN T Y,CHEN Z W.Progress in physiological functions of reactive oxygen species in the body[J].Life Science Instruments,2008,6(2):12-16.
[14]MAARMAN G J,ANDREW BM,BLACKHURSTD M,et al.Melatonin protects against uric acid-induced mitochondrial dysfunction, oxidative stress, and triglyceride accumulation in C2C12 myotubes[J].JAppl Physiol(1985),2017,122(4):1003-1010.
[15]SÁNCHEZ-LOZADA L G,LANASPA M A,CRISTÓBALGARCÍA M, et al. Uric acid-induced endothelial dysfunction is associated with mitochondrial alterations and decreased intracellular ATP concentrations[J].Nephron Experimental nephrology,2012,121(0):e71-e78.
[16]LIZ,SHENG Y,LIU C,et al.Nox4 has a crucial role in uric acid-induced oxidative stress and apoptosis in renal tubular cells[J].Mol Med Rep,2016,13(5):4343-4348.
[17]XIAO B,GOH J Y,XIAO L,et al.Reactive oxygen species trigger Parkin/PINK1 pathway-dependent mitophagy by inducing mitochondrial recruitment of Parkin[J].J Biol Chem,2017,292(40):16697-16708.

