非创伤性股骨头坏死与潜在关键基因表达谱的相关研究
晏涛, 郜玉忠
(锦州医科大学附属第一医院骨关节病区,辽宁锦州121001)
非创伤性股骨头坏死(non-traumatic osteonecrosis of femoral head,NOFH)是一种进行性病理过程,由于股骨头供血受阻、局部循环中断和软骨下骨供血受损导致骨坏死和塌陷,最终致髋关节功能受损和永久性残疾[1-2];早期症状不明显,患者总是错过最佳的治疗时机[3].此外,Weinstein[4]认为股骨头坏死不能逆转,早期诊断和治疗干预非常重要.非创伤性股骨头坏死的病因和发病机制尚不清楚,缺乏预防和早期诊断治疗股骨头坏死的有效方法.
股骨头坏死病因学机制假说众多,脂类代谢紊乱、凝血循环障碍、髓内高压、细胞功能障碍学说等,有研究表明,基因多态性与股骨头坏死有关,Lin等[5]最新研究发现与免疫系统调节相关的Fcer1A和Il7R基因和与肌肉系统过程相关的Tnn2、Mylpf和Myl1基因可能与类固醇诱导的股骨头坏死机制相关.甲状旁腺激素受体1(parathyroid hormone receptor 1,PTHR1)可能通过与维生素D受体(vitam in D receptor,VDR)相互作用而参与糖皮质激素诱导的股骨头缺血坏死[6].信号转导和转录激活因子1(signal transducers and activators of transcription1,STAT1)-蛋白酶 3途径在类固醇诱发的股骨头坏死病程中通过上调蛋白酶3的表达和STAT1的激活发挥关键作用,并促使股骨头坏死[7].
本研究根据Liu等[8]公开发表的基因表达谱数据进行非创伤性股骨头坏死的生物信息学分析.筛选非创伤性股骨头坏死和健康对照组织之间的差异表达基因,并对基因功能、信号通路及蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络进行分析,可能有助了解非创伤性股骨头坏死发病的分子机制及生物学信息.
1 材料与方法
1.1 材料
非创伤性股骨头坏死的基因芯片数据GSE74089(Liu等,2016)从公共数据库GEO下载(https://www.ncbi.nlm.nih.gov/geo/).以 necrosis of femoral head为数据检索关键词,研究类型为Expression profiling by array,限制种属为 Homo sapiens,是1个基于Agilent-026652全基因组微阵列4x44K v2的芯片平台:GPL13497.此芯片共包含有8例股骨头髋关节软骨标本.
1.2 数据的提取、处理及差异基因分析
基因表达谱的原始数据集利用Perl(practical extraction and report language)工具优先基因ID转换后,提取基因矩阵相关数据.将整理后的数据用R语 言 的 limma包 (http://bioconductor.org/biocLite.R)分析,严格按照RMA算法对原始数据进行背景校正、标准化及表达值计算,最终筛选出股骨头坏死组与健康对照组之间差异表达基因,并绘制火山图.差异表达基因需同时满足以下筛选条件:(1)采用t检验,定义校正后P<0.05;表示差异倍数(fold change).
1.3 差异表达基因的富集分析
DAVID(database for annotation,visualization and integrated discovery)是在线生物信息学分析工具(https://david.ncifcrf.gov/),拥有一系列功能注释工具,可为大规模的基因进行生物功能富集分析.通过上传差异表达基因进行基因本体论(gene ontology,GO)功能注释分析.用 R语言的GOplot包进行差异基因功能可视化绘图.设定P<0.05和FDR<0.05为显著性基因富集的临界值.用R语言的RSQLite、cluster Profiler包进行KEGG(kyoto encyclopedia of genes and genomes)通路的富集分析.应用统计学检验,设置条件:P<0.005,找出与整个基因组背景相比,在差异表达基因中显著性富集的通路.
1.4 PPI网络构建与分析
STRING(search tool for the retrieval of interacting genes/proteins,https://string-db.org/)数据库是利用已知或预测的蛋白质相互作用数据组成的网络资源,包括直接和间接的蛋白质相互作用.通过STRING对坏死股骨头软骨差异表达基因进行蛋白-蛋白相互作用(PPI)网络分析,核心蛋白是PPI网络中蛋白质作用的重要节点,为少数具有许多相互作用的中枢蛋白.设置条件:combined score>0.9.用Cytoscape软件可视化PPI网络图.将互作网络数据用R语言barplot包绘图,显示前20个互作网络中突出的中心节点蛋白并进一步GO功能富集分析.
2 结果
2.1 差异表达基因筛选结果
依据差异表达基因筛选条件,与健康对照组对比,股骨头坏死组共获得1 315个差异表达基因,其中上调基因809个,下调基因506个(图1).数据结果表明,用差异表达基因可以将股骨头坏死组从健康对照组中区分开来.
2.2 差异表达基因GO分析结果
通过GO功能富集分析,809个上调基因中有14个基因富集呈显著性(P<0.05,FDR<0.05),506个下调基因中有12个基因富集呈显著性(P<0.05,FDR<0.05).结果显示,上调的差异表达基因主要涉及细胞外基质、胶原纤维组织、蛋白质细胞外基质、胶原蛋白三聚体、胶原分解代谢过程、细胞外基质组织、胞外空间、泛素-蛋白转移酶活性(FBXW7、HACE1)、蛋白结合(FBXW7、HACE1)等功能类别;下调的差异表达基因主要涉及通过 MHCⅡ类抗原加工和呈递肽或多糖抗原、MHCⅡ类蛋白复合物、MHCⅡ类受体活性、免疫球蛋白产生涉及免疫球蛋白介导的免疫应答、内质网膜腔侧的组成、干扰素-γ介导的信号通路、抗原加工和表现、通过MHCⅡ类抗原处理和呈递外源肽抗原等功能类别(表 1).采用DAVID进一步对股骨头坏死样本的全部1315个差异基因行GO功能富集分析显示,6个GO功能富集显著相关,主要涉及蛋白质细胞外基质(proteinaceous extracellular matrix)、胞外空间(extracellular space)、细胞外基质(extracellular matrix)、胶原蛋白三聚体(collagen trimer)、细胞外基质组织(extracellular matrix organization)、胶原纤维组织(collagen fibril organization).从6类GO功能富集中选取显著表达的40个差异基因,用R语言GOplot包绘制基因聚类分布情况(图2).
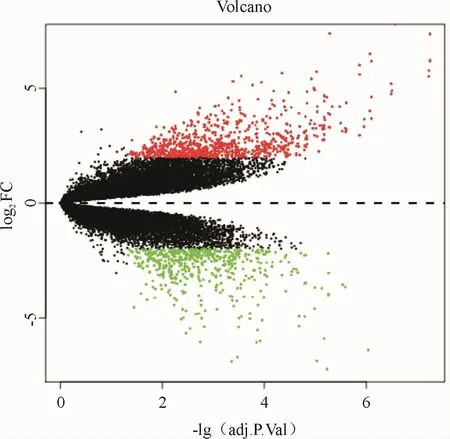
图1 差异表达基因火山图Fig.1 Volcano plot of differentially expressed genes

表1 上、下调差异表达基因前12个GO功能分析结果Table 1 The top 12 enriched GO terms of the UP-and down-regulated differentially expressed genes

BP(biological process,生物学过程);CC(cellular component,细胞组分);MP(molecular function,分子功能);GO(gene ontology,基因本体论).
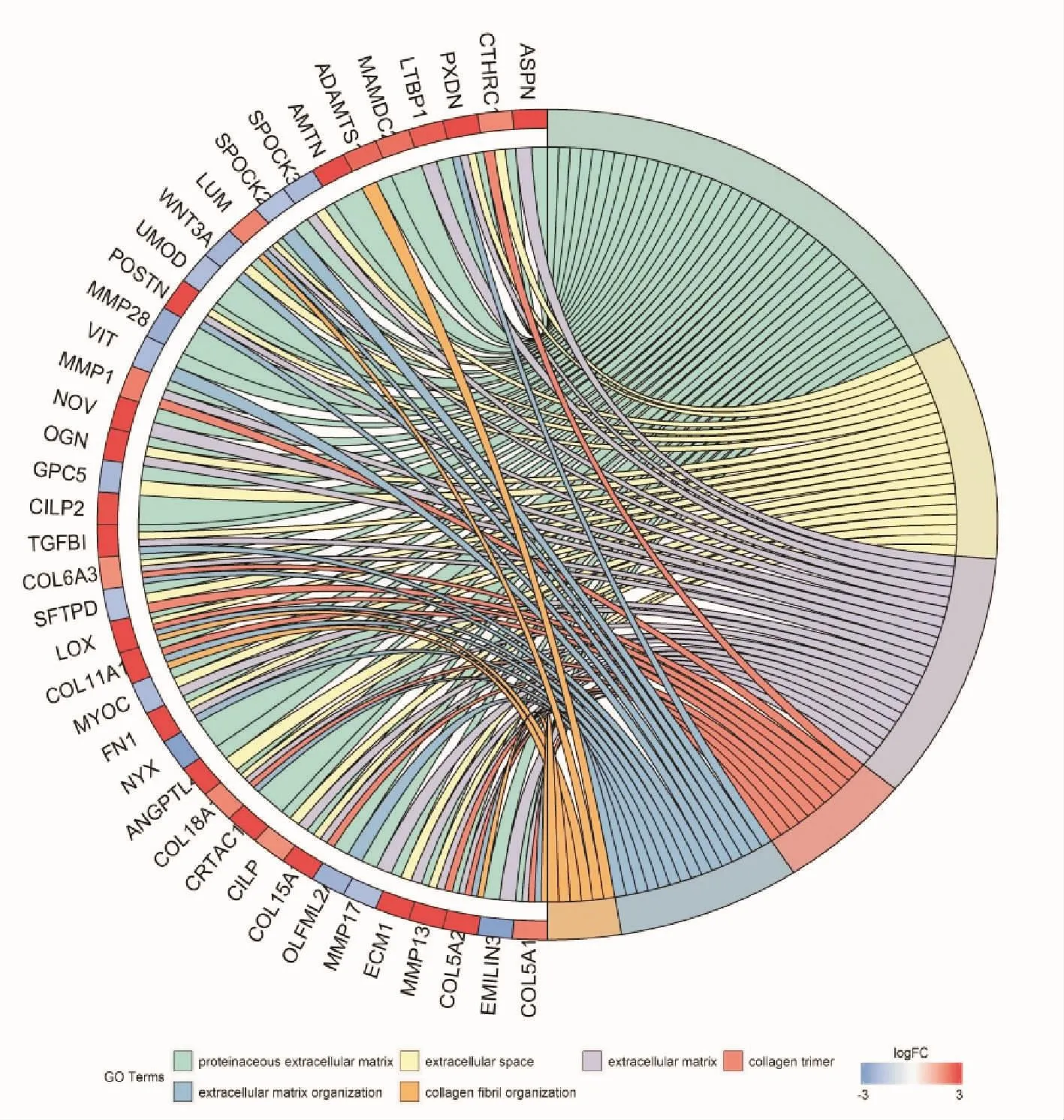
图2 差异表达基因的前6个GO功能富集和弦图(top40)Fig.2 The top 6 enriched GO terms of the 40 differentially distinctly expressed genes are enriched in the chord plot
2.3 差异表达基因KEGG通路富集分析
为了解差异基因参与的代谢通路及具体的生物学功能,进行KEGG通路分析.结果显示上调差异表达基因主要富集了黏着斑(VEGFC)、蛋白质消化吸收、松弛素信号通路、糖尿病并发症AGE-RAGE信号通路、PI3K-Akt信号通路、Hippo信号通路、凋亡信号通路(如SGK1)、癌症途径、Hedgehog信号通路、转化生长因子β信号通路等;而下调的差异表达基因主要富集途径如抗原加工和表现(HLA-DRB4)、同种异体移植排斥反应、移植物抗宿主病、造血细胞谱系、细胞粘附分子(CAMs)、HLA-DRB4、Th1/Th2细胞分化、Th17细胞分化、补体和凝血级联反应等(表2).

表2 差异表达基因的KEGG通路分析Table 2 KEGG pathway analysis of differentially expressed genes
2.4 差异表达基因PPI分析
为阐释涉及股骨头坏死差异基因分子机制,通过STRING数据库构建了蛋白互作网络,用cytoscape软件绘制蛋白互作网络图.PPI网络由391个节点和1 213个交互组成(图3).红色、绿色节点分别表示股骨头坏死样本相较于健康对照组高、低表达的基因.蛋白互作网络交互密集的20个中心节点蛋白依次为:GNB5、GNG12、GNG13、GNG8、BTRC、ADCY7、BDKRB1、SAA1、UBE2N、SOCS3、UBE2B、DET1、FBXL4、FBXO32、FBXW7、GCGR、HACE1、HERC1、KBTBD13、KLHL2(图4).根据GO富集分析,这些差异表达基因主要参与蛋白质泛素化(HACE1、FBXW7),异三聚体G蛋白复合物(GNG8)和泛素-蛋白转移酶活性(HACE1、FBXW7)(表3).

图3 上、下调差异基因构建的蛋白互作网络图Fig.3 Protein-protein interaction network constructed with the up-and down-regulated differentially expressed genes
3 讨论
随着新一代高通量基因芯片技术的发展,生物信息学正在改变人们研究生物医学的传统方式,高通量测序技术以及数据分析技术已成为探索生物学底层机制和研究人类复杂疾病诊断、治疗及预后的重要工具.本研究主要通过生物信息学技术对GEO数据库下载的非创伤性股骨头坏死基因芯片(GSE74089)进行数据分析,并使用R语言包挖掘数据,探索可作为股骨头坏死诊断、发病机制的潜在关键基因,是NOFH中基于人关节软骨的第一个基因表达谱生物信息学研究,本研究结果可能为NOFH的发病机制及治疗措施提供新的选择依据.
在本研究中,共获得809个上调差异表达基因和506个下调差异表达基因.根据GO显著富集结果分析,差异表达基因主要参与细胞外基质、胞外空间、胶原蛋白三聚体、胶原纤维组织等.这些显著富集的细胞外基质相关基因和胶原基因均为上调基因,有研究表明此类基因的突变可能与关节炎及股骨头的坏死发生、发展密切相关[8].图2中COL5A1编码V型胶原的α链是结缔组织的次要组分.在动物研究中,发现COL5A1的功能障碍产生异常关节表型,如关节松弛和早发性骨关节炎[9].ASPN编码软骨细胞外蛋白质,能够通过阻断软骨细胞中转化生长因子(TGF)-β受体相互作用来负调节关节软骨的软骨形成[10].OGN编码骨胶原能够诱导异位骨形成和调节心血管发育[11-12].CRTAC1编码软骨酸性蛋白1在关节软骨的深部区域表达.CRTAC1作为区分软骨细胞与成骨细胞和间充质干细胞的生物标志物[13].
KEGG通路分析中,黏着斑(focal adhesion)是细胞骨架中的一种重要的结构,细胞依靠“黏着斑”特殊结构来保持其正常形态和发挥其正常功能[14].黏着斑可能参与骨坏死早期时调节细胞生长的过程.蛋白质消化吸收(protein digestion and absorption)与股骨头缺血坏死后期骨质平衡破坏、关节软骨塌陷有关.松弛素信号通路(relaxin signaling pathway)具有多效性作用,包括血管扩张,抗纤维化和血管生成作用[15].与股骨头坏死患者微血管病变、血液循环障碍、凝血机制异常密切相关.转化生长因子 β信号通路(TGF-beta signaling pathway)中的转化生长因子-β(TGF-β)家族成员,包括TGF-β,激活素和骨形态发生蛋白(BMP),广泛调节细胞的增殖,凋亡,分化和迁移功能[16].大量研究证实BMP有诱导成骨作用,其中BMP-2成骨诱导作用最强,是最有前途的骨诱导物质[17].类风湿关节炎(rheumatoid arthritis)系慢性自身免疫性关节疾病,本身就可以进展为股骨头坏死,如有激素或类固醇的诱导,发生骨坏死的比率将明显增加[18].骨髓造血细胞为股骨头骨组织的重要组成部分,造血细胞系(hematopoietic cell lineage)中骨髓造血细胞的病理改变可影响股骨头坏死的发展.抗原加工和表现(antigen processing and presentation)、Th1和 Th2细胞分化(Th1 and Th2 cell differentiation)及 Th17细胞分化(Th17 cell differentiation)均涉及免疫系统.Okazaki等[19]已经证明股骨头坏死与免疫系统的破坏有关,免疫失调可导致骨代谢异常,骨量减少及骨小梁塌陷,最终导致骨坏死.
从PPI网络交互密集的20个中心节点蛋白进行潜在关节基因挖掘,发现了HACE1、FBXW7、GNG8、SAA1前4名潜在基因.在本研究中,上调的HACE1、FBXW7主要涉及蛋白质泛素化.HACE1是HECT家族E3连接酶,通过介导Rac1的泛素化,激活泛素 -蛋白酶体途径[20].HACE1生物学功能广泛,可通过介导核因子E2相关因子2(NRF2)发挥抗氧化应激作用.氧化应激是缺血性损伤的重要病理机制,Ichiseki等[21]研究发现,短暂氧化应激即可加重骨坏死.Murata等[22]研究证实,激素可能通过氧化应激途径产生骨坏死.有研究报道HACE1的丧失可增加体内外活性氧(ROS)水平,HACE1的丧失导致ROS依赖性谷氨酰胺成瘾[23].活性氧(ROS)增加可促进股骨头坏死发生,而抗氧化剂的使用可在一定程度上抑制这一病理过程[24].最近研究发现,当Rac1与Rac1依赖性NADPH氧化酶复合物结合时,HACE1特异性地靶向活化Rac1,以降低ROS产生[25].FBXW7基因编码的蛋白是F-box蛋白家族的一员.FBXW7可通过调节内皮Notch信号途径控制血管形成[26].同时FBXW7是脂肪细胞分化的负调节因子,FBXW7的上调有助于脂肪细胞肥大相关的 G0/G1期细胞周期停滞[27].Onoyama等[28]研究认为FBXW7在调节肝脏的脂肪生成和细胞增殖和分化中发挥着关键作用.目前没有证据表明HACE1和FBXW7与股骨头坏死的发病机制有关.因此,推测HACE1和FBXW7可能通过蛋白质泛素化过程参与股骨头坏死的进展.
此外,在 PPI网络模块中,下调的GNG8、SAA1分别涉及异三聚体G蛋白复合物与炎症反应的负调节过程.GNG8(鸟嘌呤核苷酸结合蛋白8)是细胞跨内皮迁移过程中一个极为重要的趋化因子.GNG8通过细胞膜G蛋白磷酸化和去磷酸化参与多细胞信号转导[29].G蛋白偶联受体(GPCR)在内皮细胞的增殖、迁移和管腔形成,以及成血管细胞的迁移、分化等过程中发挥作用[30-31].Li等[32]发现 FIZZ1(炎症区域分子 1)可以通过上调GNG8、ATG9A和P13K/Akt通路基因表达来提高大鼠主动脉内皮细胞的血管生成能力.目前,改善股骨头及其周围血液循环、促再血管化及促成骨是早期股骨头坏死治疗的研究热点.SAA1(血清淀粉样蛋白1)是一种新的促炎性脂肪细胞因子,也是一种炎症信号的触发剂.Wang等[33]研究发现SAA1是动脉粥样硬化和心肌梗死的候选基因.最近几项研究报道了SAA1基因多态性与颈动脉粥样硬化症[34]、脂质水平[35]、尿酸水平[36]和外周动脉疾病[37]的关系.Xu等[38]也报道SAA1基因多态性与脂质水平相关.SAA1基因多态性也与中国人群的骨质疏松有关,与SAA基因多态性引起的脂质紊乱有关[39].本研究中,两个基因富集于血管生成及脂质代谢过程,GNG8、SAA1之间的相互作用可能在股骨头坏死发展中起重要作用.
综上,采用生物信息学的方法在股骨头坏死样品中共鉴定出809个上调与506个下调差异表达基因.HACE1、FBXW7、GNG8和SAA1等基因以及松弛素信号通路、转化生长因子β信号通路等可能与非创伤性股骨头缺血坏死的病理机制密切相关.为股骨头缺血坏死发病机制的研究与治疗提供参考.
[1]CHAN K L,MOK CC.Glucocorticoid-induced avascular bone necrosis:diagnosis and management[J].Open Orthopaedics Journal,2012,6(1):449.
[2]WEINSTEIN R S. Clinical practice. Glucocorticoidinduced bone disease[J].New England Journal of Medicine,2011,365(1):62-70.
[3]WU B,DONG Z,Li S,et al.Steroid-induced ischemic bone necrosis of femoral head:treatment strategies[J].Pakistan Journal of Medical Sciences,2015,31(2):471.
[4]WEINSTEIN R S.Glucocorticoid-induced osteoporosis and osteonecrosis[J].Endocrinology& Metabolism Clinics of North America,2012,41(3):595.
[5]LIN Z,LIN Y.Identification of potential crucial genes associated with steroid-induced necrosis of femoral head based on gene expression profile[J].Gene,2017,627:322.
[6]HUANG G,WEIY,ZHAO G,et al.Microarray-based screening of differentially expressed genes in glucocorticoid?induced avascular necrosis[J].Mol Med Rep,2017,15(6):3583-3590.
[7]XU X,WEN H,HU Y,et al.STAT1-caspase 3 pathway in the apoptotic process associated with steroid-induced necrosis of the femoral head[J].Journal of Molecular Histology,2014,45(4):473-485.
[8]LIU R,LIU Q,WANG K,et al.Comparative analysis of gene expression profiles in normal hip human cartilage and cartilage from patients with necrosis of the femoral head[J].Arthritis Research&Therapy,2016,18(1):98.
[9]SUN M,CONNIZZO B K,ADAMSSM,et al.Targeted deletion of collagen V in tendons and ligaments results in a classic ehlers-danlos syndrome joint phenotype[J].American Journal of Pathology,2015,185(5):1436.
[10]NAKAJIMA M, KIZAWA H, SAITOH M, et al.Mechanisms for asporin function and regulation in articular cartilage[J].Journal of Biological Chemistry,2007,282(44):32185-32192.
[11]TANAKA K,MATSUMOTO E,HIGASHIMAKI Y,et al.Role of osteoglycin in the linkage between muscle and bone[J].Journal of Biological Chemistry,2012,287(15):11616-11628.
[12]PETRETTO E, SARWAR R, GRIEVE I, et al.Integrated genomic approaches implicate osteoglycin(Ogn)in the regulation of left ventricular mass[J].Nature Genetics,2008,40(5):546-552.
[13]STECK E,BRAUN J,PELTTARIK,et al.Chondrocyte secreted crtac1:a glycosylated extracellular matrix molecule of human articular cartilage[J]. Matrix Biology,2007,26(1):30.
[14]DJINOVIC-CARUGO K,GAUTEL M,YLANNE J,et al. The spectrin repeat: a structural platform for cytoskeletal protein assemblies[J].Febs Letters,2002,513(1):119.
[15]SAMUEL CS,HEWITSON TD,UNEMORIEN,et al.Drugs of the future:the hormone relaxin[J].Cellular&Molecular Life Sciences Cmls,2007,64(12):1539-1557.
[16]MIYAZONO K,KUSANAGI K,INOUE H.Divergence and convergence of TGF-beta/BMP signaling[J].Journal of Cellular Physiology,2001,187(3):265.
[17]SEKIYA I,LARSON B L,VUORISTO J T,et al.Adipogenic differentiation of human adult stem cells from bonemarrow stroma(MSCs)?[J].Journal of Bone&Mineral Research the Official Journal of the American Society for Bone& Mineral Research,2004,19(2):256.
[18]VUGT R M V,SIJBRANDIJ E S,BIJLSMA JW J.Magnetic resonance imaging of the femoral head to detect avascular necrosis in active rheumatoid arthritis treated with methylprednisolone pulse therapy[J].Scandinavian Journal of Rheumatology,1996,25(2):74.
[19]OKAZAKI S, NISHITANI Y, NAGOYA S, et al.Femoral head osteonecrosis can be caused by disruption of the systemic immune response via the toll-like receptor 4 signalling pathway[J].Rheumatology,2009,48(3):227.
[20]GACON G,METTOUCHIA,LEMICHEZ E.The tumor suppressor HACE1 targets Rac1 to ubiquitin-mediated proteasomal degradation[J].Med Sci,2012,28(1):39-41.
[21]ICHISEKI T, KANEUJI A, UEDA Y, et al.Osteonecrosis development in a novel rat model characterized by a single application of oxidative stress[J].Arthritis&Rheumatism,2011,63(7):2138.
[22]MURATA M, KUMAGAI K, MIYATA N, et al.Osteonecrosis in stroke-prone spontaneously hypertensive rats:effect of glucocorticoid[J].Journal of Orthopaedic Science,2007,12(3):289-295.
[23]CETINBASN,DAUGAARD M,MULLEN A R,et al.Loss of the tumor suppressor Hace1 leads to ROS-dependent glutamine addiction[J].Oncogene,2015,34(30):4005-4010.
[24]LIU H,YANG X,ZHANGY,et al.Fullerolantagonizes dexamethasone-induced oxidative stress and adipogenesis while enhancing osteogenesis in a cloned bone marrow mesenchymal stem cell[J].Journal of Orthopaedic Research,2012,30(7):1051-1057.
[25]DAUGAARD M,NITSCH R,RAZAGHI B,et al.Hace1 controls ROS generation of vertebrate Rac1-dependent NADPH oxidase complexes[J]. Nature Communications,2013,4(4):2180.
[26]IZUMI N,HELKER C,EHLING M,et al.Fbxw7 controls angiogenesis by regulating endothelial notch activity[J].Plos One,2012,7(7):e41116.
[27]NAKATSUKA A,WADA J,HIDA K,et al.RXR antagonism induces G0/G1 cell cycle arrest and ameliorates obesity by up-regulating the p53-p21(Cip1)pathway in adipocytes[J].Journal of Pathology,2012,226(5):784.
[28]ONOYAMA I,SUZUKI A,MATSUMOTO A,et al.Fbxw7 regulates lipid metabolism and cell fate decisions in the mouse liver[J].Journal of Clinical Investigation,2011,121(1):342-354.
[29]RYBA N J,TIRINDELLI R.A novel GTP-binding protein gamma-subunit,G gamma 8,is expressed during neurogenesis in the olfactory and vomeronasal neuroepithelia[J].Journal of Biological Chemistry,1995,270(12):6757-6767.
[30]SILLE F C,THOMAS R,SMITH M T,et al.Post-GWAS functional characterization of susceptibility variants for chronic lymphocytic leukemia[J].PLoS One.2012,7(1):e29632.
[31]HERBERT SP,STAINIER D Y R.Molecular control of endothelial cell behaviour during blood vessel morphogenesis[J].Nature Reviews Molecular Cell Biology,2011,12(9):551-564.
[32]LIX,YANG Y,FANG J,et al.FIZZ1 could enhance the angiogenic ability of rat aortic endothelial cells[J].International Journal of Clinical&Experimental Pathology,2013,6(9):1847-1853.
[33]WANG B Y,HANG JY,ZHONG Y,et al.Association of genetic polymorphisms of SAA1(rs12218) with myocardial infarction in a Chinese population[J].Genetics& Molecular Research Gmr,2014,13(2):3693-3696.
[34]XIANG X,MA Y T,YANG Y N,et al.Polymorphisms in the SAA1/2 gene are associated with carotid intima media thickness in healthy han chinese subjects:the cardiovascular risk survey[J].Plos One,2010,5(11):e13997.
[35]XIE X,MA Y T,YANG Y N,et al.Association of genetic polymorphisms of serum amyloid protein A1 with plasma high density lipoproteins cholesterol[J].Zhonghua Yi Xue Za Zhi,2010,90(26):1824-1826.
[36]XIE X,MA Y T,YANG Y N,et al.Serum uric acid levels are associated with polymorphism in the SAA1 gene in chinese subjects[J].Plos One,2012,7(6):1634-1634.
[37]XIE X,MA Y T,YANG Y N,et al.Polymorphisms in the SAA1 gene are associated with ankle-to-brachial index in han chinese healthy subjects[J].Blood Press,2011,20(4):232-238.
[38]XU X L,SUN X T,PANG L,et al.Rs12218 In SAA1 gene was associated with serum lipid levels[J].Lipids in Health&Disease,2013,12(1):1-4.
[39]FENG Z P,LI X Y,RONG J,et al.Associations of SAA1 gene polymorphism with lipid lelvels and osteoporosis in chinese women[J].Lipids in Health&Disease,2013,12(1):1-5.

