淋巴管密度、微血管密度与VEGF在胃癌中的生物学意义
沈源, 保丽玲, 吴桂霞, 滕佳, 张晓坤
(1.云南省第一人民医院急诊内科,云南昆明650032;2.昆明医科大学海源学院,云南昆明650101)
胃癌是一种严重威胁人类健康的常见消化系统恶性肿瘤,尽管随着医学的发展,在多种辅助治疗手段下,以手术为主的综合治疗取得了一定的疗效,但胃癌的预后效果仍不理想,这主要归咎于恶性肿瘤具有局部浸润和远处转移的能力.实体肿瘤的生长需要新的血管,而恶性肿瘤常见的转移方式主要是淋巴道和血道转移,两种转移途径存在着相互和广泛联系,单纯阻断某一条转移途径并不能很好控制肿瘤细胞的转移.
血管内皮生长因子(vascular endothelia growth factor,VEGF)是一种作用于血管内皮细胞并在生理以及病理过程中调节血管内皮细胞增殖与新生血管形成的血管内皮生长因子[1],可诱导肿瘤淋巴管形成[2].CD105在肿瘤血管新生中发挥重要作用,同时是肿瘤新生血管较好的标记物.D2-40是肿瘤淋巴管的特异标记物,不参与血管内皮反应,只参与新生淋巴管内皮细胞、微小淋巴管内皮细胞反应.本实验采用免疫组织化学法,检测胃癌癌组织中VEGF的表达,同时采用CD105和D2-40分别标记组织中血管密度(microvessel density,MVD)与淋巴管密度(lymphatic vessel density,LVD),研究VEGF表达在胃癌中的临床病理学意义及其与肿瘤微血管和微淋巴管生成的关系,为胃癌的治疗及预后判断提供实验依据.
1 材料与方法
1.1 标本来源
48例标本选自昆明医科大学第二附属医院病理科2009年1月至2014年6月间存档蜡块,所有病例均为手术切除,患者术前均无辅助化疗及内分泌治疗史,其中男27例,女21例,年龄35~89岁.经病理医师证实均为进展期胃腺癌,其中高、中分化腺癌(包括乳头状腺癌或管状腺癌)24例,低分化腺癌(包括粘液腺癌、印戒细胞癌和未分化癌)24例,侵及浆膜周围软组织者28例,有淋巴结转移者28例,同时依据病人年龄大小、肿瘤大小、分化程度、浸润深度及淋巴结转移进行分组.另取43例切缘不典型增生组织(均病理证实无癌组织)以及29例距癌肿边缘10 cm以上的正常胃组织作对照.
1.2 试剂
CD105鼠抗人转化生长因子免疫单克隆抗体,克隆号(SN6H),D2-40鼠抗人单克隆抗体,克隆号(D2-40),VEGF鼠抗人血管内皮生长因子免疫组化单克隆抗体,克隆号(VG1)及DAB显色试剂盒均购于福州迈新生物技术开发有限公司.
1.3 方法
所有组织常规脱水,石蜡包埋,连续切片,分别用于常规HE和免疫组织化学染色,程序严格按照SP法试剂盒说明书进行,设置阴性对照组,进行VEGF、CD105和D2-40免疫组织化学染色.
1.4 结果观察与判断
VEGF表达于细胞胞浆和(或)细胞核出现棕色颗粒为阳性显色,按照乔宏等[3]的标准进行判断.①选染色均匀的阳性表达区域,以着色细胞占视野细胞总数的比例计分:无阳性细胞为0分;阳性细胞数占比≤25%为1分;26%~50%为2分;>50%为3分.②按着色细胞染色强弱计分:无着色为0分;淡黄色为1分;棕黄色为2分;深棕色为3分.免疫组化结果以着色细胞计数与染色强度乘积表示,判断结果:0~3为(-);4~9为(+).
MVD与LVD计数按 Weidner评判标准[4]进行:先在低倍镜(100倍)下全面观察切片,确定脉管密度最高处(即hot spot),凡棕黄色颗粒单个内皮细胞或条索状内皮细胞簇均为1个阳性脉管计数,再于高倍光镜下200倍(0.74 mm2)视野下计数,每例计数3个视野,取其均值为该病例血管密度或淋巴管密度.
1.5 统计学分析
统计学分析采用SPSS 18.0软件,计量资料以(均数±标准差)(±s)表示,各组间数据比较依据资料的性质,采用t检验或方差分析,P<0.05为有统计学意义.
2 结果
CD105染色阳性为棕褐色或者棕黄色,定位于小血管内皮细胞的胞浆(图1),胃癌组织内的微血管,形状不规则,呈簇状或管状.D2-40染色定位于淋巴管内皮细胞的胞浆,在胃癌组织中标记出淋巴管,肿瘤边缘淋巴管腔较小(图2),单层,内无红细胞(图3),淋巴管形态各异,呈孤立、环形或隙状,簇状或条索状分布,有的细长,有的弯曲,有的呈线型[5].VEGF表达定位于细胞浆,呈棕黄色颗粒.在正常组、不典型增生组及胃癌组中的表达程度不一,高表达主要见于胃癌组织的癌细胞(图4).

图1 CD105在胃癌组织中免疫组织化学检测(SP×800)Fig.1 The rusulits of immunohistochemistry of CD105 in gastric carcinoma(SP×800)
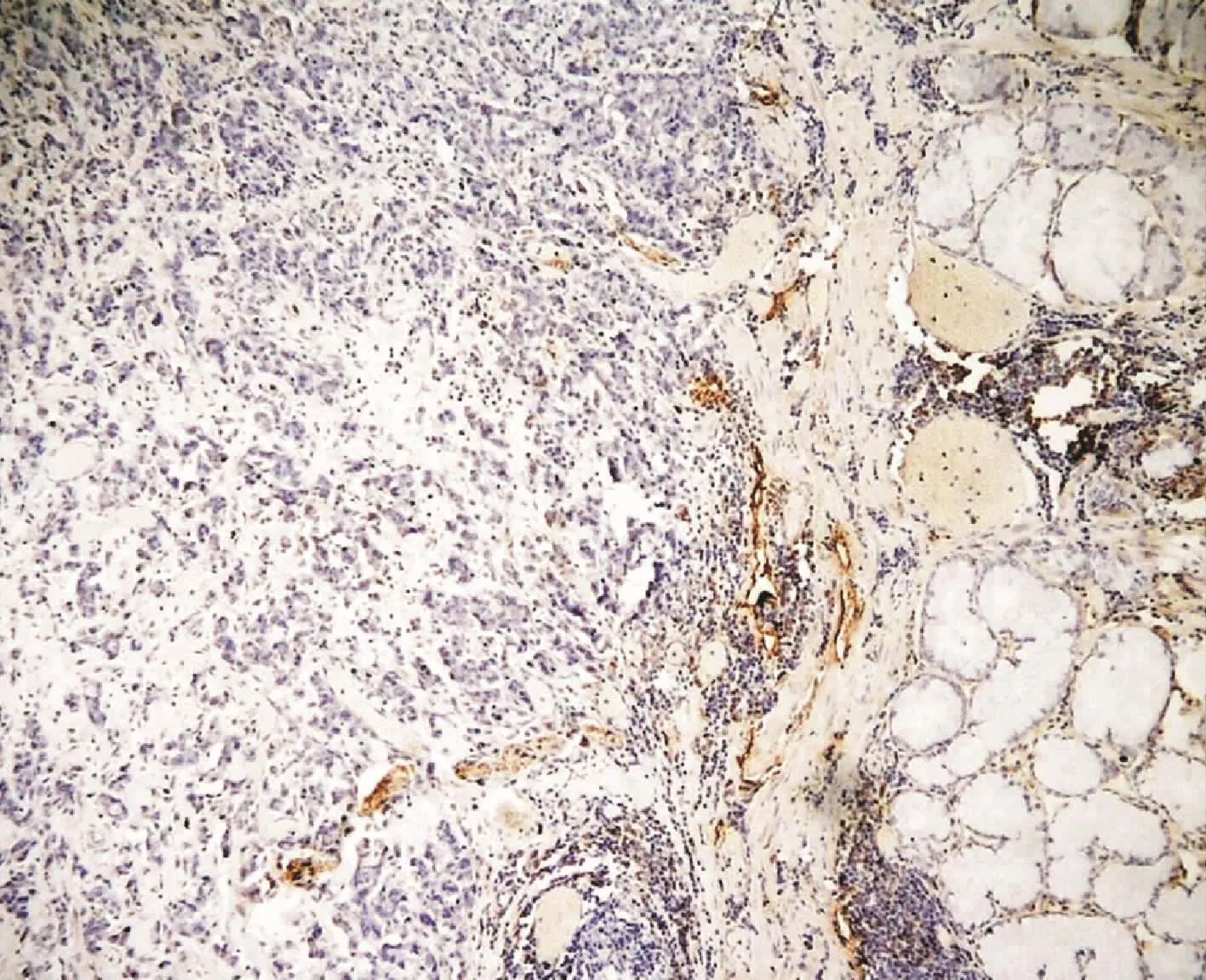
图2 D2-40在胃癌组织中免疫组织化学检测(SP×200)Fig.2 The rusulits of immunohistochemistry of D2-40 in gastric carcinoma(SP×200)
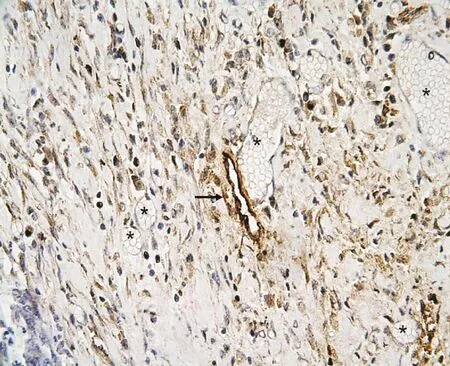
图3 D2-40在胃癌组织中表达(SP×800)Fig.3 The rusulits of immunohistochemistry of D2-40 in gastric carcinoma(SP×800)
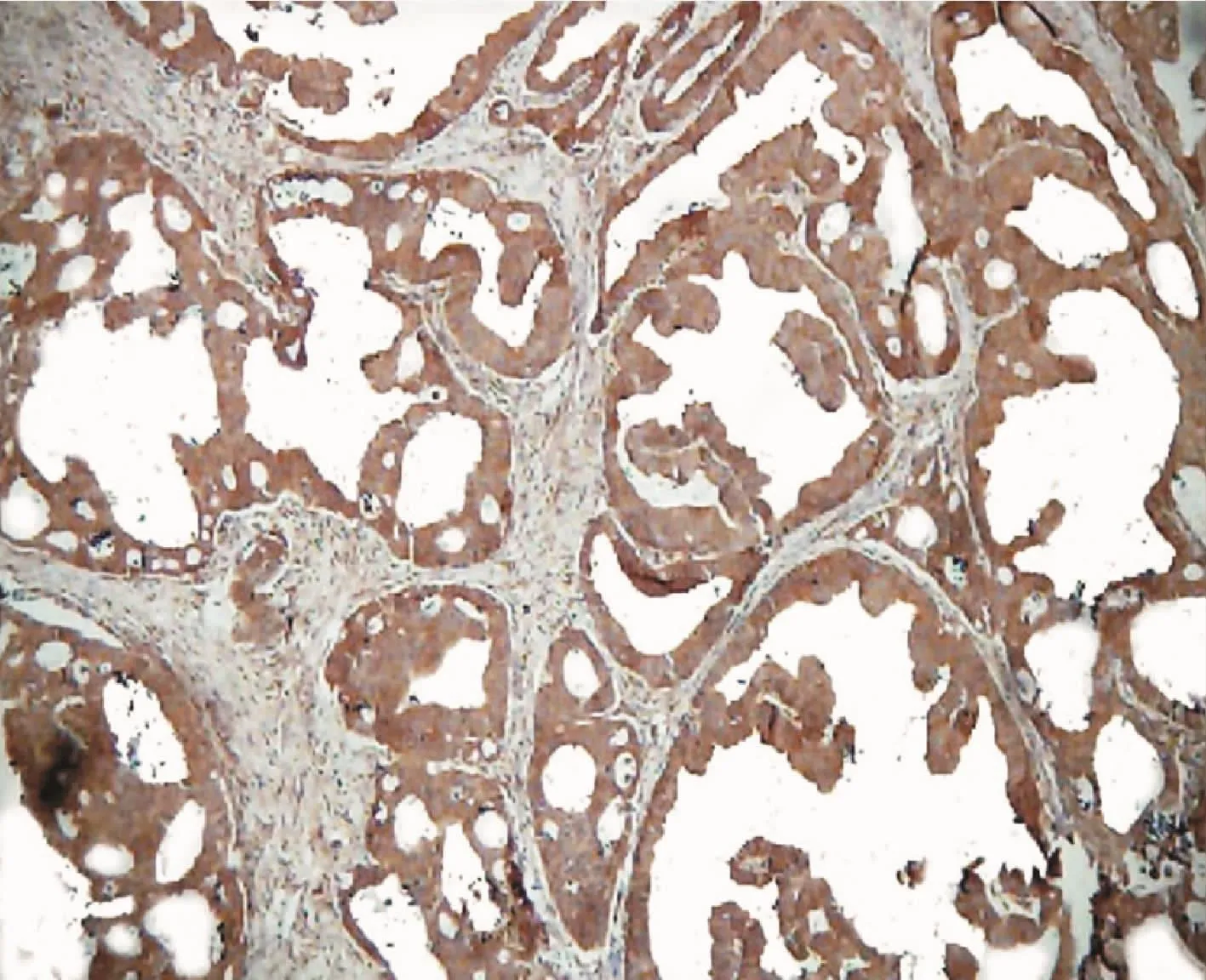
图4 VEGF在胃癌组织中免疫组织化学检测(SP×200)Fig.4 The rusulits of immunohistochemistry of VEGF in gastric carcinoma(SP×200)
2.1 MVD、LVD和VEGF统计结果
CD105标记的MVD值在正常组、不典型增生组、肿瘤组分别为(3.43±0.67)、(7.94±0.86)和(15.17±1.19);D2-40标记的 LVD值在正常组、不典型增生组和胃癌组分别为(4.60±0.68)、(8.11±0.66)和(16.16±3.01);VEGF免疫组化检测结果的29例正常组织中,25例(-),4例(+),阳性率为14%;43例非典型增生组织中,23例(-),20例(+),阳性率为53%;48例胃癌组织中,11例(-),37例(+),阳性率为77%.在胃癌组织内的VEGF,MVD,LVD较正常胃组织、不典型增生胃组织明显增高,均有统计学差异(P<0.05).
2.2 MVD、LVD和VEGF表达与临床病理因素之间的关系
MVD值在淋巴结转移组(15.58±1.21)显著高于无转移组(14.43±0.69),两者有统计学差异(P=0.009),浸润深度上,T3、T4期(19.97±1.86)高于浸润较浅的 T1、T2期(14.50±0.76)两者有统计学差异(P=0.002),MVD在分化程度、患者性别、年龄上无差异(表1).
LVD值在淋巴结转移组(17.96±3.09)显著高于无转移组(14.11±0.82),两者有统计学差异(P<0.001);分化程度上,高、中分化(19.39±1.96)高于低分化(14.01±0.81)两者有统计学差异(P=0.008),浸润深度上,T3、T4期(19.13±2.10)高于浸润较浅的 T1、T2期(13.89±0.66)两者有统计学差异(P<0.001),LVD在患者性别、年龄上无差异(表1).
VEGF标记的表达强度在淋巴结转移组(6.90±2.20)显著高于无转移组(5.0±3.08),两者有统计学差异(P=0.25),浸润深度上,T3、T4期(7.17±1.90)高于浸润较浅的 T1、T2期(4.45±3.07)两者有统计学差异(P=0.001),VEGF在分化程度、患者性别、年龄上无差异(表1).
表1 胃癌区MVD、LVD和VEGF与临床病理学参数间的关系Table 1 MVD、LVD ang VEGF of human gastric cancer and clinicopathological parameters(±s)

表1 胃癌区MVD、LVD和VEGF与临床病理学参数间的关系Table 1 MVD、LVD ang VEGF of human gastric cancer and clinicopathological parameters(±s)
0.009 <0.001 0.025无20 14.43±0.69 14.11±0.82 5.0±3.08有28 15.58±1.21 17.96±3.09 6.90±2.20分化程度 0.32 0.008 0.515高、中分化 24 14.78±1.34 19.39±1.96 5.57±2.64低分化 24 15.54±0.90 14.01±0.81 6.14±3.18浸润深度 0.002 <0.001 0.001 T1、T2期 20 14.50±0.76 13.89±0.66 4.45±3.07 T3、T4期 28 19.97±1.86 19.13±2.10 7.17±1.90性别 0.96 0.12 0.382男27 17.33±3.27 15.19±2.23 6.23±3.18女21 17.27±3.02 16.91±3.36 5.45±2.60年龄/岁 0.22 0.29 0.778≤50 18 16.53±3.17 15.48±2.47 5.67±3.16淋巴结转移>50 30 17.73±3.04 16.68±3.34 5.93±2.80
2.3 VEGF和 MVD、LVD的关系
VEGF表达阳性组的平均MVD为(15.54±6.00)高于阴性组(10.24±6.32)两者差异有统计学意义(P<0.001),而在 VEGF阳性组的平均LVD(16.06±7.09)和阴性组(18.7±8.68)之间无统计学差异(P=0.57).
3 讨论
胃癌是一种常见消化道肿瘤,随着分子生物学的发展,对胃癌的演变过程、浸润转移及预后有了更进一步的研究.肿瘤组织中血管的生成和淋巴道转移是影响胃癌患者预后和死亡的重要因素,抑制血管生成和淋巴道转移是控制肿瘤生长、转移和复发的有效策略之一,可能成为肿瘤治疗的新靶点.
CD105是80年代中期发现的一类新的细胞粘附因子,又名Endoglin,一种同型二聚体细胞膜糖蛋白,分子质量为180 ku,是转化生长因子-β(TGF-β)受体复合物成分,能独立存在于细胞的表面,可调节细胞对TGF-β的反应,促进血管生成,参与肿瘤分化、生长、转移和复发.在血管内皮细胞中有丰富的表达[6].在肝癌[7]、乳腺癌[8]等肿瘤中,CDl05可以成功标记新生血管,且明显优于CD34、Ⅷ因子等血管标记物[9],而在正常组织的血管中则很少表达.由于CD105在恶性肿瘤组织中的表达可反映肿瘤血管生成和血管内皮细胞活跃情况,所以CD105的高表达可作为恶性肿瘤转移及预后判断的指标之一[10].
D2-40是新近发现的一种单克隆抗体,可与一种40 ku的唾液酸糖蛋白M2A[11-12]特异性结合,最初发现它是一种与生殖细胞肿瘤和胎儿睾丸精原细胞相关的唾液酸糖蛋白,可与M2A肿瘤胚胎性抗原特异性结合[13],M2A仅表达于淋巴管内皮而不表达于血管内皮,临床研究证明与M2A特异相结合的D2-40选择性地表达于淋巴管内皮,以区别于血管内皮,在实验研究中可用能标记淋巴管内皮,便于鉴别血管内皮,其特异性明显高于目前常用的淋巴管标记物 VEGF-C、VEGFR-3等,是最具有特异性淋巴管标记物[14].
VEGF是目前所知的作用最强的血管生成刺激因子[15]之一.VEGF与酪氨酸激酶受体VEGFR-1、VEGFR-2和VEGFR-3等结合,激活下游信号通路,刺激血管生成[16].VEGF可特异地作用于血管内皮细胞,促进其增殖,同时可间接抑制支持细胞的聚集,导致内皮细胞之间、内皮细胞与支持细胞之间、内皮细胞与基质之间的相互作用减弱,破坏血管结构原有的稳定性,由此引起毛细血管出芽及生长,形成新生血管;另外,VEGF还能提高血管壁通透性使血浆蛋白渗到血管外,并使渗到血管外的血浆蛋白形成纤维蛋白凝块,后者成为新生血管的支持物[17].现有大量实验研究证明,在许多肿瘤组织中VEGF表达增高,且其水平高低与肿瘤的某些生物学行为有密切关系[18-19].
本实验中,VEGF及 CD105标记的 MVD、D2-40标记的LVD表达在正常胃组织和非典型增生组中低于胃癌组;而且3者在浸润较浅以及无淋巴结转移癌中的表达均较弱,在浸润较深以及有淋巴结转移的癌中表达均增强,而且,VEGF阳性组的MVD显著高于阴性组均符合上述理论.
肿瘤组织中的LVD也与肿瘤的淋巴结转移和浸润深度呈正相关,刘新兰等[20]认为VEGF与其受体结合后也能促进新生淋巴管的形成,但本研究发现LVD在VEGF阳性组和阴性组之间无统计学差异.本实验观察发现胃癌中央淋巴管稀少、且大多闭锁状态,这一现象与部分研究结果相同[21-22],可能是由于瘤细胞生长过快挤压中央淋巴管使其变扁萎缩,成为无功能性淋巴管,同时增加了淋巴管的计数的难度,当然,也可能是肿瘤淋巴管生成其他因素的影响,有待进一步研究.
此外,肿瘤细胞分泌的VEGF,可导致周围间质中新生的脉管生成,而对这种刺激,无论患者年龄大或小,其机体的反应可能都是一致的,所以MVD、LVD与患者年龄、性别上均无差异.
综上,本研究结果显示VEGF可促进肿瘤血管的新生,从而促进肿瘤的生长和转移;淋巴管的增多可促进肿瘤的淋巴转移[23].可见,VEGF、CD105、D2-40在肿瘤的发生、发展过程中起重要作用.肿瘤MVD、LVD较高者出现较强的侵袭能力和转移能力.通过联合运用VEGF和CD105标识MVD和D2-40标记LVD可较好地预测胃癌患者的淋巴转移风险,指导临床的治疗、预后评估和治疗选择.
[1]SAHARINEN P,TAMMELA T,KARKKAINEN M J,et al. Lymphatic vasculature: development, molecular regulation and role in tumormetastasis and inflammation[J].Trends in Immunology,2004,25(7):387-395.
[2]KARPANEN T,ALITALO K.Lymphatic vessels as targets of tumor therapy[J].Journal of Experimental Medicine,2001,194(6):F37-42.
[3]乔宏,杜进荣,付红,等子宫内膜样癌微血管密度及血管内皮生长因子表达的研究[J].哈尔滨医科大学学报,2002,36(1):23-25.QIAO H,DU J R,FU H,et al.Study of microvessel density and the expression of vascular endothelial growth factor in endometrial carcinoma[J]Journal of Harbin Medical University,2002,36(1):23-25.
[4]WEIDNER N,SPMPLE JP,WELCH W R,et al.Tumor angiogenesis and metastasis-correlation in invasive breast carcinoma[J].N Engl JMed,1991,324(1):1-8.
[5]AGARWAL B,SAXENA R,MORIMIYA A,et al.Lymphangiogenesis does not occur in breast cancer[J].Am JSurg Pathol,2005,29(11):1449-1455.
[6]王玥,刘爱东,庞久玲,等.CDl05在结直肠腺癌组织中的表达及意义[J].山东医药,2007,47(20):140-141.WANG Y,LIU A D,PANG J L,et al.Expression and clinicopathological significance of CD105 in colorectal cancer[J].Shandong Medical Journal,2007,47(20):140-141.
[7]YAO Y,PAN Y,CHEN J,et al.Endodin(CDl05)expression in angiogenesis of primary hepatocellular carcinomas:analysis tissue microarrays and comparisons with CD34 and VEGF[J].Ann Clin Lab Sic,2007,37(1):39-48.
[8]GRUDZINSKIM,CAMBRUZZI E,LAHUDE E,et al.Cox-2 and CDl05 expression in breast cancer and diseasefree survival[J].Rev Assoc Med Bras,2006,52(4):275-280.
[9]DING S,LI C,LIN S,et al.Comparative evaluation of microvessel density deternmined by CD34 or CDl05 in benign and malignant gastric lesions[J].Hum Pathol,2006,37(5):861-866.
[10]牛保华,皇甫超申,赵卫,等.CD105及微血管密度与胃癌的关系[J].河南大学学报(医学版),2008,27(2):24-25.NIU B H,HUANGPU C S,ZHAOW et al.Relationship between CD105 and MVD of colorectal carainoma[J].Journal of Henan University(Medical Science),2008,27(2):24-25.
[11]SUBHOJIT R,ALBERT C,JOHN Q,et al.D2-40,a novelmonoclonal antibody against the M2A antigen as a marker to distinguish hemangioblastomas from renal cell carcinomas[J].Acta Neuropathologica,2005,109(5):497-502.
[12]MARKS A,SUTHERLAND D R,BAILEY D,et al.Characterization and distribution of an oncofetal antigen(M2A antigen)expressed on testicular germ cell tumours[J].Br JCancer,1999,80(3/4):569-578.
[13]PUSZTASZERI M P, SEELENTAG W, et al.Immunohistochemical expression of endothelial markers CD31,CD34,yon Willebrand factor and Fli-1 in nonnal human tissues[J].Journal of Histochemistry and Cytochemistry,2006,54(4):385-395.
[14]GIORGADZE T A,BALOCH Z W,PASHA T,et al.Lymphatic and blood vessel density in the follicular patterned lesions of thyroid.d[J].Mod Pathol,2005,18(11):1424-1431.
[15]HOMSIJ,DAUD A I.Spectrum of activity and mechanism of action of VEGF/PDGF inhibitors[J].Cancer Control,2007,14(3):285-294.
[16]CEBE-SUAREZ S,ZEHNDER-FJALLMAN A.The role of VEGF receptors in angiogenesis;complex partnerships[J].Cellular and Molecular Life Sciences,2006,63(5):601-615.
[17]REINDERS M E,SHO M,IZAWA A,et al.Prointlammatory functions of vaseula endothelial growth factor in alloimmunity[J].JClin Invest,2003,112(11):1655-1665.
[18]陈秀慧,曲军英.Ang-2及VEGF在早期宫颈癌中的表达及与血管及淋巴管密度的相关性[J].福建医药杂志,2011,33(1):4-7.CHEN X H,QU JY.Correlation between expression of Ang-2 and VEGF and the density of new blood vessels and lymphatic at early stage of cervical cancer development[J].Fujian Medical Journal,2011,33(1):4-7.
[19]KATO Y,ASANO K,MOGI T,et al.Clinical sig nificance of circulating vascular endothelial growth factor in dogs with mammary gland tumors[J].Vet Med Sci,2007,69(1):77-80.
[20]刘新兰,李亦工,马志兰.胃癌组织中VEGF-C、VGFR-3表达和微淋巴管密度的研究[J].宁夏医学杂志,2014,36(5):385-387;384.LIU X L,LIY G,MA Z L,et al.A study on expression of VEGF-C and VEGFR-3 and study on the lymphatic microvessel density in gastric carcinoma[J].Ningxia Medical Journal,2014,36(5):385-387;384.
[21]TOLL A,GIMENO-BELTRÁN J,FERRANDIZ-PULIDO C,et al.D2-40 immunohistochemical over expression in cutaneous squamous cell carcinomas:a marker of metastatic risk[J].Journal of the American Academy of Dermatology,2012,67(6):1310-1318.
[22]万琳琳,赵光明,展瑞,等.D2-40标记微淋巴管密度对乳腺癌淋巴结转移的临床意义[J].现代肿瘤医学,2015,15:2136-2138.WANG L L,ZHANO G M,ZHAN R,et al.Detection of D2-40 marked micro-lymphatic vessel density in the tissues of human breast cancer[J].Journal of Modern Oncology,2015,15:2136-2138.
[23]SUNDOV Z,TOMIC S,ALFIREVIC S,et al.Prognostic value of MVD,LVD and vascular invasion in lymph nodenegative colon cancer[J].Hepato-Gastroenterology,2013,60(123):432-438.

