m iR-132在人脐静脉内皮细胞中的生物学功能
陈 清, 符方勇, 黄显莹, 万 恒, 刘文俊, 刘正军
(南方医科大学南方医院血管外科,广东广州510515)
动脉粥样硬化是由多种原因造成胆固醇等脂质沉积于动脉内膜下,纤维组织增生和钙质沉着、斑块内出血和血栓形成,最终致动脉管壁变硬、管腔狭窄甚至闭塞而引发一系列的缺血性症状,动脉壁中的慢性炎症反应、脂质代谢异常、内皮损伤动脉粥样硬化发生发展中主要因素[1-3].黄显莹等[4]在实验中发现miR-132与脂代谢调控相关而脂代谢学说在动脉粥样硬化形成中占据重要地位.本研究探讨miR-132对内皮细胞生物学特性的影响及作用机制,为动脉粥样硬化的基因靶向治疗提供实验依据.
1 材料与方法
1.1 临床资料
收集南方医院2011年1月至2015年12月手术切除的动脉粥样硬化标本48例,其中男30例,女18例,年龄40~80岁,平均60岁.实验组为动脉粥样硬化组织,对照组为正常动脉组织,并经术后病理证实.获得患者的知情同意,并经本院医学伦理委员审核通过.
1.2 实验材料及来源
内皮细胞购买自中国科学院上海细胞库;胎牛血清和RPMI 1640培养液购自美国Gibco公司;miR-132-3p inhibitor、miR-Negative control(阴性对照)、内参U6购买自广州锐博生物科技公司,引物由上海生工生物合成,TRIzol、总RNA提取试剂盒、Lipofectamine2000购自美国Invitrogen公司,反转录试剂盒、实时荧光定量PCR试剂盒购自日本 Ta-KaRa公司.Caspase-GloH 3/7 Assay Systems购买自Promega公司.Cell Counting Kit-8(CCK-8)试剂盒购买自日本同仁公司;Annexin VFITC Apoptosis Detection试剂盒购买自BD公司;一抗anti-PCNA,KLF5,caspase-3,Bax,GAPDH,βactin购置Santa Cruz生物科技公司.
1.3 细胞培养及转染
用含质量分数为10%胎牛血清的RPMI1640培养液培养人脐静脉内皮细胞细胞,在37℃、体积分数为5%CO2的恒温培养箱中培养.选取对数期生长的细胞接种于6孔板上,待细胞融合度为75%左右时参照说明书用Lipo2000转染.miR-132 inhibitor转染实验分3组:空白对照组(Blank)、阴性对照组 miR-NC(miR-NC)、转染miR-132 inhibitor组.转染后24 h后于荧光显微镜下观察细胞荧光,检测转染效率.
1.4 Real-time PCR检测动脉粥样硬化标本组织及正常动脉组mRNA表达水平
TRIzol法提取组织或细胞的总RNA,按反转录试剂盒说明书合成cDNA,反转录条件:37℃15 min,85℃5 s.扩增体系采用SYBR Premix Ex Taq 10μL,上、下游引物各 0.5μL,提取的模板DNA 1μL,加去核酶水至20μL.扩增的条件:95℃ 30 s,95℃ 5 s、65℃ 30 s,40次循环.采用2-ΔΔCt法计算 miR-132的相对表达水平.U6的反转录引物:5′-GTCGTATCCAGTGCAGGGTCCGAGGTGCACTGGATACGACAAAATATGGAAC-3′,miRNA的定量PCR引物上下游引物分别为:5′-TGCGGGTGCTCGCTTCGGCAGC-3′和5′-CCAGTGCAGGGTCCGAGGT-3′.
1.5 CC-8法检测转染后内皮细胞增殖水平的改变
将转染后24 h的细胞,消化后收集细胞,按2.00×103个每孔接种到96孔板,每孔加入100μL单细胞悬液,各组设5个复孔.于种板后1~5 d进行检测,待细胞贴壁后,用CCK8分别测定1~5 d时细胞的增殖活性.检测前2 h,加入10μL/孔CCK8溶液,37℃孵育2 h,利用酶标仪上测定450 nm波长处各孔的吸光度值A.
1.6 流式细胞仪检测转染后细胞周期、凋亡情况
将转染后各组细胞,制成单细胞悬液并体积分数为75%乙醇固定,RNase A(质量分数为1 mg/mL)200μL,37℃孵育30min,与800μL碘化丙啶染色液混匀后,4℃避光染色30 min,使用FACSCalibur流式细胞仪检测细胞周期.收集转染后细胞,用磷酸缓冲盐溶液洗涤细胞沉淀1次,收集细胞沉淀;1 mL染色缓冲液重悬细胞;取100μL重悬细胞液加入5μL Annexin V-APC染色,室温避光15 min后上机检测凋亡水平.
1.7 Western blot法检测转染后内皮细胞中增殖、凋亡、脂代谢相关基因的蛋白的表达水平
收集转染后的内皮细胞,加入提取缓冲液并收集其裂解液,BCA法测定蛋白浓度,根据蛋白浓度调节上样量,质量分数为10%浓度的SDSPAGE胶电泳后进行转膜,按分子量大小剪下相应大小的PVDF膜在质量分数为5%脱脂奶粉封闭液中行抗原封闭,加入一抗孵育,洗膜后孵育二抗后进行显影、定影.
1.8 统计学方法
所有实验数据均经SPSS 20.0统计软件分析.实验均重复3次,计量资料以(均数±标准差)表示,组织分析采用两独立样本的t检验,多组数据比较采用单因素方差分析,进一步两两比较采用SNK-q检验.P<0.05为有统计学差异.
2 结果
2.1 Real-time PCR检测动脉粥样硬化及正常动脉组织中的m iR-132-3p的表达
结果显示与正常动脉组织相比较,动脉粥样硬化组织中miR-132-3p的表达明显降低(t=15.47,P<0.000 1,图 1).
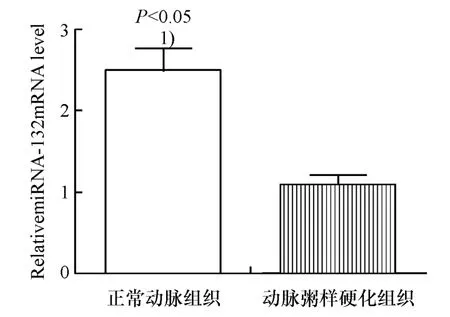
图1 Real-time PCR检测动脉粥样硬化及正常动脉组织中miR-132的表达水平Fig.1 Detection of miR-132 expression in abmormal and normal arterial tissue by real-time PCR
2.2 Real time PCR检测内皮细胞转染后m iR-132-3p的表达水平
Real time PCR检测结果显示miR-132-3p inhibitor组为(1.424±0.09)、miR-NC组为(0.90±0.15),Blank组为(1.12±0.12),与 Blank和 miRNC组比较,miR-132 inhibitor组细胞miR-132-3p表达水平降低,有统计学差异(F=81.83,P<0.000 1,图 2),表明转染成功.

图2 miR-132-3p inhibitor转染内皮细胞后miR-132-3p表达水平Fig.2 Detection of miR-132 expression in endothelial cells after transfected with miR-132-3p inhibitor
2.3 CCK8法检测转染后的内皮细胞增殖水平
与Blank及miR-NC组比较,从第3天开始miR-132 inhibitor组内皮细胞增殖能力较Blank与 miR-NC组明显增强(P<0.001,图 3),Blank与miR-NC组相比较,无统计学差异.
2.4 流式细胞术分析内皮细胞转染后细胞凋亡的变化
Blank、miR-NC、miR-132 inhibitor组分别为(6.21±1.36)%、(15.34±1.68)%、(28.38±2.74)%.miR-132 inhibitor组较 Blank及 miR-NC组细胞凋亡率明显降低,有统计学差异(图4).

图4 miR-132对人脐静脉内皮细胞凋亡的影响Fig.4 Effects ofmiR-132 on apoptosis of human umbical vein endothelial cells
2.5 m iR-132-3p抑制增殖相关基因 PCNA和KLF5的表达
为进一步明确机制miR-132-3p抑制人脐静脉内皮细胞增殖分子机制,Western blot实验检测人脐静脉内皮细胞内增值细胞核抗原(proliferating cell nuclear antigen,PCNA)和转录因子 5(kruppel-like factors,KLF5)表达及活性,相较于NC组,转染inhibitor,细胞PCNA和KLF5表达升高(图5).提示miR-132-3p抑制人脐静脉内皮细胞增殖分子机制可能与PCNA和KLF5的表达有关,miR-132-3p可能通过激活PCNA和KLF5依赖性增殖机制抑制HUVEC增殖.
2.6 miR-132-3p促进凋亡相关基因caspase-3和Bax的表达
为进一步明确机制miR-132-3p促进人脐静脉内皮细胞凋亡分子机制,Western blot检测人脐静脉内皮细胞内凋亡相关基因胱天蛋白酶Caspase-3和凋亡相关基因Bax表达及活性,相较于NC组,转染inhibitor,细胞Caspase-3和 Bax表达下调(图6).提示miR-132-3p促进人脐静脉内皮细胞凋亡分子机制可能与Caspase-3和Bax的表达有关,miR-132-3p可能通过激活Caspase依赖性凋亡机制诱导HUVEC死亡.
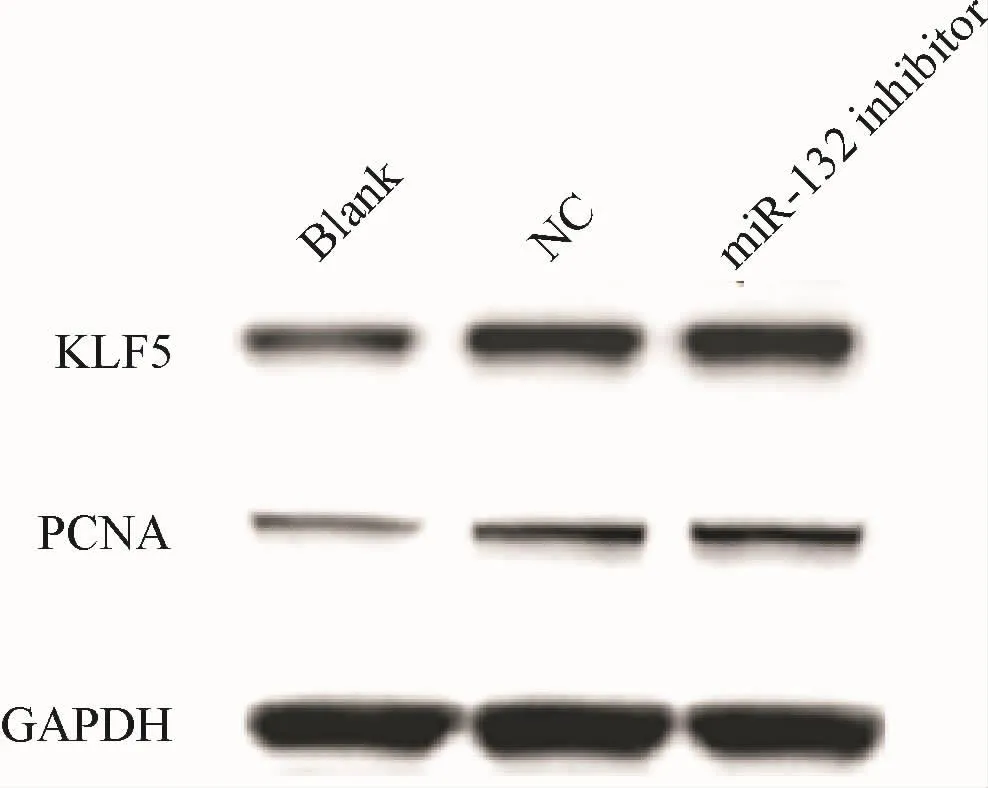
图5 miR-132抑制增殖相关基因PCNA和KLF5的表达Fig.5 miR-132 inhibits the expression of PCNA and KLF5 proliferation related genes
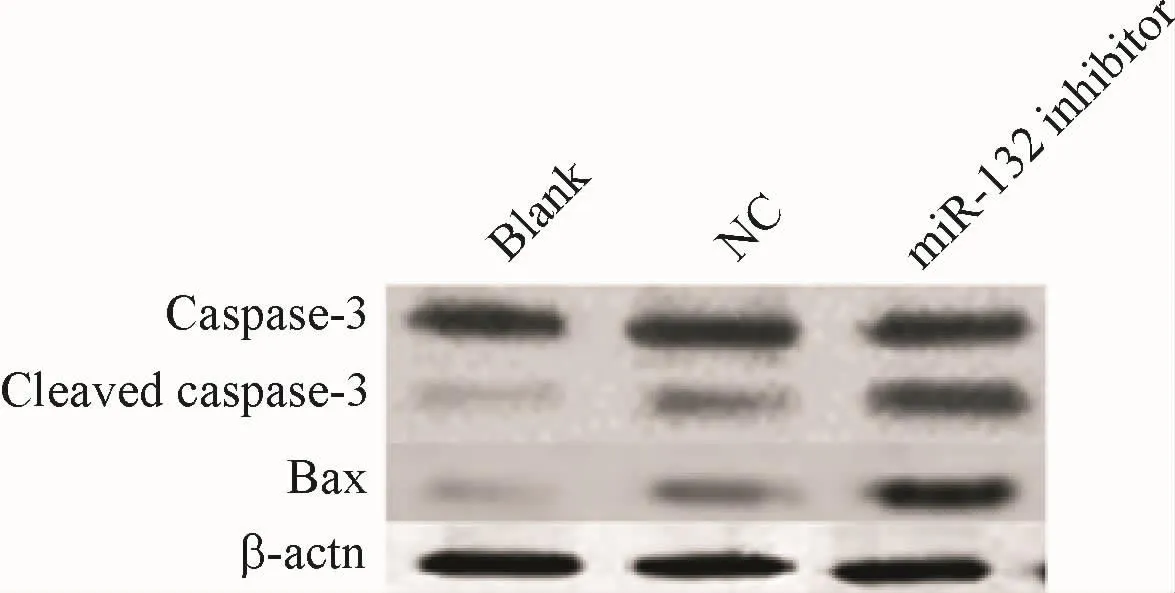
图6 miR-132促进凋亡相关基因Caspase-3和Bax的表达Fig.6 miR-132 promotes expression of Caspase-3 and Bax apoptosis related gene
3 讨论
研究表明,动脉粥样硬化是血管壁长期过度炎症刺激引起的结果,其通常以内皮中的炎性变化开始[5-6].基因水平的治疗是动脉粥样硬化研究中的热点,且急需寻求有效的基因治疗靶点.目前研究表明miRNA具有广泛的基因调节功能,参与一系列的生物学进程,如胚胎的发育、细胞增殖与凋亡和造血功能等.有学者研究动脉粥样硬化的发生、发展时发现,miRNA常表达失调,恶性生物学表型和某些miRNA有着密切的关系[7-8].miR-132在动脉粥样硬化形成中占据重要地位[9-10].
本研究小组前期研究显示miR-132-3p能够抑制 SIRT1,SREBP-1c及其下游基因表达,而SREBP-1c控制并参与脂肪酸、脂质和胆固醇生物合成相关基因[11-13],在本研究中,miR-132-3p能够抑制HUVEC中脂肪酸和胆固醇的生成,表明miR-132-3p能够通过抑制SIRT1和SREBP-1c表达和下调其靶向基因包括FASN和HMGCR可抑制HUVEC中的脂质生成和胆固醇生成.miRNA影响血管内皮细胞的功能,参与血管平滑肌细胞的迁移和增殖并在动脉粥样硬化的形成过程中,血管壁细胞,如EC和VSMC的变化发挥了重要作用.内皮细胞功能障碍增加内皮层的通透性和相应细胞因子和黏附分子的表达,减少内皮层的再生.VSMC的迁移及增值则促进粥样斑块的形成,加速冠状动脉粥样硬化的进程.而内皮细胞和平滑肌的功能障碍及迁移、增殖均可受miRNA的调控[14].
本研究结果显示动脉粥样硬化组织中miR-132-3p的表达水平较正常组织明显降低,将miR-132-3p inhibitor转染入内皮细胞中,使miR-132-3p表达水平受抑制,CCK8实验提示下调miR-132-3p的表达能明显抑制内皮细胞的增殖能力.流式细胞仪分析细胞凋亡结果提示抑制miR-132-3p的表达水平,G0/G1期的细胞数明显增加,表明miR-132表达下降可以影响内皮细胞周期,而同时细胞凋亡数目明显增多,凋亡率增高.
另外,下调miR-132-3p表达水平后内皮细胞增殖受抑制并促进其凋亡;PCNA与Klfs是一类与增殖相关的基因,PNCA表达水平和细胞增殖的结果相关,其表达水平的改变与细胞增殖情况相符[15].当细胞处于静止状态时,PCNA表达水平低,当细胞处于增殖状态时,PCNA表达水平迅速升高.因此.PCNA的表达水平高低能够作为细胞评价细胞增殖状态指标[16].KLFs是与转录相关的一类转录因子,参与到早期血管形成,癌症发生等一系列生理过程[17].KLF5是KLF基因家族成员,KLF5在增殖状态下检测表达水平升高明显[18]miR-132-3p通过抑制PCNA和KLF5表达,实现抑制细胞增值.因此,miR-132-3p能抑制HUVEC中的细胞增殖,存活力和迁移,并且也能诱导HUVEC的凋亡.
综上,miR-132-3p能够抑制人脐静脉内皮细胞中脂质和胆固醇的生成;miR-132-3p能够抑制内皮细胞的增殖与迁移能力,促进细胞的凋亡推测miR-132-3p能够抑制HUVEC细胞的增殖,并在体外诱导细胞凋亡,miR-132-3p通过调控相关基因的翻译调控内皮细胞增殖及其凋亡水平,表明miR-132-3p可能在动脉粥样硬化中作为一种促使基因,可作为治疗动脉粥样硬化的新靶点.
[1]CERSOSIMO E,DEFRONZO R A.Insulin resistance and endothelial dysfunction:the road map to cardiovascular diseases[J].Diabetes Metab Res Rev,2006,22(6):423-436.
[2]LEINNOEN M,SOIKLSU P.Infection and atherosclerosis[J].Scand Cardiovasc J,2002,34(2):12-20.
[3]OONI K,ALA-KORPEL M.Modified LDL-trigger of atherosclerosis and inflammation in the arterial intima[J].J Inter Med,2000,247:359-370.
[4]黄显莹,符方勇,陈清,等.miR-132诱导动脉粥样硬化中血管内皮细胞的促炎性作用.miR-132 induces the pro-inflammatory of vascular endothelial cells in atherosclerosis[J].实用医学杂志,2016,32(5):20-22.
[5]MOORE K,TABAS I.Macrophages in the Pathogenesis of atherosclerosis[J].Cell,2011,145(3):341-355.
[6]刘俊田.动脉粥样硬化发病的炎症机制的研究进展[J].西安交通大学学报(医学版),2015,36(2):141-152.
[7]RAITOHARJU E,LYYTIKÃINEN L P,LEVULA M,et al.miR-21,miR-210,miR-34a,and miR-146a/b are up-regulated in human atherosclerotic plaques in the tampere vascular study[J].Atherosclerosis,2011,219(1):211-217.
[8]VICKERS K C, REMALEY A T. MicroRNAs in atherosclerosis and lipoprotein metabolism.[J].Current Opinion in Endocrinology Diabetes&Obesity,2010,17(2):150.
[9]ZHANG L,HUANG D,WANG Q,et al.MiR-132 inhibits expression of SIRT1 and induces pro-inflammatory processes of vascular endothelial inflammation through blockade of the SREBP-1c metabolic pathway[J].Cardiovascular Drugs&Therapy,2014,28(4):303.
[10]CHOE N,KWON J S,KIM JR,et al.The microRNA miR-132 targets Lrrfip1 to block vascular smooth muscle cell proliferation and neointimal hyperplasia[J].Atherosclerosis,2013,229(2):348-355.
[11]COZZONE D,DEBARD C,Dif N,et al.Activation of liver X receptors promotes lipid accumulation but does not alter insulin action in human skeletal muscle cells[J].Diabetologia,2006,49(5):990-999.
[12]CALKIN A C,TONTONOZP.Transcriptional integration of metabolism by the nuclear sterol-activated receptors LXR and FXR[J].Nat Rev Mol Cell Biol,2012,13(4):213-224.
[13]IVASHCHENKO C Y,Bradley B T,AO Z H,et al.Regulation of the ADMA-DDAH system in endothelial cells:a novelmechanism for the sterol response element binding proteins,SREBP1c and-2[J].Am J Physiol Heart Circ Physiol,2010,298(2):H251-258.
[14]SCHOBER A,SCHOBER A,NAZARIJAHANTIGH M,et al.MicroRNA-126-5p promotes endothelial proliferation and limits atherosclerosis by suppressing Dlk1[J].Nature Medicine,2014,20(4):368-376.
[15]LIJ J,HANM,WEN JK,et al.Osteopontin stimulates vascular smooth muscle cell migration by inducing FAK phosphorylation and ILK dephosphorylation[J].Biochemical& Biophysical Research Communications,2007,356(1):13.
[16]MAFFIA P, GRASSIA G, MEGLIO P D, et al.Neutralization of Interleukin-18 inhibits neointimal formation in a rat model of vascular injury[J].Circulation,2006,114(5):430-437.
[17]ZHANG X H,ZHENG B,HAN M,et al.Synthetic retinoid Am80 inhibits interaction of KLF5 with RARα through inducing KLF5 dephosphorylation mediated by the PI3K/Akt signaling in vascular smooth muscle cells[J].Febs Letters,2009,583(8):1231-1236.
[18]GAO D, NIU X, NING N, et al. Regulation of angiotensin II-induced Krüppel-like factor 5 expression in vascular smooth muscle cells[J]. Biological&Pharmaceutical Bulletin,2006,29(10):2004-2008.

