基于氮同位素标记技术的高寒人工草地氮肥氨挥发和氮素回收率研究
刘攀, 周华坤, 杨冲, 李香芬, 王文颖,*
1. 青海师范大学地理科学学院, 西宁810008
2. 中国科学院西北高原生物研究所, 西宁810008
1 前言
青藏高原是我国主要的畜牧业基地之一, 草地面积约 150 万 km2, 占全国草地总面积的 37.64%;高寒草地不仅为当地居民的生活和社会生产提供物质基础, 还在调节气候、涵养水源、保持水土、固碳、遗传基因资源、景观、文化教育等方面具有极其重要的生态系统服务功能, 是保障我国生态安全的关键地区之一[1]。2005—2012年期间, 在“三江源自然保护区生态保护和建设工程”、“青海省天然草原退牧还草工程”、“荒山种草”、“天然草原保护”等工程项目的支持下, 累计在青藏高原三江源区完成“黑土滩”治理、建植人工、半人工草地338.4万亩, 在同德、兴海、泽库3县建设人工饲草料基地5万亩[1]。建设稳定、优质、高产的高寒人工草地, 关键要依靠优良牧草品种选育技术、牧草混播组合筛选技术、高产栽培耕作和施肥技术、高效病虫鼠害防治技术和杂草防除等先进技术手段, 才能保证青藏高原高寒地区人工草地建设和利用的可持续发展[2]。
草地畜牧业可持续发展过程中草畜平衡是至关重要的因素, 且不同发展阶段草畜平衡的具体内涵不同。第一个阶段是在自然生产力条件下草地放牧系统的草畜平衡, 主要内容是天然草场的生产力与牲畜饲养量之间的平衡。第二阶段是在发展人工草地前提下的草畜平衡。主要内容是适度建植人工草地开展种草养畜与天然草场合理利用并举, 提高草畜平衡点[3-5]。第三个阶段是营养平衡阶段, 随着天然草原和人工草地潜力的不断发挥, 在草畜平衡关系中出现一个制约因素即营养要素的平衡。草地土壤中大部分氮素来自大气氮沉降、豆科植物生物固氮、家畜粪便的再循环以及动植物残体的分解。随着草畜平衡点的不断提高, 长期放牧使草地产出不断增加, 导致土壤氮素水平不断下降, 因此土壤氮素水平成为制约高寒草地生产潜力的主要因素[6-8]。
氮在陆地生态系统中的循环过程可划分为3个阶段: 氮素的输入(主要是生物固氮、氮沉降和施氮肥)、氮的转化(主要包括矿化, 即氨化与硝化、反硝化和固持)和植物的氮吸收及沿食物网的营养级传递、氮素的输出(主要是反硝化和氨挥发)[9]。国际上,15N标记技术已经广泛用于研究植物对氮的吸收、利用及分配研究, 且取得了一些突破性的研究成果[10-13]。近年来, 由于氮肥利用效率低使植物氮营养学研究日益受到重视。氮肥利用率受施肥水平、施肥方法、土壤性状、气象条件、植被类型等多种因素的影响, 平均利用率只有30%—35%[14-15]。减少氮肥氨挥发和硝化作用, 选育氮高效、耐低氮品种是提高氮利用率、减少环境污染与资源浪费, 实现农业和草地生态系统可持续发展的主要途径。
施肥是保持人工草地生产力可持续利用的主要措施之一。高寒人工草地主要以磷酸二铵作为基肥,尿素作为追肥。磷酸二铵施肥量为75—375 kg hm-2,含N量46%的成品尿素的施肥量75—300 kg hm-2。研究表明尿素中辅以脲酶抑制剂或硝化抑制剂可减缓土壤中尿素酰胺态氮水解以及NH4+-N至NO3--N的氧化, 减少 NH3挥发[14]。脲酶抑制剂和硝化抑制剂的作用机理不同。脲酶抑制剂可以延缓土壤中尿素的水解, 减少 NH3的挥发损失, 从而间接地延缓NH4+-N氧化为 NO3--N, 而硝化抑制剂则是直接抑制NH4+-N氧化为NO3--N, 并且减少NO3--N淋溶以及N2和N2O等气态损失。脲酶抑制剂N-丁基硫代磷酰三胺(NBPT)和硝化抑制剂3, 4-二甲基吡唑磷酸盐(DMPP)是常用的两种抑制剂。目前对青藏高原高寒人工草地建置过程中施入氮肥的氨挥发、氮肥在人工草地生态系统中的去向、增加氮肥利用率的措施等方面的基础研究缺乏。因此, 本研究应用15N示踪技术, 野外原位定量测量高寒燕麦人工草地施尿素后草地氨挥发速率、累计氨挥发量、氮素利用率及回收率, 研究尿素配施脲酶抑制剂 NBPT和硝化抑制剂DMPP对高寒燕麦草地NH3挥发、地上、地下初级生产力以及氮肥回收率的影响, 为高寒人工草地生态系统施肥技术和可持续利用发展模式提供科学依据。
2 材料与方法
2.1 研究地区自然地理概况
该实验在青海省同德县牧草良种繁殖场进行,地处 35°15′N、100°39′E, 位于同德巴滩地区, 海拔3280 m, 年均降水量429.8 mm, 年均温0.2 ℃, 大于0 ℃的活动积温1503.0 ℃, 牧草生长季内的活动积温 1309.0 ℃, 无绝对无霜期, 地势平坦。天然草地植被类型为温性草原, 以禾本科芨芨草(Achna-therum splendens)、针茅(Stipa capillata L.)、固沙草(O. thoroldii)、凤毛菊(Saussurea japonica)、紫菀(Aster tataricus)等为优势种。土壤类型为暗栗钙土, 土壤总碳 18.9 g·kg-1, 有机碳10.6 g·kg-1, 全氮 2.4 g·kg-1, 土壤pH为7.8。
2.2 实验设计
试验采用随机区组设计, 共设置5组2×3 m处理小区, 每组3个重复, 共15个处理小区, 每个小区间距为1 m×1 m。分别为: (1)不施肥对照CK; (2)单施尿素CO(15NH2)2处理A1; (3)尿素CO(15NH2)2+脲酶抑制剂NBPT处理 A2; (4)尿素CO(15NH2)2+硝化抑制剂DMPP处理A3; (5)尿素CO(15NH2)2+硝化抑制剂 DMPP+脲酶抑制剂 NBPT处理 A4。各处理尿素施氮量均为 55.20 kg N·hm-2, 施肥时间为2015年7月初, 收获时间为8月底。其中尿素CO(15NH2)215N丰度为10.15%, 购自上海普振生物科技有限公司。硝化抑制剂DMPP与脲酶抑制剂 NBPT用量分别为施氮量的 1%和 0.5%。硝化抑制剂DMPP的施用量为552 g·hm-2; 脲酶抑制剂 NBPT的施用量为 276 g·hm-2。脲酶抑制剂NBPT为正丁基硫代磷酸三铵(C4H14N3PS)分析纯试剂, 硝化抑制剂 DMPP为 3,4-二甲基吡唑磷酸盐(C5H11N2O4P)分析纯试剂。
2.3 氨挥发量的测定方法
土壤氨挥发采用“通气法”测定[16]。在每个处理样地内插入直径19.2 cm, 高度40 cm的PVC管, 其中20 cm插入土壤, 地上部分20 cm。氨气回收装置示意图如图1所示, 将两块厚度为2 cm、直径为20 cm的海绵作为多孔吸收介质, 分别均匀的浸入 30 mL磷酸甘油溶液(50 mL磷酸+ 40 mL的丙三醇, 超纯水定容至 1 L)后, 置于 PVC管中。上层海绵置于PVC管顶部, 防止空气中的氨气和灰尘进入装置内;下层海绵距土壤表面 10 cm, 用于吸收土壤挥发出的氨。燕麦地施肥后第1, 2, 3, 4, 5, 6, 7, 9, 11天测定氨挥发速率, 取出下层海绵, 装入自封袋中置于-4℃冰箱中保存, 同时换取另一块浸过磷酸甘油的海绵, 上层海绵视其干湿情况更换。将取出的海绵置于1L的烧杯中, 加入500 mL浓度为0.5 mol·L-1的K2SO4的溶液, 置于转速为150 r·min-1的摇床上震荡1h得到浸提液。连续流动注射分析仪测定海绵浸提液中的NH4+-N浓度。

图1 氨气挥发吸收装置示意图Fig. 1 Schematic diagram of ammonia volatilization absorption device
2.4 地上组织、根系及土壤δ15N值的测定
由于青海省海南州同德县8月底为一年中牧草生物量最高的时期, 而后牧草逐渐进入枯黄期。因此8月底从每个处理样地收集燕麦茎叶、根系和土壤分析样品δ15N值及其地上、地下生物量。每个样地内随机采集3个0—10 cm、10—20 cm、20—30 cm、30—40 cm的土样(直径5.5 cm), 土样立即转入实验室过2 mm的土壤筛, 取出根系, 用自来水淋洗后, 用 0.5 mmol·L-1的 CaCl2溶液淋洗 10 min, 再用蒸馏水冲洗以去除附着在根系表面上的15N。收集的茎叶和根系80 ℃烘干, 研磨过100目筛, 土样自然风干后研磨过100目筛。在元素分析仪-连续流动同位素比率质谱仪(EA-IRMS)分析δ15N和氮含量(g·kg-1)。样品经EA燃烧, 氧化还原成可供质谱测定的气体, 并经色谱分离, 由载气(He)带入质谱仪进行同位素比值测定。
2.5 计算方法与数据处理
2.5.1 氨挥发速率的计算:

(1)式中:A为通气法单个装置每次测得的NH4+-N含量(mg N);B为捕获装置的横截面积(m2);C为每次连续捕获的时间(d)。试验中所获得数据均为各处理3个重复数值的平均值。
2.5.2 氨挥发累积损失量的计算:

(2)式中:V1为各施肥处理下层海绵24 h氨的吸收量(mg·N);V0为无肥对照处理(CK)下层海绵24 h氨的吸收量(mg N)。
将不同时间的氨挥发损失量相加, 即为氨挥发累积损失量。试验中所获得的数据为各处理3个重复数值的平均值。
2.5.3 氮素回收率的计算
氮肥利用率是指农作物吸收的氮占施肥料总氮量的百分率, 通常它仅局限于氮肥施入后的当季利用率[22]。基于氮质量、施加的15N质量和不同库中回收的15N质量计算15N回收率。

式(3)中,Fsample: 标记样品15N 原子百分超(%);Fref:背景(未标记样品)15N原子百分超(%);Ftrace: 示踪剂原子百分超; Npool: 植物库或土壤库氮质量(g N·m-2);Ntracer: 施加的氮质量(g N·m-2)。
2.5.4 数据处理
采用单因素方差分析(one-way ANOVA,LSD)比较不同处理间各参数差异显著性; 统计分析均在Excel 2007和 SPSS 19.0统计软件上完成; 运用OriginPro 8.0软件制图。
3 结果与分析
3.1 高寒人工草地氮肥配施脲酶/硝化抑制剂处理下土壤氨挥发速率特征

图2 尿素配施NBPT/DMPP处理下氨挥发速率Fig. 2 NH3 volatilization rate under different NBPT/DMPP combined nitrogen fertilization treatments
尿素配施脲酶/硝化抑制剂处理下土壤氨挥发速率特征见图2。不施尿素对照CK处理氨挥发速率保持在最低水平, 变动幅度范围 4.13—7.11 g N·hm-2·d-1;单施尿素处理施肥后第 2天氨挥发速率达到最大值343.43 g N·hm-2·d-1, 第3天后进入缓速挥发阶段。尿素+DMPP处理氨气挥发速率在第 2天达到最大值216.53 g N·hm-2·d-1, 第5 天出现小高峰44.06 g N·hm-2·d-1,之后进入缓速挥发阶段。尿素+ NBPT处理和尿素+DMPP+NBPT处理氨挥发速率均在第7天达到最大值, 分别为 43.19 g N·hm-2·d-1、34.55 g N·hm-2·d-1。与单施尿素处理相比, 尿素+NBPT处理和尿素+DMPP+NBPT处理氨挥发高峰出现时间延迟, 且氨挥发速率最大值分别降低87.42%和89.94%。
由表1可以看出, 施肥后第2天, 单施尿素处理氨挥发速率显著高于其它处理, 尿素+DMPP氨挥发速率显著高于尿素+NBPT、尿素+NBPT+DMPP处理, 且后两者差异不显著。施肥第9天后, 单施尿素氨挥发速率仍显著高于其它组, 其它组间显著不显著。结果表明在同德高寒人工草地尿素配施脲酶/硝化抑制剂处理对降低草地氮肥氨挥发速率产生效果,但不同抑制剂效果不同。尿素+NBPT和尿素+NBPT+DMPP处理对于推迟氮肥氨挥发速率高峰出现时间和降低峰值都有明显的作用。
3.2 高寒人工草地氮肥配施脲酶/硝化抑制剂处理下氨挥发累积损失量特征
尿素配施脲酶/硝化抑制剂处理下氨挥发累积损失量特征见图3。可以看出: 单施尿素处理下 11天累计氨挥发量为727.77g N·hm-2, 且氨挥发主要集中在施入尿素后的前4天。尿素加入抑制剂对累计氨挥发的影响看: 尿素+DMPP、尿素+NBPT、尿素+NBPT+DMPP后燕麦地累计氨挥发量分别为439.30 g N·hm-2、94.85 g N·hm-2、80.01 g N·hm-2, 氨挥发主要集中在施入尿素的前7天, 较单施尿素氨挥发累积量分别降低了39.64%、86.97%、89.01%。根据统计结果表明, 除尿素+NBPT+DMPP和尿素+NBPT之间氨挥发累积损失量差异不显著外, 其余处理间差异显著(P<0.05)。可以看出: 尿素+NBPT 与尿素+NBPT+DMPP对降低氮肥氨挥发累积损失量的效果最好。
3.3 高寒人工草地氮肥配施脲酶/硝化抑制剂处理下初级生产力特征
高寒人工草地氮肥配施脲酶/硝化抑制剂处理下茎叶和根系净初级生产力特征见表 2。可以看出,不施肥对照处理高寒燕麦草地净初级生产力为565.57 g·m-2·y-1, 施尿素处理净初级生产力为652.36 g·m-2·y-1, 尿素+NBPT、尿素+DMPP、尿素+NBPT+DMPP 处理净初级生产力为 678.33—704.41 g·m-2·y-1。
各处理下高寒人工草地茎叶初级生产力为504.01—613.33 g·m-2·y-1。统计分析结果表明: 所有施肥处理茎叶初级生产力显著高于不施肥对照组,尿素+NBPT、尿素+DMPP显著高于单施尿素、尿素+NBPT+DMPP。

表1 不同处理下氨挥发速率差异显著性分析Tab. 1 Difference significance analysis of NH3 volatilization rate
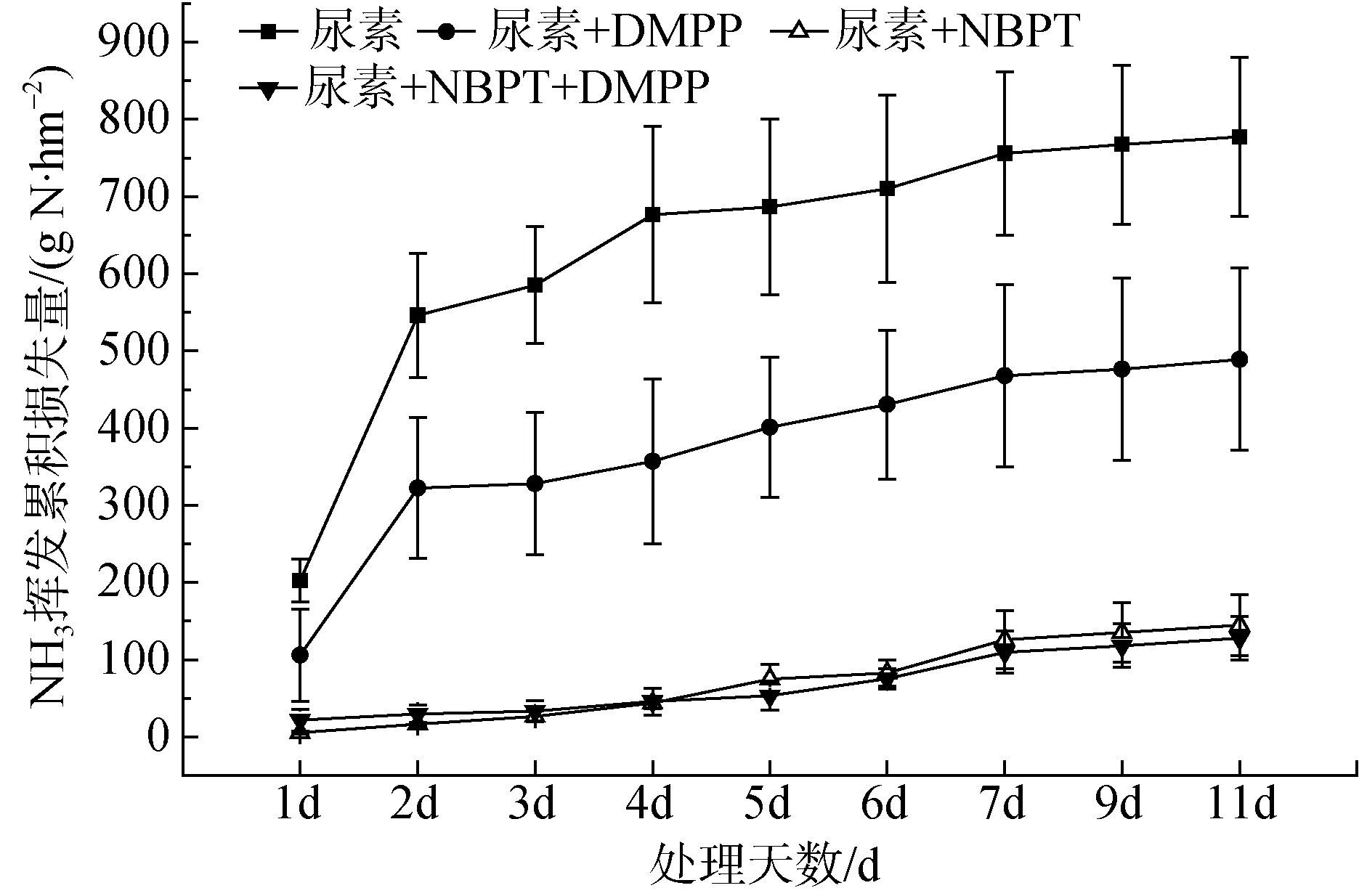
图3 尿素配施NBPT/DMPP处理下氨挥发累积损失量Fig. 3 The accumulated NH3 volatilization under NBPT/DMPP combined urea treatments
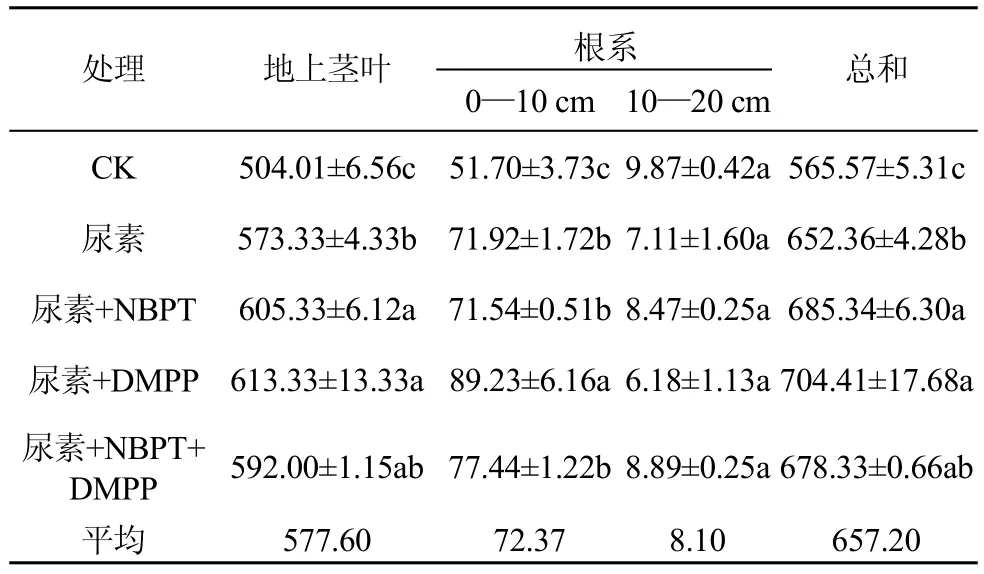
表 2 不同处理下高寒人工草地茎叶、根系初级生产力(g·m-2·y-1)Tab 2 The cauline leaf and root primary productivity of alpine oat land at different treatments (g·m-2·y-1)
各处理下高寒人工草地 0—10 cm 层地下根系初级生产力平均为72.37 g·m-2·y-1, 10—20 cm层平均为 8.10 g·m-2·y-1。统计分析结果表明: 所有施肥处理0—10 cm层根系显著高于对照组; 10—20 cm层地下根系初级生产力各处理间无显著差异性。
3.4 高寒人工草地氮肥配施脲酶/硝化抑制剂处理下15N在植物和土壤中的回收率
高寒人工草地15N标记尿素配施脲酶/硝化抑制剂处理下,15N在植物茎叶、根系和土壤中回收率见表3。单施尿素处理15N总回收率(茎叶+根系+土壤)为 57.66%, 尿素+DMPP处理15N总回收率为58.07%, 尿素+NBPT、尿素+NBPT+DMPP处理15N总回收率分别为69.82%和79.80%。
不同处理中15N在植物茎叶中的回收率为28.45%—37.62%,15N在植物根系中的回收率为2.33%—2.68%,15N在0—40 cm土壤层中的回收率为25.90%—41.64%。可以看出施入土壤的15N尿素经过50天后主要分布在植物地上部分, 其次分布于土壤层中, 根系中分布的最少。土壤中15N标记尿素主要分布在0—10 cm层。
植物茎叶氮回收率(氮素利用率)在尿素+NBPT处理最高, 达到37.62%, 其次为尿素+DMPP、尿素+NBPT+DMPP, 茎叶氮回收率为28.45%、35.63%。植物根系氮回收率(氮素利用率)各处理间差异不显著, 仅为2.33%—2.68%。土壤中氮素回收率在尿素+ DMPP+NBPT处理中最高, 达到41.64%。其次为尿素+NBPT、单施尿素和尿素+DMPP处理, 氮素回收率为25%—29%。
从不同处理15N总回收率看: 除尿素+DMPP处理外, 尿素+NBPT和尿素+NBPT+DMPP处理可显著提高尿素在草地生态系统中的回收率。与单施尿素相比, 效果最好的是尿素+DMPP+NBPT,氮回收率提高 22%; 其次是尿素+NBPT, 氮回收率提高了12%。尿素+DMPP处理不能显著提高氮回收率。

表3 高寒人工草地15N尿素在植物和土壤中的回收率(%)Tab. 3 Recovery rates of 15N urea in plants and soils of alpine grassland (%)
4 讨论
4.1 氮肥配施抑制剂对氨挥发速率动态变化及氨挥发累积损失量的影响
在农业生态系统中, 氨挥发是降低氮肥利用率的主要因素之一, 同时氨挥发也带来一系列的环境问题, 因此降低氨挥发损失量和提高氮肥利用率问题已迫在眉睫。然而, 目前氮肥配施硝化抑制剂或脲酶抑制剂对氨挥发损失产生的影响的相关研究结果尚不统一。Freney等[17]与Chien等[18]通过研究尿素配施不同抑制剂对氨气挥发的影响, 发现尿素+脲酶抑制剂NBPT、氮肥+硝化抑制剂PPDA(苯基磷酰二胺)+脲酶抑制剂NBPT可以推迟氨挥发出现的高峰且降低峰值。而张文学等[19]研究发现添加脲酶抑制剂NBPT并未影响到氨挥发速率高峰期出现的时间, 所有处理在施入尿素后第 4 天达到高峰期。有关青藏高原高寒草地氮肥配施脲酶抑制剂、硝化抑制剂的研究未见相关报道。本研究结果显示尿素+NBPT+DMPP或尿素+NBPT对氨挥发速率峰值出现时间较单施尿素处理有所滞后, 且峰值显著降低。原因主要是脲酶抑制剂 NBPT和硝化抑制剂DMPP可分别减缓了土壤中尿素酰胺态氮至铵态氮的水解以及铵态氮至硝态氮的转化, 土壤NH4+含量减少, 有效的抑制氨挥发损失[20]。也可能是因为同德温性草原人工草地土壤微生物碳源丰富, 促进微生物活动, 导致部分氮由矿化态转化为固持态。此外, Freney等[17]与Soares等[21]认为尿素+硝化抑制剂PPDA(苯基磷酰二胺)会增加氨挥发损失量。而本研究结果发现, 相较于单施尿素, 尿素+DMPP处理亦可降低氨挥发累积损失。目前, 对于氮肥配施硝化抑制剂是否促进氨挥发损失报道不一, 可能与当地的土壤质地、气候、抑制剂添加浓度有关[21]。
4.2 氮肥配施抑制剂对氮素利用率的影响
目前全球不同作物平均氮肥利用率仅为50%左右[23]。唐建阳等[24]研究指出, 尿素+硝化抑制剂EP(2-cthymylpyrudine)或脲酶抑制剂 NBPT(N-丁基硫代磷酰二胺)可提高氮肥利用率, 减少氮素损失,而Shoji等[25]研究指出尿素+硝化抑制剂DCD(双氰胺)对氮肥利用率无显著作用, 却增加了氮素的损失。在本研究中, 单施尿素处理下燕麦对氮肥的利用率为 31.68%, 尿素+DMPP处理下氮肥利用率为31.04%。但尿素+NBPT和尿素+NBPT+DMPP处理样地燕麦对氮肥的利用率分别为40.10%和38.07%,比单施尿素提高8.42%和7.03%。由此结果可以得出,在高寒人工草地中, 尿素+DMPP处理燕麦对氮素利用率无显著作用; 但尿素+NBPT和尿素+NBPT+DMPP均提高燕麦牧草氮素利用率, 且前者氮素利用率大于后者。
王文颖等[26]通过对青藏高原人工草地氮分流研究发现以 K15NO3为示踪剂时, 垂穗披碱草(Elymus nutans)、中华羊茅(Festuca. sinensis)和冷地早熟禾(Poa crymophila)三种牧草茎叶、根系及土壤15N回收率分别为6.61%、3.33%、24.88%; 以15NH4Cl为示踪剂时, 三种牧草茎叶、根系及土壤回收率分别为4.15%、3.54%、34.19%。本论文以尿素CO(15NH2)2为示踪剂发现, 燕麦茎叶、根系及土壤的回收率分别为 25.43%、2.33%、25.90%, 相较于其两种氮素,CO(15NH2)2的氮素回收率效果更好, 且对于茎叶中15N利用率更高。
Templer等[27]综述了15N示踪研究结果发现陆地生态系统平均保留了62.7%的15N。根据不同的回收时间, 生态系统平均总15N 回收分别是 59.60%(<1周), 80.10%(1周—1月), 50.70%(1—3月), 69.4%(3—18月)和 61.6%(>18月)。在本实验研究中, 高寒燕麦草地生态系统15N示踪剂施用一个生长季后, 不同处理样地植物与土壤(0—40 cm)中15N回收率为57.58%—82.66%。与单施尿素比较, 除尿素配施DMPP外, 所有处理均能显著提高15N在植物和土壤中的总回收率。与单施尿素相比较, 效果最好的是尿素+DMPP+NBPT, 氮回收率提高 22%, 其次是尿素+NBPT, 氮回收率提高了 12%。表明在同德暗栗钙土, 除尿素+DMPP处理外, 添加脲酶抑制剂NBTP可有效提高尿素在高寒草地生态系统中的回收率。施入土壤的15N肥料经过一个生长季后主要分布在植物地上部分, 其次分布于土壤层中, 根系中分布的最少。
单施15N尿素肥料后, 42.34%的N素没有在植物和土壤中回收到。流失的氮素一部分以氨挥发损失了, 另外一部分 NO3——N 通过反硝化作用以 N2O和N2的形式进入大气, 部分NO3——N通过淋溶作用流失, 这些都是示踪氮肥可能流失的途径。这些结果表明: 在同德人工草地生态系统施肥过程中降低气态氮流失和土壤氮淋溶是一个重要的环节。同德暗栗钙土尿素+DMPP对氮肥利用率无显著作用。但尿素+NBPT, 尿素+NBPT+DMPP可以有效降低氮素的流失, 氮素流失分别为30.27%和20.29%。本研究结果表明, 在青藏高原高寒人工草地, NBPT对降低氨挥发损失及提高肥料利用率具有显著效果,但与NBPT+DMPP配施的效果无显著性差异, 因此在人工草地中如何科学合理的运用脲酶抑制剂与硝化抑制剂更有效的提高氮肥的利用效率与增加产量、降低环境污染仍需进一步研究。
[1] 秦大河. 三江源区生态保护与可持续发展[M]. 北京: 科学出版社, 2014.
[2] 董世魁, 蒲小鹏, 胡自治. 青藏高原高寒人工草地生产-生态范式[M]. 北京: 科学出版社, 2013.
[3] 胡自治. 青藏高原的草业发展与生态环境[M]. 北京: 中国藏学出版社, 2000.
[4] 张耀生. 青藏高原牧区多年生人工草地持续利用的研究[J].草业学报,2003, 12(3): 22-27.
[5] 赵新全, 周华坤. 三江源区生态环境退化、恢复治理及其可持续发展[J]. 中国科学院院刊, 2005, 20(6): 471-476.
[6] 曹广民, 吴琴, 李东, 等. 土壤-牧草氮素供需状况变化对高寒草甸植被演替与草地退化的影响[J]. 生态学杂志,2004, 23(6): 25-28.
[7] LE BAUER D S, TRESEDER K K. Nitrogen limitation of net primary production in terrestrial ecosystems is globally distributed[J]. Ecology, 2008, 89: 371-379.
[8] 赵新全. 三江源区退化草地生态系统恢复与可持续管理[M].北京: 科学出版社, 2011.
[9] 林光辉. 稳定同位素生态学[M]. 北京: 高等教育出版社,2013
[10] BELOW F, CRAFTS-BRANDNER S, HARPER J, et al.Uptake, distribution and remobilization of15N-labeled urea applied to maize canopies[J]. Agronomy Journal, 1985, 77:412-415.
[11] LINZMEIER W, GUSTER R, SCHMIDHALTER U.Nitrous oxide emission from soil and from a15N-labelled fertilizer with the new nitrification inhibitor 3,4-dimethylpyrazole phosphate (DMPP) [J]. Biology and Fertility of Soils, 2001, 34: 103-108.
[12] HOFMOCKEL K S, SCHLESINGER W H, JACKSON R B. Effects of elevated atmospheric carbon dioxide on amino acid and NH4+-N cycling in a temperate pine ecosystem.Global Change Biology[J], 2007, 13: 1950-1959.
[13] TUMER M M, HENRY H A L. Interactive effects of warming and increased nitrogen deposition on15N tracer retention in a temperate old foeld: seasonal trends[J].Global Change Biology, 2009, 15: 2885-2893.
[14] 朱兆良. 农田中氮肥的损失与对策[J]. 土壤与环境,2000, 9(1): 1-6.
[15] RAUN W R, SOLIE J B, JOHNSON G V, et al. Improving nitrogen use efficiency in cereal grain production with optical sensing and variable rate application[J]. Agronomy Journal, 2002, 94: 815-820.
[16] 王朝辉, 刘学军, 巨晓棠, 等. 田间土壤氨挥发的原位测定——通气法[J]. 植物营养与肥料学报, 2002, 8(2): 205-209.
[17] FRENEY J R, KEERTHISINGHE D G, PHONGPAN S, et al. Effect of urease, nitrification and algal inhibitors in ammonia loss and grain yield of flooded rice in Thailand[J].Nutrient Cycling in Agroecosystems, 1994, 40(3): 225-233.
[18] CHIEN S H, PROCHNOW L I, CANTARELLA H. Recent developments of fertilizer production and use to improve nutrient efficiency and minimize environmental impacts[J].Advance in Agronomy, 2009, 102(9): 267-322.
[19] 张文学, 孙刚, 何萍, 等. 脲酶抑制剂和硝化抑制剂对稻田氨挥发的影响[J]. 植物营养与肥料学报, 2013, 19(6):1411-1419.
[20] TUMER D A, EDIS R B, CHEN D, et al. Determination and mitigation of ammonia loss from urea applied to winter wheat with N-(n-butyl) thiophosphorictriamide[J]. Agriculture Ecosystems and Environment. 2010, 137(3/4): 261-266.
[21] SOARES J R, CANTARELLA H, MENEGALE M L DC.Ammonia volatilization losses from surface - applied urea with urease and nitrification inhibitors[J]. Soil Biology and Biochemistry, 2012, 52(8): 82-89.
[22] 刘巽浩, 陈阜. 对氮肥利用效率若干传统观念的质疑[J].农业现代化研究, 1990, 11(4): 28-34.
[23] NEWBOULD P. The use of fertilizer in agriculture: Where do we go practically and ecologically[J]. Plant & Soil, 1989,115(2): 297-311.
[24] 唐建阳, 翁伯琦, 何萍, 等. 提高稻田氮素利用率若干方法和机制探讨[J]. 植物营养与肥料学报, 1998, 4(3):242-248.
[25] SHOJI S J, DELGADO A M, MIURA Y. Use of controlled release fertilizers and nitrification inhibitors to increase nitrogen use efficiency and to conserve air and water quality[J]. Communications in soil Science and Plant Analysis, 2001, 32 (7-8): 1051-1070.
[26] 王文颖, 赵明德, 杨冲,等. 人工草地氮素分流:青藏高原野外15N示踪实验研究[J]. 青海师范大学学报(自科版),2016, 32(3): 71-79.
[27] TEMPLER P H, MACK M C, Chapin III F S, et al. Sinks for nitrogen inputs in terrestrial ecosytems: a meta-analysis of15N tracer field studies[J]. Ecology, 2012. 93(8): 1816-1829.

