海菖蒲浸提液对锥状斯氏藻的抑制效应研究
肖晗, 王璐畇, 赵旻, 陈琪, 段舜山
暨南大学水生生物研究中心, 水体富营养化与赤潮防治广东普通高校重点实验室, 广州 510632
1 前言
赤潮(Harmful Algal Blooms, HABs)是国际社会共同关注和急需研究解决的海洋环境问题之一, 探索经济有效的防治方法对于保护海洋环境质量、保障养殖业持续发展以及维护人类健康均具有重要意义[1]。锥状斯氏藻隶属甲藻门(Pyrrophyta)斯氏藻属(Scrippsiella Baleth & Loeblich),细胞长为 18—30μ m, 是一种世界广布性赤潮藻类,其赤潮在世界各地海域时有发生,在我国东南沿海广泛分布,同时也是我国南海重要的赤潮生物[2]。2000年起我国南海海域接连发生多起大规模锥状斯氏藻赤潮[3-5], 锥状斯氏藻赤潮已经成为我国主要的有害赤潮之一。锥状斯氏藻在遇到不良环境时形成孢囊, 当遇到合适生长条件就会重新萌发并爆发赤潮[3]。锥状斯氏藻虽然无毒, 但是能够通过大量的聚集, 造成水体缺氧, 从而导致水生动物的机械性窒息死亡, 进而造成了水质的恶化, 危及到海洋生态系统的安全[6]。赤潮爆发严重影响海洋生态系统的结构和功能, 并给渔业造成巨大的损失[7]。
目前国内外尚未找到合理有效的治理方法, 均以预防为主, 治理为辅的策略。目前治理赤潮的方法主要有三种, 分别是物理法[8,9]、化学法[10-13]、生物法[14]。然而, 物理方法成本高、效率低, 化学方法容易产生二次污染[15], 真正可用于实际的方法并不多。化感作用原理的发现为赤潮的防治提供了新的研究思路。高等植物能产生各种次级代谢产物通过根、枝叶、凋落物释放到环境中[16],来影响周围其他植物的生长, 从而为自身竞争到更多的光照、水分和矿物质[17]。大型沉水植物为优势种的水生态系统中通常具有更高的生物多样性和更清澈的水质, 在浮游植物为优势种的水生态系统中往往具有低的生物多样性和糟糕的水质[18]。目前, 利用化感作用控制水华已经成为一个新的研究热点[16,19]。有研究发现某些大型水生植物如金鱼藻[20]、黑藻[20]、水浮莲[21]、眼子菜[22]、石莼[23]、红毛藻[24]、狐尾藻[19]对某些藻类具有抑制作用。但是, 关于利用化感作用控制海洋赤潮藻的研究还较少, 亦少见关于海草对赤潮藻生长抑制作用的报道。
海草床生态系统是典型海洋生态系统[25]。除了北冰洋沿岸,全世界几乎所有的海岸都有海草分布[26]。海草草甸是生产力最高的海洋生态系统之一[27], 一些海草植物能够产生化感物质, 对其他植物产生抑制效应。例如, 曾经大量生长过波喜荡(Posidonia oceanica)的海区人工移植其他海草种很难成活, 而重新移植波喜荡, 建植的成功率最高达到 98%。Harrison[28]利用 14C示踪法发现大叶藻(Zostera marina)叶片水提物降低了其附生硅藻的光合作用效率。然而, 尚不清楚海菖蒲浸提物是否能够抑制赤潮藻的生长。为此, 本文研究了海菖蒲干粉三种提取物对典型赤潮藻锥状斯氏藻生长的影响, 以期为进一步利用海草植物资源提高近海水域的环境生态效益提供新的思路和科学依据。
2 材料与方法
2.1 材料
2.1.1 赤潮藻
实验所用藻种锥状斯氏藻(S. trochoidea)由暨南大学水生生物研究中心藻种室提供。赤潮藻采用改进过的 f/2培养基[29]静置培养。光照强度为100 µmol·m2·s-1, 光暗比 12L:12D, 培养温度为(23±1) ℃,盐度为30, 起始pH为8.0±0.02。每天摇晃赤潮藻三次防止其贴壁生长。藻细胞密度用C6流式细胞仪测定(BD AccuriC6, USA)。在实验前三天将对数期藻细胞接种到高温灭菌的培养基中以适应生长环境。
2.1.2 海草植物
海菖蒲(Enhalus acodoides)采集于中国海南省陵水县新村湾(E109°59'34, N18°23'59)。
2.2 方法
2.2.1 海菖蒲干粉的制备
新鲜海菖蒲叶片采集出水后迅速用蒸馏水和毛刷刷去其表面附着的藻类与其他生物, 然后放入烘箱中 60 ℃烘干至恒重。烘干后的海草用研钵研磨成粉末, 过100目筛网, 4 ℃保存待用。
2.2.2 海菖蒲干粉浸提液母液制备
用电子天平准确称取40 g海草植物干粉, 加入容量为3000 mL且经过高温蒸汽灭菌过的玻璃烧杯中, 加入2000 mL人工海水。用无菌封口膜包扎瓶口放入恒温水浴电磁搅拌锅中, 调制中等转速, 25 ℃浸提48 h。浸提液离心(5000 rpm, 15 min), 取上清液。上清液由Millipore水系0.22 µm滤膜过滤去除微生物,得到实验用浸提母液, 浓度为20 g·L-1。提取液4 ℃保存待用。过滤过程在超净工作台中严格无菌进行。
2.2.3 海菖蒲乙醇与正己烷粗提物制备
用电子天平分别准确称取 10 g海草植物干粉,分别加入两个容量为 500 mL经过高温蒸汽灭菌过的玻璃锥形瓶中, 分别加入 300 mL乙醇正己烷浸渍提取(10d, 室温23 ℃)。将浸提液经Millipore有机相0.22 µm 滤纸过滤, 滤液经旋转蒸发仪减压旋干(35℃), 浓缩至1—2 mL。将浓缩液用氮气吹干, 分别得到乙醇提取物与正己烷粗提物。
2.2.4 海菖蒲干粉水体物对锥状斯氏藻生长的抑制实验
蒸汽灭菌过的500 mL三角玻璃瓶装200 mL培养液。锥状斯氏藻培养体系中海菖蒲水提液浓度设置为0、0.1、0.5、1和2.5 g·L-1, 每个浓度作三组平行。空白对照组中不添加海菖蒲提取液, 加相同体积的灭菌人工海水。锥状斯氏藻起始培养浓度分别为1×103cells·mL-1, 培养时间为8天。从接种开始每隔24小时取样2 mL藻液用1%甲醛固定之后用流式细胞仪检测细胞密度并计算抑制率。
赤潮藻抑制率计算公式如下[30]

其中IR为相对抑制率;N为浸提物处理组的藻密度(cells·mL-1);N0为空白对照组藻密度(cells·mL-1)。
2.2.5 海菖蒲乙醇粗提物与正己烷粗提物对锥状斯氏藻生长的抑制实验
海菖蒲乙醇粗提物与正己烷粗提物对锥状斯氏藻抑制实验采用无菌 48孔板培养, 培养体系为 2 mL, 将海草粗提物用 2.5‰DMSO 复溶, 粗提物浓度设置为 0、6.25、12.5、25和 50 mg·L-1。每个浓度作三组平行。空白对照组中不添加海菖蒲粗提物,加相同体积的灭菌人工海水和对应浓度的DMSO。锥状斯氏藻起始培养浓度为1×103cells·mL-1培养时间为12天。从接种开始每隔48小时取样100 µL藻液用 1%甲醛固定之后用流式细胞仪检测细胞密度并计算抑制率。
2.2.6 二甲基亚砜作为助溶剂对锥状斯氏藻生长的影响
用二甲基亚砜作为助溶剂, 分别用不同体积分数的DMSO对五种赤潮藻进行剂量效应测试, 设置空白、0.50%、1%、1.50%、2%、2.50%、3%、3.50%、4%、4.50%(v/v)共计10个浓度梯度, 每24 h测定一次藻细胞在680 nm波长处的吸光值(多孔板法), 通过统计学软件计算出无可观察效应剂量(No observed effect level, NOEL)。
2.2.7 统计分析
使用FlowJo软件完成流式细胞仪数据分析。使用GraphPad Prism 7和Microsoft Excel 2016软件完成数据统计分析。通过单因素方差分析(One-way ANOVA)检验处理组与对照组之间的差异显著性,当P<0.05时, 表示差异显著,P<0.01时, 表示差异极显著。
3 结果与分析
3.1 海菖蒲干粉水提液对锥状斯氏藻生长的抑制效能
图1-a为不同浓度海菖蒲水提液对锥状斯氏藻生长抑制曲线。海菖蒲水提液对锥状斯氏藻生长的影响呈现出明显的剂量-效应关系。相比空白对照组,0.1 g·L-1处理组在第四天开始对锥状斯氏藻有抑制作用。0.5、1和2.5 g·L-1处理组藻密度均显著低于对照组(P<0.05)。

图1 海菖蒲干粉水提液对锥状斯氏藻生长的影响(a.藻密度;b.抑制率; 平均值±标准误差,n=3)Fig 1 Effects of Enhalus acoroides dry powder water extracts on the growth of S. trochoidea (a. algal density; b.IR; mean±SD, n=3)
图1-b为不同浓度海菖蒲水提液对锥状斯氏藻的生长抑制率曲线。抑制率随着培养时间的延长而升高, 随着海菖蒲水提液浓度升高而升高。2.5 g·L-1处理组在第8天达到最高抑制率95.34%。1 g·L-1和2.5 g·L-1处理组在培养的第一天的抑制率分别为43.36%和 48.08%, 0.5、1、2.5 g·L-1处理组均有显著抑制作用(P<0.05)。8 天内, 0.1、0.5、1 和 2.5 g·L-1处理组最高抑制率为分别为42.2%、82.47%、95.07%和95.34%。
3.2 海菖蒲乙醇粗提物对锥状斯氏藻生长的抑制效能
图2-a为不同浓度海菖蒲乙醇粗提物对锥状斯氏藻生长抑制曲线。相比空白对照组, 6.25 mg·L-1处理组对锥状斯氏藻无显著抑制作用(P>0.05)。12.5、25和 50 mg·L-1处理组藻密度均显著低于对照组(P<0.05)。抑制效果随海菖蒲浓水提液度升高而升高。
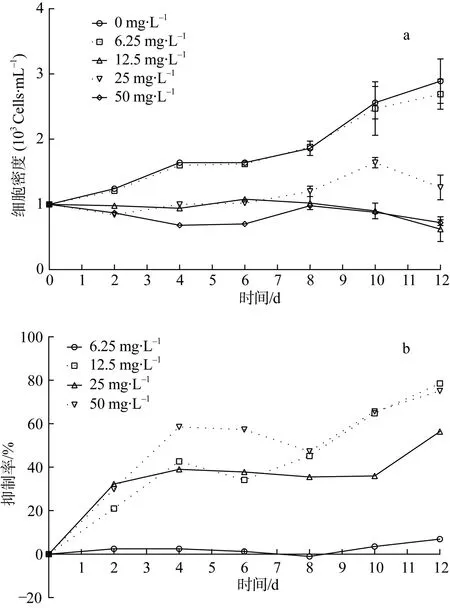
图2 海菖蒲干粉乙醇粗提物对锥状斯氏藻生长的影响(a.藻密度; b.抑制率; 平均值±标准误差, n=3)Fig 2 Effects of Enhalus acoroides ethanol phase extracts on the growth of S. trochoidea (a. algal density; b. IR;mean±SD, n=3)
图2-b为不同浓度海菖蒲乙醇粗提物对锥状斯氏藻的生长抑制率曲线。抑制率随着培养时间的延长而升高, 随着海菖蒲水提液浓度升高而升高。12.5 mg·L-1处理组在第 12天达到最高抑制率78.55%。12.5、25和50 mg·L-1处理组在培养的第一天的抑制率分别为 20.97%、32.26%和29.84%。12天内, 6.25、12.5、25 和 50 mg·L-1处理组最高抑制率为分别为6.92%、78.55%、56.4%和75.09%。
3.3 海菖蒲干粉正己烷粗提物对锥状斯氏藻生长的抑制效能
图3-a为不同浓度海菖蒲正己烷粗提物对锥状斯氏藻生长抑制曲线。相比空白对照组, 6.25 mg·L-1与12.5 mg·L-1处理组显著促进了锥状斯氏藻的生长(P<0.05)。25 mg·L-1和 50 mg·L-1处理组藻密度均显著低于对照组(P<0.05)。抑制效果随海菖蒲浓正己烷粗提物浓度度升高而增强。

图3 海菖蒲干粉正己烷粗提物对锥状斯氏藻生长的影响(a.藻密度; b.抑制率; 平均值±标准误差, n=3)Fig 3 Effects of Enhalus acoroides hexane phase extracts on the growth of S. trochoidea (a.algal density; b.IR;mean±SD, n=3)
图3-b为不同浓度海菖蒲正己烷粗提物对锥状斯氏藻的生长抑制率曲线。抑制率随着培养时间的延长而升高, 随着海菖蒲水提液浓度升高而升高。50 mg·L-1处理组在第12天达到最高抑制率58.28%。25 mg·L-1和 50 mg·L-1处理组在培养的第一天的抑制率分别为27.5%和31.25%。12天内, 6.25、12.5、25和50 mg·L-1处理组最高抑制率为分别为5.29%、12.58%、32.45%和58.28%。
3.4 二甲基亚砜作为助溶剂对锥状斯氏藻生长的影响
不同体积分数二甲基亚砜对锥状斯氏藻生长的影响如图4所示,当二甲基亚砜(DMSO)的体积分数≤2.5‰时,对锥状斯氏藻的生长影响与对照组相比差异不显著(P>0.05),而 DMSO的体积分数≥3‰时,对锥状斯氏藻的生长表现出显著的抑制作用(P<0.05),因此实验中助溶剂DMSO的体积分数选定为2.5‰。

图4 二甲基亚砜对锥状斯氏藻藻密度的影响(均值±标准误差, n=3)Fig 4 Effects of DMSO on the algal density of S. trochoidea
4 讨论
本研究采用欧盟和美国国家环保署藻类生长抑制试验(Algal Growth Inhibition Test)标准方法, 实验结果可反映海菖蒲干粉提取物对锥状斯氏藻生长抑制效应。
海菖蒲干粉水浸液(图1)在很低的浓度下就能影响锥状斯氏藻生长, 抑藻效果与浓度正相关, 说明海菖蒲中部分水溶性的物质具有抑制锥状斯氏藻的能力, Grignon-Dubois的研究也支持了我们的结果,研究发现大叶藻的水提物和甲醇提取物在很低的浓度下就对链状亚历山大藻产生了强烈抑制作用[31],其中水溶性酚类物质对抑制链状亚历山大藻生长起到主要的作用。乙醇粗提物(图2)对锥状斯氏藻起到了无显著抑制效应(p>0.05)和显著的抑制效应(p<0.05)两种结果, 抑制效果与浓度成正相关, Shu-Hua Qi[32]从海菖蒲乙醇提取物中分离出11种物质,其中黄酮和类固醇具有抗海洋细菌的活性。正己烷粗提物(图3)出现了“低促高抑”的双重浓度效应, 说明海菖蒲正己烷粗提物中同时存在促进锥状斯氏藻生长和抑制锥状斯氏藻生长的物质, “低促高抑”现的存在象表明化感物质在环境中的浓度是决定其起作用的关键因素, 孙志伟[33]的研究也支持我们的结果, 研究发现红树植物提取物对赤潮藻也有抑制效应, 并出现了“低促高抑”的效应。因此海菖蒲粗提物中可能存在三类物质, 一类是可以促进藻类生长的物质, 一类是可以抑制藻类生长的物质, 一类是对藻类生长不起作用的物质, 最终表现出来的效果是这三类物质共同作用的结果[33]。如果促进藻类生长的物质占优势, 则表现出促进作用, 如果抑制藻类生长的物质占优势, 则表现出抑制作用。
研究结果表明海菖蒲三种提取物均对锥状斯氏藻产生了不同程度的的抑制作用。海菖蒲生长在在近岸沿海潮下带水域, 并能够长期稳定生长[34], 具有持续释放化感物质的潜力。海菖蒲海草床还能为许多物种提供庇护场所, 提高近岸水域生物多样性[35], 将其作为生物防治赤潮的物种具有成本低, 无二次污染的风险, 具有物理方法和化学方法所不具有的优越性,因此, 海菖蒲具有生物防治锥状斯氏藻赤潮的潜力,其具有应用于近海水体富营养化的治理和开发新型抑藻剂的潜力。
本研究均使用一次性培养, 而且水提液抑制实验在较小的三角瓶中进行,有机相粗提物实验在多孔版中进行。因此, 实验条件尚不能与自然海区的环境条件相吻合, 可能也会造成一定的瓶效应。研究发现海菖蒲中不同极性提取物抑藻能力不同, 抑藻能力随极性增强而增强。但是具体是什么物质在起作用目前还不太明确, 有待进一步研究。
[1] 王仁君, 唐学玺, 冯蕾, 等. 鼠尾藻对赤潮异弯藻和中肋骨条藻的抑制作用 [J]. 应用生态学报, 2006, 17(12):2421-2425.
[2] 王朝晖, 钟文聪, 廖姿蓉. 敌百虫对两种赤潮微藻生长的毒性效应研究 [J]. 海洋科学, 2017, 10: 102-108.
[3] 肖咏之, 齐雨藻, 王朝晖, 等. 大亚湾海域锥状斯氏藻赤潮及其与孢囊的关系 [J]. 海洋科学, 2001, 25(9): 50-54.
[4] 张玉宇, 吕颂辉. 大亚湾澳头水域一次锥状斯氏藻(Scrippsiella trochoidea)和海洋卡盾藻(Chattonella marina)赤潮的初步探讨[C]//中国赤潮研究与防治学术研讨会, 2004.
[5] 常虹, 王博, 姚蜜蜜, 等. 深圳大鹏湾海域锥状斯氏藻赤潮期间细菌群落结构变化研究 [J]. 现代生物医学进展,2014, 14(10): 1801-1807.
[6] MANGANELLI M. Blooms of toxic microorganisms in aquatic environments: marine microalgae and freshwater cyanobacteria. A brief review with a particular focus on the Italian situation[J]. Rendiconti Lincei, 2016, 27(1):135-143.
[7] FREHI H, COUTE A, MASCARELL G, et al. Harmful and red-tide dinoflagellates in the Annaba bay (Algeria) [J].Comptes Rendus Biologies, 2007, 330(8): 615-628.
[8] ZHANG G, ZHANG P, WANG B, et al. Ultrasonic frequency effects on the removal of Microcystis aeruginosa [J].Ultrason Sonochem, 2006, 13(5): 446-450.
[9] ZEESHAN M, PRASAD S M. Differential response of growth, photosynthesis, antioxidant enzymes and lipid peroxidation to UV-B radiation in three cyanobacteria [J].South African Journal of Botany, 2009, 75(3): 466-474.
[10] 利普泰克. 环境工程师手册 [M]. 北京: 中国建筑工业出版社, 1985.
[11] 梁想, 尹平河, 赵玲,等. 生物载体除藻剂去除海洋赤潮藻[J]. 中国环境科学, 2001, 21(1): 15-17.
[12] YU Z M, ZOU J Z, MA X N. Applications of clays to removal of red tide organisms. I. Coagulation of red tide organisms with clays [J]. Chinese Journal of Oceanology &Limnology, 1994, 12(3): 193-200.
[13] CAO X H, SONG X X, YU Z M. Removal efficiency of red tide organisms by modified clay and its impacts on cultured organisms [J]. Environmental Science, 2004, 25(5):148-152.
[14] LURLING M, VAN GEEST G, SCHEFFER M. Importance of nutrient competition and allelopathic effects in suppression of the green alga Scenedesmus obliquus by the macrophytes Chara, Elodea and Myriophyllum [J]. Hydro-Biologia, 2006, 556(1): 209-220.
[15] 高伟. 九种杀藻剂和三种复配杀藻剂对铜绿微囊藻、小球藻和水绵生长的影响[D]. 新乡: 河南师范大学, 2016.
[16] SUN Zhiwei, TIAN Fei, DUAN Luyang, et al. Allelopathic effects of mangrove plant Bruguiera gymnorrhiza on microalgae [J]. Allelopathy Journal, 2012, 30(2): 291-298.
[17] SAND-JENSEN K, SØNDERGAARD M. Phytoplankton and epiphyte development and their shading effect on submerged macrophytes in lakes of different nutrient status[J]. Internationale Revue Der Gesamten Hydrobiologie Und Hydrographie, 1981, 66(4): 529-552.
[18] DECLERCK S A J, BAKKER E S, LITH B V, et al. Effects of nutrient additions and macrophyte composition on invertebrate community assembly and diversity in experimental ponds [J]. Basic & Applied Ecology, 2011,12(5): 466-475.
[19] LU Z, SHA J, TIAN Y, et al. Polyphenolic allelochemical pyrogallic acid induces caspase-3(like)-dependent programmed cell death in the cyanobacterium Microcystis aeruginosa[J]. Algal Research, 2017, 21: 148-155.
[20] WANG H Q, ZHU H J, ZHANG L Y, et al. Identification of antialgal compounds from the aquatic plant Elodea nuttallii[J]. Allelopathy Journal, 2014, 34(2): 207-213.
[21] MULDERIJ G, MOOIJ W M, VAN DONK E. Allelopathic growth inhibition and colony formation of the green alga Scenedesmus obliquus by the aquatic macrophyte Stratiotes aloides [J]. Aquatic Ecology, 2005, 39(1): 11-21.
[22] AHLUWALIA A S. Cyanobacterial and Algal Allelopathy[M]//Allelopathy. Springer Berlin Heidelberg, 2013:485-509.
[23] ACCORONI S, PERCOPO I, CERINO F, et al.Allelopathic interactions between the HAB dinoflagellate Ostreopsis cf. ovata and macroalgae [J]. Harmful Algae,2015, 49: 147-155.
[24] TANG Y Z, KANG Y, BERRY D, et al. The ability of the red macroalga, Porphyra purpurea (Rhodophyceae) to inhibit the proliferation of seven common harmful microalgae [J]. Journal of Applied Phycology, 2015, 27(1):531-544.
[25] 杨宗岱. 中国海草的生态学研究[J]. 海洋科学, 1982,6(2): 34-37.
[26] ROBERTSON A I, MANN K H. Disturbance by ice and life-history adaptations of the seagrass Zostera marina [J].Marine Biology, 1984, 80(2): 131-141.
[27] RAJA S, THANGARADJOU T, SIVAKUMAR K, et al.Rhizobacterial population density and nitrogen fixation in seagrass community of Gulf of Mannar, India [J]. Journal of Environmental Biology, 2012, 33(6): 1033-1037.
[28] HARRISON P G, DURANCE C D. Reductions in photosynthetic carbon uptake in epiphytic diatoms by water-soluble extracts of leaves of Zostera marina [J].Marine Biology, 1985, 90(1): 117-119.
[29] GUILLARD R R L. Culture of Phytoplankton for Feeding Marine Invertebrates[M]// Culture of Marine Invertebrate Animals. Springer US, 1975: 29-60.
[30] 李庆华, 郭沛涌, 田美燕,等. 柳树叶浸提液对蛋白核小球藻的化感作用[J]. 生态学杂志, 2009, 28(5):884-888.
[31] LAABIR M, GRIGNON-DUBOIS M, CECCHI P, et al.Allelopathic effects of Zostera spp. on the growth and photosynthetic activity of the toxic dinoflagellate Alexandrium catenella[C]//Proceedings of the 4th Mediterranean Symposium on Marine Vegetation. Regional Activity Center for Specially Protected Areas,Yasmine-Hammamet, 2010: 187-188.
[32] QI S H, ZHANG S, QIAN P Y, et al. Antifeedant,antibacterial, and antilarval compounds from the South China Sea seagrass Enhalus acoroides [J]. Botanica Marina,2008, 51(5): 441-447.
[33] 孙志伟, 段璐洋, 周静韵, 等. 红树植物干粉和新鲜组织水提物对两种赤潮藻的化感抑制效应[J]. 生态科学,2012, 31(2): 109-114.
[34] YANG D, YANG C. Detection of seagrass distribution changes from 1991 to 2006 in xincun bay, hainan, with satellite remote sensing [J]. Sensors, 2009, 9(2): 830-844.
[35] LEE S Y, FONG C W, WU R S S. The effects of seagrass(Zostera japonica) canopy structure on associated fauna: a study using artificial seagrass units and sampling of natural beds [J]. Journal of Experimental Marine Biology and Ecology, 2001, 259(1): 23-50.

