薏米中β-谷甾醇的分离纯化及其抗氧化活性的研究
张冬阳,郭雪松
(锦州医科大学食品科学与工程学院,辽宁锦州 121001)
薏米(CoixchinensisTod.)又称薏苡仁、薏仁米等,是常见的一种谷物[1],具有清热、消痛、祛湿、健脾补肺之功效,常作为药用[2],也是滋补、保健和润肤的佳品[3]。薏米中不仅含有丰富的蛋白质、碳水化合物以及各种微量元素,还含有较多的β-谷甾醇,使其具有抗氧化、抗菌消炎、降低胆固醇、调节脂代谢、抗肿瘤等功效[4-6]。
米制品中有关β-谷甾醇的分离纯化及抗氧化作用的研究文献报道较少,洪庆慈等人从燕麦中提取燕麦油,再从中提取β-谷甾醇放入色拉油中,结果表明β-谷甾醇具有一定的抗氧化作用[7]。乌汗其木格从裸燕麦麸皮中提取β-谷甾醇,将其放在油脂中进行抗氧化测定,结果表明,时间越久,抗氧化作用越强;浓度越大,抗氧化作用越大[8]。因此对于深入了解薏米中β-谷甾醇的抗氧化能力,提高薏米的营养价值,具有重要意义。
β-谷甾醇具有很好的抗氧化活性,然而从米制品中提取β-谷甾醇并进行抗氧化性的研究尚未见相关报道。本实验利用大孔树脂分离纯化薏米中β-谷甾醇的粗提液,通过响应面优化,得到最佳纯化工艺,以提高β-谷甾醇的提取得率、回收率和纯度,为了深入了解β-谷甾醇的生物活性,并进一步研究其抗氧化作用,为天然抗氧化剂的开发提供参考依据和技术支持。
1 材料与方法
1.1 材料与仪器
薏米 购自锦州市新玛特超市,粉碎过60目筛;β-谷甾醇标准品 纯度≥98%,北京索莱宝科技有限公司;甲醇、乙腈 色谱纯,郑州鑫瑞化验设备科技销售公司;AB-8、D-101、DA-201树脂 北京索莱宝科技有限公司;1,1-二苯基-2苦苯肼 北京索莱宝科技有限公司;邻二氮菲 北京索莱宝科技有限公司;VC、水杨酸、双氧水、乙醇、氢氧化钠、氯化钠、DPPH等其他试剂 均为分析纯,购自天津贝斯医药科技有限公司。
高速万能粉碎机 天津市泰斯特仪器有限公司;FA2004N电子分析天平 上海精密科学仪器有限公司;电热恒温鼓风干燥箱 上海一恒科技有限公司;LC-15C型高效液相色谱仪 岛津企业管理(中国)有限公司;旋转蒸发仪 上海亚荣生化仪器厂;KQ3200B型超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 粗提液的制备 参照张冬阳的方法进行提取[12]。
1.2.2β-谷甾醇分离纯化流程 取β-谷甾醇粗提液100 mL→-80 ℃冷冻干燥成粉末→取β-谷甾醇粗品10 g→加175 mL 95%乙醇溶解→过滤→滤液水洗至中性→大孔树脂吸附分离→旋转蒸发回收溶剂→β-谷甾醇纯化样品[9,13]
1.2.3 大孔树脂的静态吸附与解析
1.2.3.1 大孔树脂预处理 称取适量的大孔树脂,用95%的乙醇浸泡24 h,取出大孔树脂,用蒸馏水洗至无醇味,用5%的HCl浸泡3 h,用水洗至中性,再用5% NaOH浸泡3 h,水洗至中性[14-16]。
1.2.3.2 大孔树脂的筛选 准确称取经处理后的AB-8、D-101、DA-201三种大孔树脂各5 g于250 mL锥形瓶中,分别加入40 mL的β-谷甾醇粗提液(浓度0.5 mg/mL),于25 ℃,100 r/min的条件下充分振荡吸附24 h,过滤,测定浓度;在过滤后的树脂中加入100 mL水,于25 ℃的条件下恒温振荡3 h(100 r/min),过滤,用滤纸吸干树脂,加入100 mL 95%的乙醇,于相同条件下洗脱24 h,过滤,测定浓度。参照以下公式计算吸附率(Q1)及解析率(Q2)以及回收率,并以吸附率、解析率为指标选择最佳的大孔树脂[14,17-18]。
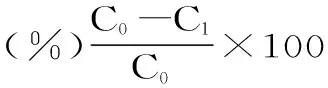


式中:C0-供试液浓度(mg/mL);C1-吸附平衡后浓度(mg/mL);C2-解析液浓度(mg/mL);V1-吸附液体积(mL);V2-解析液体积(mL);m-树脂质量(g)。
1.2.4 薏米中β-谷甾醇纯化的单因素实验设计
1.2.4.1 树脂质量对薏米中β-谷甾醇纯化效果的影响 分别称取1、2、3、4、5 g 处理后的AB-8大孔树脂,采用湿法装柱,加入0.50 mg/mL的粗提液40 mL,以1 mL/min的速度进行动态吸附,测量吸附液中β-谷甾醇的浓度,计算吸附率、回收率。
1.2.4.2 进样浓度对薏米中β-谷甾醇纯化效果的影响 称取五份处理后的AB-8大孔树脂各3 g,采用湿法装柱,然后分别加入0.1、0.3、0.5、0.7、0.9 mg/mL的粗提液40 mL,以1 mL/min的速度用75%的乙醇进行洗脱,测量吸附液中β-谷甾醇的浓度,计算吸附率、回收率。
1.2.4.3 洗脱剂浓度对薏米中β-谷甾醇纯化效果的影响 称取五份处理后的AB-8大孔树脂各3 g,采用湿法装柱,加入0.50 mg/mL的粗提液40 mL,以1 mL/min的速度进行动态吸附,分别用15%、35%、55%、75%、95%的乙醇进行洗脱,测量吸附液中β-谷甾醇的浓度,计算吸附率、回收率。
1.2.4.4 洗脱速度对薏米中β-谷甾醇纯化效果的影响 称取五份预处理的AB-8大孔树脂各3 g,采用湿法装柱,加入0.50 mg/mL的粗提液40 mL,用75%的乙醇进行动态洗脱,设置洗脱速度分别为0.5、1、1.5、2、2.5 mL/min,测量吸附液中β-谷甾醇的浓度,计算吸附率、回收率。
1.2.5 响应面实验设计 结合单因素实验结果,选择影响树脂质量、进样浓度、洗脱速度,采用三因素三水平的响应面分析法,对薏米中β-谷甾醇纯化工艺进行优化,各因素的水平见表1。

表1 Box-Behnken设计实验因素与水平Table 1 Box-Behnken design experiment factors and levels
AB-8大孔树脂纯化效果的测定 纯度对比:取上柱前的粗提液和经树脂洗脱后的溶液各50 mL,分别进行旋转蒸发并冷冻干燥,各取5 g等质量冻干样品,通过液相色谱测β-谷甾醇的纯度[19],具体条件为:C18柱(250 mm×4.6 mm,5 μm);流动相:甲醇-乙腈(35∶65)、波长:246 nm、柱温:30 ℃、进样量:10 μL、流速:0.8 mL/min。
按以下公式计算纯度:

式中,m1-粗提液冻干后冻干物的含量mg;m2-洗脱液冷冻干燥后冻干物质量mg。
1.2.6 抗氧化活性的测定
1.2.7.1β-谷甾醇对DPPH·清除能力 分别取浓度为0.1、0.2、0.4、0.6、0.8、1 mg/mL纯化后的样品溶液2 mL,各加入2 mL的DPPH,参照刘海霞[21]等人的方法。在25 ℃水浴中放置30 min,用95%的乙醇作空白对照,在517 nm处测得吸光度为A0,样品的吸光度为A1。同时以VC作为对照,测不同浓度的吸光度。
式中:A1是2 mL DPPH加2 mLβ-谷甾醇溶液测得的吸光度;A2是2 mLβ-谷甾醇溶液加2 mL 95%乙醇测得的吸光度;A0是2 mL DPPH加2 mL 95%乙醇测得的吸光度。
1.2.7.2β-谷甾醇对·OH清除能力的研究 参照田瑶[20-21]等人的方法,采用邻二氮菲-Fe2+氧化法进行测定。取10 mL试管,依次加入1 mL FeSO4溶液,1 mL 8.8 mmol/L的双氧水溶液,1 mL 9 mmol/L的水杨酸-乙醇溶液,混匀,于36~37 ℃水浴中反应15 min,在波长510 nm处测吸光度A0。按上述条件,分别加入1 mL不同浓度的β-谷甾醇标准溶液,于36~37 ℃水浴中反应15 min,在波长510 nm处测吸光度Ax。
其中:A0是空白对照测得的吸光度;Ax是加入β-谷甾醇溶液测得的吸光度。
1.3 数据处理
实验平行数3次,结果采用平均值±标准差形式表示,单因素实验采用SPSS 13.0软件和Excel软件进行数据处理。响应面实验采用Design Expert 8.0.6进行实验数据处理。
2 结果与分析
2.1 大孔树脂吸附效果的比较
由图1可知,AB-8大孔树脂的吸附率和解析率高于其他两种树脂,所以选择AB-8树脂作为薏米中β-谷甾醇分离纯化的最佳树脂。

图1 大孔树脂吸附效果的比较Fig.1 Comparison of adsorption effect of macroporous resin
2.2 单因素实验
2.2.1 树脂质量对薏米中β-谷甾醇纯化效果的影响 由图2可知,随着树脂质量的增加,薏米中β-谷甾醇的吸附率先增加后下降,回收率随着吸附率的增加而变大后趋于稳定。当树脂质量为3 g时,β-谷甾醇的吸附率和回收率有最大值。当树脂取1~2 g时,由于树脂质量太少,树脂的吸附能力有限,吸附β-谷甾醇的量偏少,从而导致吸附率和回收率都低[22-23]。当树脂质量大于3 g时,由于树脂达到吸附平衡,吸附率呈下降趋势,而回收率趋于稳定。所以最佳树脂质量为3 g。

图2 树脂质量对薏米中β-谷甾醇纯化效果的影响Fig.2 Effect of resin mass on the purification of β-sitosterol in Coix chinensis Tod.
2.2.2 进样浓度对薏米中β-谷甾醇纯化效果的影响 由图3可知,上样浓度从0.1 mg/mL增加到0.3 mg/mL时,吸附率和回收率都呈逐渐上升的趋势。当上样浓度为0.5 mg/mL时,薏米中β-谷甾醇的吸附率和回收率均达到最大值。不断增大上样浓度,当浓度大于0.5 mg/mL时,吸附率趋于稳定,而回收率不断下降,这是由于进样浓度大于树脂的吸附饱和度。当浓度过高时,树脂的再生次数增加,树脂使用周期缩短[17,24]。因此最佳上样浓度为0.5 mg/mL。

图3 进样浓度对薏米中β-谷甾醇纯化效果的影响Fig.3 Effect of injection concentration on the purification of β-sitosterol in Coix chinensis Tod.
2.2.3 洗脱剂浓度对薏米中β-谷甾醇纯化效果的影响 由图4可知,随着洗脱剂浓度的增加,薏米中β-谷甾醇的吸附率和回收率呈先上升后趋于平缓的趋势。当洗脱剂浓度为15%~75%时,β-谷甾醇的吸附率和回收率逐渐变大,当洗脱剂浓度为95%时,两者变化趋于稳定,因为乙醇浓度太高时,大部分杂质也会被洗脱出来[17,25-26],也为了节约成本,因此选择浓度为75%的乙醇进行洗脱。

图4 洗脱剂浓度对薏米中β-谷甾醇纯化效果的影响Fig.4 Effect of eluent concentration on purification of β-sitosterol in Coix chinensis Tod.
2.2.4 洗脱速度对薏米中β-谷甾醇纯化效果的影响 由图5可知,随着洗脱速度的增加,薏米中β-谷甾醇的吸附率、回收率都在下降,当洗脱速度为1 mL/min时,吸附率和回收率有最大值,当洗脱速度大于1 mL/min时,两者下降速度较为明显。由于洗脱速度过低,吸附在树脂内部的β-谷甾醇不能被充分洗脱,而当洗脱速度过快时,有部分β-谷甾醇不能被洗脱出来,使吸附率降低,从而导致回收率降低[26-27]。因此。最佳的洗脱速度为1 mL/min。
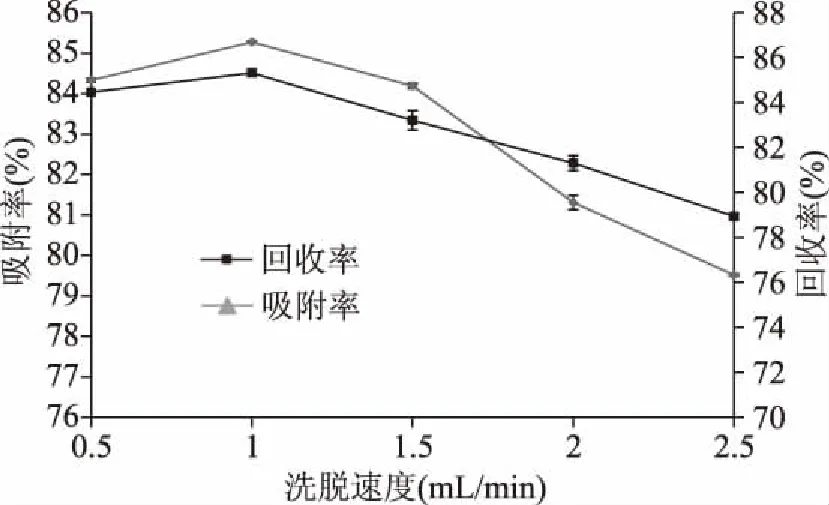
图5 洗脱速度对薏米中β-谷甾醇纯化效果的影响Fig.5 Effect of elution rate on purification of β-sitosterol in Coix chinensis Tod.
2.3 响应面优化实验
2.3.1 实验设计及结果 根据单因素实验结果,选择树脂质量、进样浓度、洗脱速度为考察因素,以β-谷甾醇回收率为响应值进行优化,得到的响应面实验结果见表2。
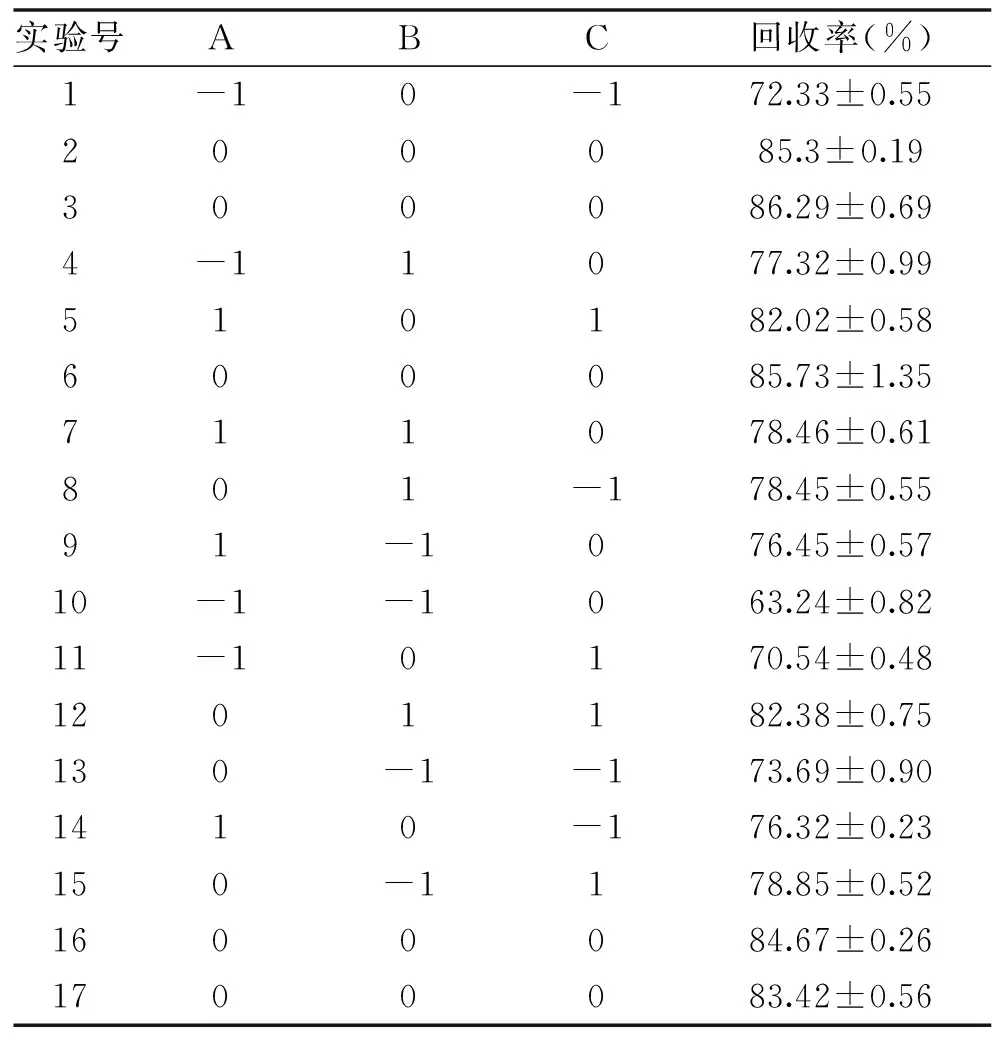
表2 响应面实验设计及结果Table 2 Design and results of response surface experiment
2.3.2 回归方程拟合及方差分析 利用Design Expert软件对实验数据进行回归分析,得到回归模型的方程为:Y=85.08+3.73A+3.05 B+1.63C-3.02AB+1.87AC-0.31BC-7.13A2-4.09B2-2.65C2。
由方差分析可知,模型p<0.0001,说明此回归方程差异极显著,失拟项p=0.1547>0.05,差异不显著。说明该方程与实际情况吻合较好,实验误差小。该回归方程的拟合度是97.41%(R2=0.9741),说明实际值与预测值拟合较好,实验方法可行。一次项A、B对回收率的影响极显著(p<0.01),C对回收率影响显著(p<0.05)。交互项AB、AC对回收率影响显著(p<0.05),而BC对回收率影响不显著(p>0.05)。二次项A2、B2、C2对回收率的影响都极显著(p<0.01)。

表3 方差分析结果Table 3 ANOVE of regression analysis
2.3.3 回收率的响应曲面分析 由图6可知,随着进样浓度和树脂质量的增加,回收率先逐渐上升然后平缓下降,响应值具有最大值。这是因为有效成分扩散到树脂中达到饱和时,增加上样浓度,会使有效成分发生泄漏,从而使回收率降低[27]。图的坡度越陡,等高线形状为椭圆形,表示树脂质量和进样浓度这两个因素交互作用显著[14]。
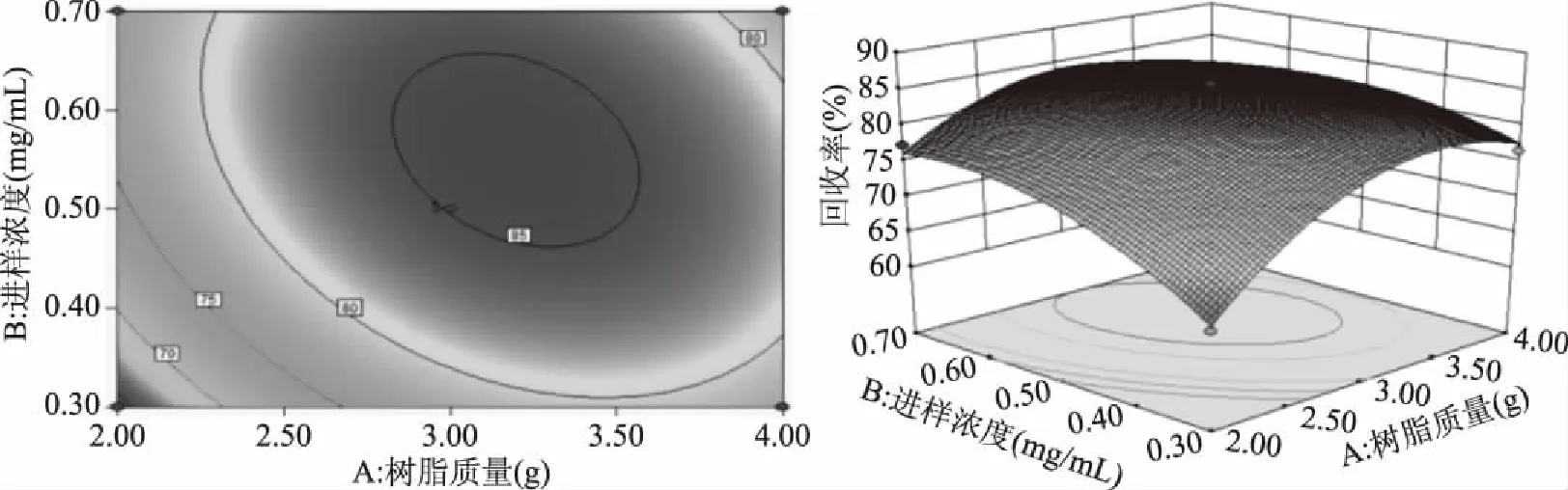
图6 树脂质量与进样浓度交互作用图Fig.6 Interaction between resin mass and injection concentration
由图7可知,回收率随着树脂质量的增加先上升后下降,不断加大洗脱速度,回收率增加的趋势较为平缓,因为树脂的量不够时,β-谷甾醇不能被完全洗脱出来,当树脂的量过多时,大部分杂质会随之洗脱下来,所以回收率会降低[27-28]。且图中等高线的形状为椭圆形,说明两因素之间的交互作用显著[14]。

图7 树脂质量与洗脱速度交互作用图Fig.7 Interaction between resin quality and elution rate
由图8可知,随着进样浓度和洗脱速度的增加,回收率上升的趋势缓慢,且等高线为圆形,说明这两个因素之间交互作用不显著。

图8 进样浓度与洗脱速度交互作用图Fig.8 Interaction between sample concentration and elution speed
2.3.4 验证实验 应用软件分析,得到最佳工艺参数为:树脂质量3.26 g,进样浓度0.55 mg/mL,洗脱速度1.19 mL/min,此条件下得到β-谷甾醇回收率的模型预测值为86.2707%。考虑到实际操作,将其修正为:树脂质量3 g,进样浓度0.55 mg/mL,洗脱速度1 mL/min。为了验证预测值的可靠性,在此条件下进行3次平行实验,得到β-谷甾醇回收率的平均值分别为85.35%、84.34%、85.77%,平均回收率为85.56%,与预测值86.2707%比较接近,说明该模型回归方程具有可靠性,可以应用于β-谷甾醇纯化工艺的研究。
2.4 AB-8大孔树脂纯化效果的测定
由图9可知,β-谷甾醇经AB-8大孔树脂纯化后,样品的纯度由原来的13.8%提高到76.17%。表明实验精密度较好,工艺条件稳定便于控制[28],AB-8树脂对β-谷甾醇的纯化具有显著效果。

图9 纯化前后样品纯度的对比Fig.9 Comparison of purity of samples before and after purification
2.5 抗氧化活性的比较
2.5.1β-谷甾醇对DPPH·清除能力 由图10可知,薏米中的β-谷甾醇对DPPH具有清除能力,且纯化后的样品对DPPH自由基的清除能力高于VC和纯化前的样品。当浓度为0.1 mg/mL时,VC对DPPH自由基的清除能力最高,当浓度为0.4 mg/mL时,三种溶液对DPPH自由基的清除能力几乎相同,随着浓度不断增大,对DPPH自由基的清除能力都呈不断上升的趋势,且经过AB-8树脂纯化后的样品对DPPH自由基的清除能力有显著提高[28-29]。

图10 纯化前后的样品与VC对DPPH清除能力的对比Fig.10 Comparison of DPPH scavenging ability of samples before and after purification with VC
2.5.2β-谷甾醇对·OH清除能力的研究 由图11可知,β-谷甾醇对于·OH具有一定的清除能力,纯化后的样品清除率最大,高于VC溶液和纯化前的样品。当浓度在0.05~0.1 mg/mL范围内,VC溶液和纯化前的样品对·OH的清除能力平缓上升;当浓度大于0.2 mg/mL时,两种样品的·OH清除率直线上升,后趋于稳定。浓度为0.05~0.2 mg/mL时,纯化后样品的清除能力上升幅度较大;当浓度大于0.2 mg/mL时,呈缓慢上升趋势。由此可见,浓度越高,纯度越好的样品对·OH的清除能力也越大[25,30-31]。

图11 纯化前后的样品与VC对·OH清除能力的对比Fig.11 Comparison of the scavenging ability of ·OH from samples before and after purification
3 结论
本实验通过比较三种树脂的吸附和解析力,将AB-8树脂作为分离纯化最佳的树脂。在单因素的基础上,对树脂质量、进样浓度、洗脱速度三个因素进行响应面分析,得到最佳工艺条件为:树脂质量3 g,进样浓度0.55 mg/mL,洗脱速度1 mL/min,此条件下得到β-谷甾醇回收率的平均值为85.56%±0.33%,与预测值86.2707%比较接近,β-谷甾醇的纯度由原来的13.8%提高到76.17%。将纯化前后的样品做抗氧化研究,表明纯度越高,抗氧化能力越大。
[1]杨梓晨,梁婧,刘雨晴,等. 薏米的成分分析[J]. 安徽农业科学,2011,39(2):756,758.
[2]金黎明,刘垠孜,赵晓蕾,等. 薏苡仁有效成分研究进展[J]. 安徽农业科学,2011,39(10):5734,5750.
[3]Bin Sayeed,Muhammad Shahdaat,Syeda Sadia Ameen. Beta-sitosterol:A promising but orphan nutraceutical to
Fight against cancer[J]. Nutrition and Cancer,2015,67(8):1216-1222.
[4]黄滢璋,赵雁武,周振中. 植物甾醇清除自由基活性研究[J]. 粮食科技与经济,2012,37(4):40-41,45.
[5]Awad,AB. Peanuts as a source of beta-sitosterol,a sterol with anticancer properties[J]. Nutrition and Cancer. United States,2000,36(2):238-241.
[6]李丹平. 红黑二丸中甾醇类物质提取、鉴定及生理活性的研究[D].武汉:华中农业大学,2011
[7]洪庆慈,王梅,姜伟,等.燕麦中主要甾醇的鉴定和效能实验[J].食品科学,2002(1):103-106.
[8]乌汉其木格. 裸燕麦麸皮中β-谷甾醇的分离提取及其特性研究[D].呼和浩特:内蒙古农业大学,2007.
[9]季慧,陈斌斌,黄越燕.大孔吸附树脂分离纯化生物碱类化合物研究进展[J].亚太传统医药,2017,13(1):72-75.
[10]Njinga,Ns. Isolation and antimicrobial activity ofβ-Sitosterol-3-O Glucoside from Lannea Kerstingii Engl. & K. Krause(Anacardiacea)[J]. Nitte University Journal of Health Science,2016,6(1):4-8.
[11]张冬阳,郭雪松.响应面法优化薏米中β-谷甾醇的提取工艺[J].食品工业科技,2017,38(22):206-209,241.
[12]万建春. 大豆脱臭馏出物中生育酚及甾醇单体的分离纯化[D].武汉:武汉工业学院,2008.
[13]叶松华,冯夏珍,王晓燕,等. Box-behnken设计优化黄刺玫果总黄酮纯化工艺研究[J/OL].中国食品添加剂,2017(10):73-79.
[14]张俊,李进,吕海英,等. 响应面法优化扁桃果皮熊果酸的纯化工艺[J/OL]. 食品与发酵工业,2017,43(10):170-176.
[15]Bhatlum,Singhs,Vermaa. Recovery of naringin from kinnow(Citrus reticulata Blanco)peels by adsorption-desorption technique using an indigenous resin[J]. Sadhana,2017,42(1):85-94.
[16]Lei Z,Xu Wang,Xiao lei Zhang,et al. Purification and identification of anti-inflammatory peptides derived from simulated gastrointestinal digests of velvet antler protein(Cervus elaphus Linnaeus)[J]. Journal of Food & Drug Analysis,2016,24(2):376-384.
[17]陈建中,葛水莲,昝立峰,等. 响应面优化大孔吸附树脂分离纯化茼蒿总黄酮[J]. 食品与发酵工业,2015,41(11):115-120.
[18]薛雪,孟宪军,李斌,等. AB-8大孔树脂分离纯化北五味子藤茎总木脂素的研究[J]. 食品与机械,2011,27(1):22-25.
[19]邓梦琴,林晓瑛,张明,等. 大孔树脂分离纯化菠萝蜜果皮黄酮工艺及其抗氧化活性研究[J]. 食品工业科技,2017,38(5):246-251,257.
[20]田瑶. 蓝莓中黄酮类物质的提取、分离纯化及生物活性研究[D].哈尔滨:东北农业大学,2012.
[21]刘海霞. 苹果籽油甾醇的分离、提取及其功能性评价[D].西安:陕西师范大学,2009.
[22]吴海成. 玉米须甾醇的提取纯化及抑菌活性[D].长春:吉林大学,2013.
[23]Fenglai L,Wei Huan,Wang Lei,et al. Separation and Purification of Macranthoidin B and Dipsacoside B from Flos Lonicerae by HP-20 and HP-SS Macroporous Resin[J]. Agricultural Science & Technology,2016,17(4):765-768.
[24]钟方丽,金龙哲,王晓林,等. 大孔吸附树脂纯化黄芪茎总黄酮的工艺及其抗氧化性[J]. 河南工业大学学报:自然科学版,2017,38(2):88-94.
[25]邹家丽. 山茶花(Camelliajaponica)花卉中多酚的提取、纯化及抗氧化活性研究[D].重庆:重庆师范大学,2013.
[26]李洁. 大孔吸附树脂在天然产物分离纯化中的应用研究[D].兰州:兰州理工大学,2011.
[27]张琳,赵凤平,江敏瑜,等. Box-Behnken响应面法优选大孔树脂分离纯化三七总皂苷的工艺研究[J]. 成都中医药大学学报,2017,40(3):57-61,127.
[28]邓梦琴. 菠萝蜜果皮总黄酮的提取、分离纯化、结构鉴定及其抗氧化活性研究[D].广州:华南农业大学,2016.
[29]Emad M,Azza A. Matloub,Mona E. Aboutabl,etal. Assessment of anti-inflammatory,antinociceptive,immunomodulatory,and antioxidant activities ofCajanuscajanL[J]. seeds cultivated in Egypt and its phytochemical composition. Pharmaceutical Biology,2016,54(8):1380-1391.
[30]Havyarimana L,et al. Chemical constituents of millettia barteri and their antimicrobial and antioxidant activities[J].Pharmaceutical biology. England,2012,50(2):141-146.
[31]Raviraj Anand Devkar,Shilpee Chaudhary,Sahithi Adepu,et al. Evaluation of antiurolithiatic and antioxidant potential of lepidagathis prostrate[J]. A pashanbhed plant.pharmaceutical biology,2016,54(7):1237-1245.
欢迎订阅《食品工业科技》

