油茶花青素还原酶基因克隆和体外功能研究
黄贝,李龙宝,吴信洁,何周,陈子怡,姚芳,杨华,*,宛晓春*
(1安徽农业大学茶树生物学与资源利用国家重点实验室,安徽合肥 230036;2 安徽农业大学理学院应用化学系,安徽合肥 230036)
油茶(Camellia oleiferaAbel.)和茶树(Camellia sinensisL.)同属于山茶科山茶属。油茶是我国特有的木本油料物种[1],其而其油脂代谢相关的[2-3]研究较多。茶树作为加工各类茶饮的重要经济林物种,其叶片富含儿茶素类(黄烷-3醇类)次生代谢物[4],并对茶叶品质的形成具重要影响。最近,Tai和Jiang通过比较研究发现茶树和油茶中儿茶素类成分的积累和分布差异较大[5-6]。儿茶素类物质的生物合成来自于植物类黄酮合成途径[6],Tai通过对两个物种比较转录组学的研究,鉴定了该途径相关的一些差异表达基因,包括花青素还原酶基因(ANR)。花青素还原酶具有催化花青素类还原形成儿茶素的作用[7],茶树ANR基因(CsANR)已经被克隆,且功能已获得验证[8],而油茶ANR基因(CoANR)尚未被克隆,其相关的功能也尚不明确。因而,本文对油茶ANR基因进行克隆,并对其原核表达的重组蛋白进行体外酶促反应活性的研究。
1 材料与方法
1.1 实验材料和试剂
1.1.1 实验材料
以成年油茶树(长林四号)为实验材料(安徽六安,德昌苗木公司),选取长势良好一致油茶植株,采集芽、一叶、茎和根样品,每个样品三个生物学重复,液氮速冻后于-80℃保存备用。1.1.2 实验试剂
儿茶素标品(C、EC、GC、EGC、ECG和EGCG,上海源叶标品公司),色谱级甲酸(阿拉丁公司,中国),色谱级甲醇(TEDIA,美国),色谱级乙酸等。KOD-Fx-plus高保真酶(TOYOBO公司,日本),rTaq酶(TaKaRa公司,大连),RNA提取试剂盒,胶回收试剂盒等。
1.2 油茶花青素还原酶基因的克隆
1.2.1 RNA的提取
预先准备 65℃水浴锅和 RNase灭活的研钵。取保存在-80℃的样品,在液氮中迅速研磨至粉末,采用TIANGEN试剂盒,按照厂家说明书提取总RNA。
1.3 油茶ANR全长基因的克隆
1.3.1 油茶ANR全长基因的克隆
基于已发表的茶树花青素还原酶基因(CsANR1和CsANR2,GenBank登录号为ADZ58166和ADZ58168)[8]和本实验室前期获得的油茶转录组序列[7]的比对分析,鉴定了两条同源的油茶花青素还原酶基因(CoANR1和CoANR2)的转录本。基于这两条转录本,进一步采用RACE结合嵌套PCR方法获得CoANR1和CoANR2的5’-UTR和3’-UTR序列,测序验证后的片段通过 MegAlign软件比对,再用EditSeq软件拼接获得全长序列。以ORF系列引物(CoANR1-ORF-F,CoANR1-ORF-R 和CoANR2-ORF-F,CoANR2-ORF-R)扩增CoANR1和CoANR2完整的ORF框。相关引物见表1。

表1 克隆油茶花青素还原酶基因的相关引物
1.3.2 ANR基因的进化树分析
将CoANR1和CoANR2ORF框翻译成氨基酸序列,用 MegAlign和 MEGA6.0软件将CoANR1和CoANR2的氨基酸序列与植物ANR基因的氨基酸序列进行比对,并采用邻接法构建进化树。采用的植物ANR蛋白包括进化树上缩写的基因物种及登录号为:CsANR1 (茶树,ADZ58166), CsANR2 (茶树,ADZ58166),AtANR(拟南芥, AT1G61720),PtANR (杨树,XP_002317270),TcANR (可可,ADD51353),VvANR (葡萄,CAD91911)MtANR (苜蓿, AAN77735), DkANR (柿树,BAF56654),FaANR1 (草莓,ABG76843),FaANR2 (草莓,ABD95362),LcANR (百脉根,ABC71337), MdANR (苹果,AEL79860),TrANR (白三叶,ADD09575),MsANR (紫花苜蓿, ADK95116)。
1.4 CoANR1和CoANR2基因的原核表达
1.4.1 CoANR1和CoANR2原核表达载体的构建
设计特异性重组引物设计CoANR1-pMAL-SalI-F,CoANR1-pMAL-SalI-R 和CoANR2-pMAL-SalI-F,CoANR2-pMALSalI-R(见表1)。选用pMAL-c5X表达载体,先用内切酶SalI切开,再采用一步克隆法试剂盒(One Step Clone Kit)将测序验证的CoANR1和CoANR2基因和载体进行连接,完成原核表达载体的构建。
1.4.2 CoANR1和CoANR2重组蛋白的纯化
将构建的表达载体导入大肠杆菌表达菌株BL21(DE3)中进行重组蛋白表达,挑选测序正确的单克隆菌株,加入4mL的LB培养基过夜培养14h,扩大成600mL培养体系,培养至OD值0.6左右,加1mM IPTG,25℃诱导6h,收集菌体,超声破碎,离心获取上清蛋白,用亲和树脂柱纯化获得CoANR1,CoANR2纯化蛋白,用 BCA蛋白定量试剂盒定量蛋白浓度。采用 SDS-PAGE电泳检测表达和纯化的蛋白。
1.4.3 CoANR1和CoANR2重组蛋白的体外酶活检测
基于 Xie[7]和 Qian[9]的方法对花青素还原酶体外酶活反应体系进行优化,该反应体系总体积100μL,包括30μg纯化重组蛋白,100 μM氯化矢车菊色素(或者氯化飞燕草色素),500mM NADPH,以及pH6.5的20mM磷酸缓冲液。37℃反应30min后用等体积甲醇终止反应,12000rpm冷冻离心,弃下层沉淀,得到的上清经 0.22μm有机膜过滤后获得反应产物的溶液。反应产物采用UPLC-MS/MS检测,A流动相为0.4%乙酸,B流动相为甲醇,洗脱条件:0~5 分钟, 5%~20%B,5~18 分钟,20%~25%B,18~25分钟,从25%~5%B。流速为0.2mL·min−1,检测波长278nm紫外光,进样量 2μL,反相柱 Kinetex1.7u XB-C18 100A column (Phenomenex 30 mm×2.1 mm)。质谱仪检测采用 MRM 模式(m/z 100~800),鞘气温度325℃,流速6L·min−1,干燥气流温度325℃,毛细管电压45psi。
2 结果与分析
2.1 油茶ANR全长基因的克隆
2.1.1 油茶不同器官总 RNA的提取和质量检测提取的油茶不同器官总RNA经检测浓度较高,其A260/A280和A260/A230值表明RNA质量较好,没有污染(表2)。经凝胶电泳胶检测RNA条带完整,没有出现弥散。因此,提取的RNA质量较好,能满足后续实验的要求。
表2 油茶不同器官RNA浓度和质量检测结果
图1 不同器官RNA凝胶电泳图
2.1.2 油茶ANR全长基因的克隆
通过 RACE和RT-PCR结合的方法,获得油茶CoANR1和CoANR2基因的全长序列,菌落PCR的结果见图2。将阳性菌落测序,获得 COANR1(登录号:MG925480)全长 1441bp,包括ORF框1047bp,5’UTR区188bp,3’UTR区 206bp。ORF框编码 348个氨基酸残基,肽链分子量大小 37.4KDa,等电点 PI 为5.52;获得COANR2(登录号:MG925481)全长1413bp,包括ORF框1014bp,5’UTR区155bp,3’UTR区244bp。ORF框编码337个氨基酸残基,肽链分子量大小36.2KDa,等电点 PI 为 6.5。
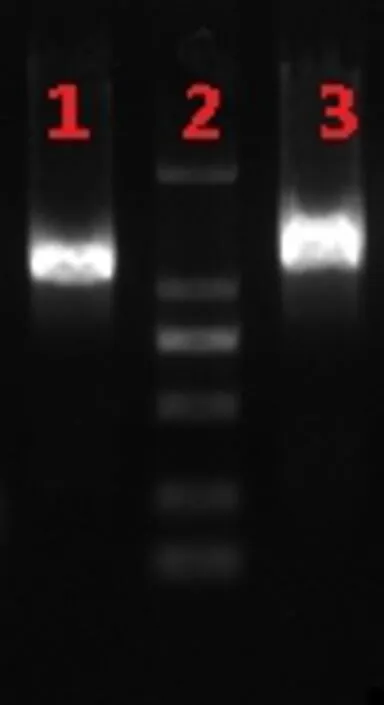
图2 CoANR1和CoANR2 菌落PCR检测结果
2.1.3 ANR基因的进化树分析
将CoANR1和CoANR2基因与GenBank数据库中登录一些植物ANR基因的氨基酸序列进行Blast比对并构建了系统进化树(图3)。CoANR1和茶树同源性为97%,和柿树,葡萄,紫花苜蓿比对的同源性分别为97%,78%,79%,73%;CoANR2和茶树同源性为99%,和百脉根,柿树和苹果的同源性分别为 99%,77%,86%,82%。进化树分析表明,CoANR1和CoANR2分别与茶树CsANR1和CsANR2亲缘性最高,并与柿树、葡萄、可可和杨树ANR在同一进化树分支上。

图3 油茶与其他物种花青素还原酶基因的系统进化树
2.2 CoANR1和CoANR2重组蛋白的制备和体外酶活检测
2.2.1 CoANR1和CoANR2重组蛋白的制备
含有CoANR1和CoANR2完整ORF序列的质粒经测序验证后,采用pMAL-c5X载体,基于Vazyme公司的一步克隆法构建原核表达载体,再将表达载体导入表达菌株(BL21),诱导表达后在大肠杆菌破碎上清中获得重组的目的粗蛋白(见图4泳道2和4),经SDSPAGE检测表明目的蛋白与预测表达蛋白的分子量大小一致。重组粗蛋白进一步经过亲和树脂纯化后获得相应的纯化重组蛋白(见图4泳道3和5),经SDS-PAGE检测纯化蛋白杂带较少,目的蛋白显著富集(图4)。
2.2.2 CoANR1和CoANR2重组蛋白体外酶活检测
将纯化后的CoANR1和CoANR2重组蛋白用于体外酶促反应,并用LC-MS检测反应产物。结果表明,CoANR1和CoANR2重组蛋白都可以催化花青素还原反应产生儿茶素,当底物为矢车菊色素时,CoANR1和CoANR2都能将其催化成C和EC;当底物为飞燕草色素时,CoANR1和CoANR2都能其催化成GC和EGC(图5)。

图4 CoANR1和CoANR2重组蛋白的SDS-PAGE检测图

图5 CoANR1和CoANR2重组蛋白体外酶促反应产物的质谱检测(a)底物为矢车菊色素的催化产物 ; (b)底物为飞燕草色素的催化产物
3 讨论
本研究克隆了两条油茶花青素还原酶的全长基因,并对油茶重组CoANR1和CoANR2蛋白进行体外酶活检测。结果表明两者均具有催化花青素转化为儿茶素的功能。这一结果与茶树重组 CsANR1和 CsANR2蛋白体外酶促反应催化矢车菊色素和飞燕草色素的产物相同[8]。然而在Tai和Jiang[5-6]的研究中发现,茶树中(尤其在幼嫩叶部)积累的总儿茶素含量显著高于油茶[5-6]。本研究尽管发现茶树和油茶ANR重组蛋白体外催化功能相似,但是茶树和油茶ANR蛋白的体内催化功能尚不明确,有待将来进一步研究和比较。此外,Tai通过茶和油茶叶部的比较转录组研究发现两个物种儿茶素合成途经关键酶相关基因表达存在显著差异,其中茶树ANR基因表达显著高于油茶ANR基因,基因转录水平的差异可能导致最终代谢产物积累的差异,但是相关的基因调控的分子机制还有待将来进一步的深入研究。
[1]黎先胜. 我国油茶资源的开发利用研究[J]. 湖南科技学院学报, 2005, 26(11):127-129.
[2]Xia E H, Jiang J J, Huang H, et al. Transcriptome analysis of the oil-rich tea plant, Camellia oleifera, reveals candidate genes related to lipid metabolism.[J]. Plos One,2014, 9(8):e104150.
[3]Chan A P, Crabtree J, Zhao Q, et al. Draft genome sequence of the oilseed species Ricinus communis[J].Nature Biotechnology, 2010, 28(9):951-6
[4]宛晓春. 茶叶生物化学[M]. 中国农业出版社, 2003.
[5]Tai Y, Wei C, Yang H, et al. Transcriptomic and phytochemical analysis of the biosynthesis of characteristic constituents in tea (Camellia sinensis) compared with oil tea(Camellia oleifera)[J]. BMC Plant Biology,15,1(2015-08-07), 2015, 15(1):190.
[6]Jiang X, Hou H, Zhang S, et al. Comparison of phenolic compound accumulation profiles in eight evergreen woody core eudicots indicating the diverse ecological adaptability of Camellia sinensis[J]. Scientia Horticulturae, 2017,219:200-206.
[7]Xie D Y, Sharma S B, Dixon R A. Anthocyanidin reductases from Medicago truncatula, and Arabidopsis thaliana[J]. Archives of Biochemistry & Biophysics, 2004,422(1):91-102.
[8]Pang Y, Abeysinghe I S B, He J, et al. Functional Characterization of Proanthocyanidin Pathway Enzymes from Tea and Their Application for Metabolic Engineering[J].Plant Physiology, 2013, 161(3):1103-1116.
[9]Qian Y, Zhao X, Zhao L, et al. Analysis of stereochemistry and biosynthesis of epicatechin in tea plants by chiral phase high performance liquid chromatography[J].Journal of Chromatography B, 2015, 1006(Print):1-7.

