右美托咪定复合曲马多在颅脑外伤患者开颅术后镇痛中的应用
王梅,李正民
(空军军医大学附属唐都医院麻醉科,陕西 西安 710038)
随着医疗技术的发展,神经外科手术种类明显增多。脑肿瘤、颅脑外伤、脑血管瘤等多数患者均需行开颅手术,但该术式容易损伤机体,引起反射性应激反应,导致颅内压增高,在使患者生命健康受到严重威胁的同时也给麻醉操作带了很大困难[1]。作为非阿片类中枢性镇痛药,曲马多既可作用于μ-阿片类受体,又可作用于去甲肾上腺素和5-羟色胺两条下行痛觉一直传导通路,在术后镇痛中显示出较高临床价值,但术后恶心、呕吐发生率较高[2]。右美托咪定为开颅手术麻醉过程中的辅助用药,具有较强的镇痛、镇静及抑制交感活性等作用,且患者苏醒迅速、无呼吸抑制[3]。研究[4]发现,术后静脉自控镇痛(PCIA)中辅助使用右美托咪定可减少镇痛药物剂量,降低不良反应发生率。因此,本研究拟对右美托咪定复合曲马多在颅脑外伤患者开颅术后镇痛中的效果进行评估,现报告如下。
1 资料与方法
1.1 一般资料
选取2016年3月至2017年11月在空军军医大学附属唐都医院择期行开颅手术患者75例,美国麻醉医师协会(ASA)评分均为I~II级,排除心脏传导阻滞、严重肝肾功能障碍、长期使用镇痛药及慢性头痛史者。按照随机数字表法,将患者分为A、B、C 3组,每组各25例。A组:男性11例,女性14例;年龄16~63岁,平均(42.8±5.4)岁;体重(55.7±8.2)kg。B组:男性12例,女性13例;年龄18~65岁,平均(44.2±5.9)岁;体重(54.5±8.6)kg。C组:男性10例,女性15例;年龄19~66岁,平均(44.5±6.1)岁;体质重(56.2±8.3)kg。
1.2 方法
A组不给于右美托咪定。B、C组在麻醉诱导前,均于10 min内静脉泵注右美托咪定1 μg/kg的负荷剂量,而后分别以0.2 μg·kg-1·h-1及0.4 μg·kg-1·h-1速率进行泵注,至术后24 h停止。麻醉诱导:丙泊酚、瑞芬太尼各3 μg/mL进行靶控输注,顺式阿曲库铵0.2 mg/kg于患者意识消失后给予,行气管插管同时控制呼吸,以七氟烷、瑞芬太尼、顺式阿曲库铵维持麻醉。手术期间,对3组患者血压、心电图及血氧饱和度(SpO2)进行连续监测,曲马多1.5 mg/kg于硬脑膜缝合后静脉给予。手术结束时接镇痛泵,镇痛泵配方:镇痛泵内加入昂丹司琼8 mg、曲马多按0.25 mg/(kg·h)的泵注速度加入泵内配至150 mL。设定背景剂量为2 mL/h,锁定时间15 min,单次给药量1 mL。
1.3 观察指标
观察3组不同时点心率(HR)、血压、呼吸频率(RR)、SpO2等血流动力学指标及Ramsay评分、视觉模拟评分(VAS)变化,Ramsay评分越高则镇静效果越好,VAS评分越高则镇痛效果越差[5];记录3组镇痛泵总按压次数及不良反应发生情况。
1.4 统计学分析
2 结果
2.1 手术前后血流动力学变化
3组一般资料比较差异无统计学意义(P>0.05),具有可比性。术前,3组HR、RR、收缩压(SBP)、舒张压(DBP)、SpO2比较无显著差异(P>0.05)。与术前及A组比较,B组术后2~6 h SBP、DBP及术后2~24 h HR明显降低,C组术后2~24 h SBP、DBP和HR明显降低,其中C组HR降低幅度显著大于B组,差异有统计学意义(P<0.05或0.01)。3组术后2~48 h RR及SpO2比较无显著差异,见表1。
2.2 术后不同时点Ramsay、VAS评分
术后2~48 h,B、C组Ramsay评分显著高于A组,其中C组术后6~48 h显著高于B组(P<0.05或P<0.01);术后6~48 h,B、C组VAS评分显著低于A组,其中C组降低幅度更为显著(P<0.05或0.01)。见表2。
2.3 镇痛泵总按压情况
A、B、C 3组镇痛泵总按压次数分别为(8.9±2.1)次、(7.1±1.8)次和(4.3±1.5)次,B、C组总按压次数较A组明显减少,其中C组总按压次数最少(P<0.01)。
2.4 术后不良反应
B、C组口干发生率明显高于A组(P<0.05);C组恶心呕吐发生率明显低于A组(P<0.05),略低于B组,但差异无统计学意义(P>0.05)。见表3。
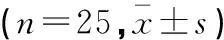
表1 3组术前及术后不同时间点血流动力学指标比较
*P<0.05,**P<0.01,与术前相比;#P<0.05,##P<0.01,与A组相比;△P<0.05,与B组相比。
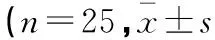
表2 3组术后不同时间点Ramsay、VAS评分的变化分)
**P<0.01,与术前相比;#P<0.05,##P<0.01,与A组相比。

表3 术后不良反应[n(%)]
*P<0.05,与A组相比。
3 讨论
开颅术后疼痛较为常见,多数患者会在颅脑术后48 h内遭受中到重度疼痛[6]。而不充分的镇痛治疗可使患者交感神经兴奋,引发应激反应,导致血压升高、烦躁、恶心呕吐等症状,从而增加颅内出血的风险,不利于术后恢复。临床关于中度到重度疼痛的治疗常采用阿片类药物,但该药物可能对神经外科术后的神经学检查造成影响,掩盖颅内事件,同时还可造成呼吸抑制、瞳孔缩小、颅内压升高等,甚至引发脑水肿[7]。
曲马多为中枢性非吗啡类镇痛药,通过使去甲肾上腺素和5-羟色胺再摄取受阻来激活抑制性疼痛途径,具有作用范围广、镇痛效果佳、成瘾性低的特点,可用于各种急慢性疼痛的治疗[8]。由于曲马多不影响血小板或凝血功能,故在开颅手术中的应用较为安全,但因与阿片样物质受体作用较弱,可能出现恶心呕吐、口干、眩晕等不良反应,使其临床应用受到限制[9]。作为非阿片类药物,右美托咪定不仅可通过作用于大脑蓝斑α2受体产生镇静作用,还可通过作用于脊髓及蓝斑α2受体产生镇痛作用,与安定的镇静机制有所不同,其镇静效果被认为是目前最接近于自然睡眠的镇静方式[10-11]。研究[12]发现,右美托咪定有助于缓解大脑缺血性损伤,降低脑代谢,对手术所致脑损伤具有一定保护作用。本研究将右美托咪定复合曲马多用于开颅术后镇痛,结果显示与术前及A组比较,B组术后2~6 h血压及术后2~24 h心率明显降低,C组术后2~24 h血压和心率明显降低,其中C组心率降低幅度显著大于B组,考虑与右美托咪定抑制儿茶酚胺释放有关[13]。Cooper等[14]认为,在规定剂量范围内,无需干预右美托咪定所致的心率及血压降低,其多在正常范围内,对安全不会造成影响。3组术后2~48 h RR及SpO2比较无显著差异,说明右美托咪定复合曲马多对开颅术后患者的呼吸无明显影响。术后6~48 h,B、C组Ramsay评分显著高于A组,VAS评分显著低于A组,但C组升高及降低幅度更为显著,说明右美托咪定复合曲马多具有更强的镇静、镇痛效应,尤其是0.4 μg的右美托咪定复合曲马多。此外,C组恶心呕吐发生率明显低于A组,略低于B组,考虑与镇痛泵总按压次数有关,即曲马多用量会随镇痛泵按压次数的减少而减少,故导致恶心呕吐发生率有所降低。目前,关于右美托咪定本身对恶心呕吐影响的研究较为少见,其作用机制和效果尚需研究进一步证实。
综上所述,右美托咪定复合曲马多用于开颅术后的镇痛效果确切,镇静作用佳,有助于减少术后恶心呕吐的发生,且对呼吸无明显影响,尤其是0.4 μg的右美托咪定复合曲马多。
[1] Vacas S,Van de Wiele B.Designing a pain management protocol for craniotomy:A narrative review and consideration of promising practices[J].Surg Neurol Int,2017,8(1):291.
[2] Kundra TS,Kuthiala G,hrivastava A,etal.A comparative study on the efficacy of dexmedetomidine and tramadol on post-spinal anesthesia shivering[J].Saudi J Anaesth,2017,11(1):2-8.
[3] 范智波.右美托咪定对开颅手术患者术中疼痛的影响[J].实用药物与临床,2016,19(2):193-196.
[4] 王萍,丛海涛,徐韶怡.右旋美托咪定联合舒芬太尼在术后静脉自控镇痛中的应用[J].实用医学杂志,2011,27(2):290-292.
[5] 胡伟,安礼俊,李金玉,等.右美托咪定复合不同剂量曲马多对患儿术后静脉自控镇痛的效果[J].临床麻醉学杂志,2013,29(11):1099-1101.
[6] Klimek M,Ubben JF,Ammann J,etal.Pain in neurosurgically treated patients: a prospective observational study[J].J Neurosurg,2006,104(3):350-359.
[7] 张永燕,许华.神经外科围术期多模式镇痛治疗研究进展[J].临床麻醉学杂志,2017,33(5):515-518.
[8] 谢菡,阿罗那,葛卫红.曲马多代谢相关基因多态性研究进展[J].现代生物医学进展,2015,15(19):3797-3800.
[9] 周永伟,贺静,杨涛,等.曲马多复合右美托咪定用于后颅窝手术术后镇痛效果观察[J].重庆医学,2015,44(5):660-661.
[10] Madden CJ,Tupone D,Cano G,etal.α2 Adrenergic receptor-mediated inhibition of thermogenesis[J].J Neurosci,2013,33(5):2017-2028.
[11] 王涛,杨晓明,王珊珊.右美托咪定对全麻下脊柱手术患者术后寒颤的治疗作用[J].川北医学院学报,2015,30(2):191-194.
[12] 杨坤渹.右美托咪定对体外循环下心脏瓣膜置换术患者脑损伤的保护作用[J].重庆医学,2014,43(1):67-68.
[13] Engelhard K,Werner C,Kaspar S,etal.Effect of the alpha2-agonist dexmedetomidine on cerebral neurotransmitter concentrations during cerebral ischemia in rats[J].Anesthesiology,2002,96(2):450-457.
[14] Cooper L,Candiotti K,Gallagher C,etal.A randomized, controlled trial on dexmedetomidine for providing adequate sedation and hemodynamic control for awake,diagnostic transesophageal echocardiography[J].J Cardiothorac Vasc Anesth,2011,25(2):233-237.

