1H-MRS采用短回波扫描在超急性脑梗死治疗中的应用价值
尚文文,薛莲,张慧丽,薛海林,孙军*
脑血管疾病具有高发病率、高致残率及高死亡率,已成为危害人类健康最主要的疾病之一,尤其是在我国,脑血管疾病已成为第一死亡原因[1]。随着对该疾病认识的不断深入,在我国脑卒中的死亡率都呈明显下降的趋势,但如何降低发病率、患病率及提高急性脑血管疾病的治愈率,成为目前临床中研究的热点之一。研究发现[2-3]磁共振波谱成像技术能够无创性检测脑梗死患者机体内生化与代谢改变,为脑梗死的早期诊断、病情发展变化及预后提供了越来越准确的资料,可减少脑卒中给家庭、社会带来的巨大损失。因此,本文通过探究急性脑梗死的磁共振波谱成像特点及临床应用,为临床更好治疗急性脑梗死提供依据。
1 材料与方法
1.1 临床资料
收集南京医科大学附属南京医院2015年3月至2016年9月超急性脑梗死患者28例,男17例,女11例,年龄49~74岁,平均(66.67±6.44)岁,发病时间均在6 h以内,以偏身感觉障碍、偏身四肢无力入院。准入标准:①符合全国第四届脑血管病学术会议制订的诊断标准,神经功能缺损具有可评估性;②发病时间明确;③头颅扩散加权成像(diffusion-weighted imaging,DWI)明确为急性脑梗死,DWI显示梗死灶主要分布于半卵圆中心、基底节区及侧脑室旁,单侧单发梗死灶;④患者或亲属签署知情同意书。排除标准:①CT检查发现脑出血患者;②既往有脑梗死患者;③无法完成磁共振成像(magnetic resonance imaging,MRI)、质子磁共振波谱(1H magnetic resonance spectroscopy,1H-MRS)检查者;④严重的心、肺、肝、肾功能不全者。
1.2 影像学检查
患者入院符合溶栓治疗标准且本人或家属签订手术同意书者给予溶栓治疗,否则进行临床常规内科治疗,其中12例患者进行溶栓治疗,16例纳入临床常规内科治疗(非溶栓治疗)。患者经1 w治疗后待病情稳定后行常规MRI和多体素1H-MRS扫描。所用设备是Philips Achieva 3.0 T MR仪(Philips TX Medical Systems,Netherlands),采用8通道头线圈。行常规MRI扫描包括轴、矢状位T1WI、T2WI和FLAIR,扫描参数设置为:T1WI:采用TSE序列,TR=2000 ms,TE=20 ms,矩阵384×194,层厚6 mm,间隔0.6 mm,FOV 180×230;T2WI:采用IR-TSE序列,TR=3000 ms,TE=80 ms,矩阵384×194,层厚6 mm,间隔0.6 mm,FOV 180×230;FLAIR:采用longTR序列,TR=9000 ms,TE=120 ms,矩阵352×245,层厚6 mm,间隔1 mm,FOV 180×230;DWI检查采用SE EPI序列,参数设置为:TR=2200 ms,TE=85 ms,矩阵140×130,层厚6 mm,间隔0.6 mm,FOV 230×230,扩散敏感系数为1000 s/mm2。选取DWI显示的病变中心层面,避免来自头皮、颅底骨骼、脂肪和脑脊液的干扰而尽量包括病变中心区(该区中DWI或T2WI图像所示高信号区占90%以上)、病灶边缘区(该区中DWI或T2WI图像所示高信号区占30%以下)、病灶周围正常区(该区中不含有DWI或T2WI图像所示高信号区且存在一定距离)与对侧区域,进行体素定位,并选取体素厚度10 mm行多体素1H-MRS扫描,其相关参数:2D-CSI STEAM序列(ECHO,TRA,TR/TE=1200 ms/35 ms,FOV 200 mm×185 mm,VOI 100 mm×100 mm,体素12 mm×12 mm,NEX=4),用时4 min 56 s。
1.3 图像处理与病理分析
1H-MRS检查结果利用Philips后处理工作站自动进行处理,包括软件自动完成信号平均、基线校正、相位校正、代谢物的识别和N-乙酰天门冬氨酸(N-acetylpartate,NAA)、总肌酸(肌酸+磷酸肌酸)(Creatine,Cr)、胆碱化合物(Choline,Cho)、乳酸(Lactate,Lac)、肌醇(Myo-inositol,mI)及谷氨酸复合物(Glutamine/Glutamate,Glx)等所对应波谱线下面积的计算,并分别计算NAA/Cr、Cho/Cr、NAA/Cho等比值,并分析其与患者预后的相关性。
1.4 神经功能缺损评分
在患者入院时及治疗2 w出院时的神经功能缺损评分由同一神经内科医师对患者进行评分,评分标准参见美国国立卫生院神经功能缺损评分(National Institutes of Health Stroke Scale,NIHSS),NIHSS分值越高,神经功能缺损越严重,预后越差。
1.5 统计学处理
应用SPSS 16.0统计软件进行数据分析,计量资料用均数±标准差(x±s)表示,对计量资料采用t检验;采用Spearman秩相关分析Cr、Cho、NAA、Lac与患者预后相关性;P<0.05为差异有统计学意义。
2 结果
2.1 常规MRI表现及NIHSS评分
28例急性脑梗死患者共28个梗死病灶,均为单侧单发病灶(图1),3例梗死灶位于半卵圆中心区,16例梗死灶位于基底节区,9例梗死灶位于侧脑室旁,其中3例患者的梗死灶较大,累及额顶颞叶,梗死面积占半球的30%左右,且3例患者出院时的NIHSS分值等于或大于入院时分值。溶栓组患者入院时的NIHSS分值为10.14±2.05,出院时的NIHSS分值为6.29±3.10;二者差异具有统计学意义(P<0.05);非溶栓组患者入院时的NIHSS分值为5.75±0.90,出院时的NIHSS分值为3.25±0.67;二者差异具有统计学意义(P<0.05);溶栓组与非溶栓组患者入院时的NIHSS分值差异具有统计学意义(P<0.05),但出院时的NIHSS分值差异无统计学意义(P>0.05)。
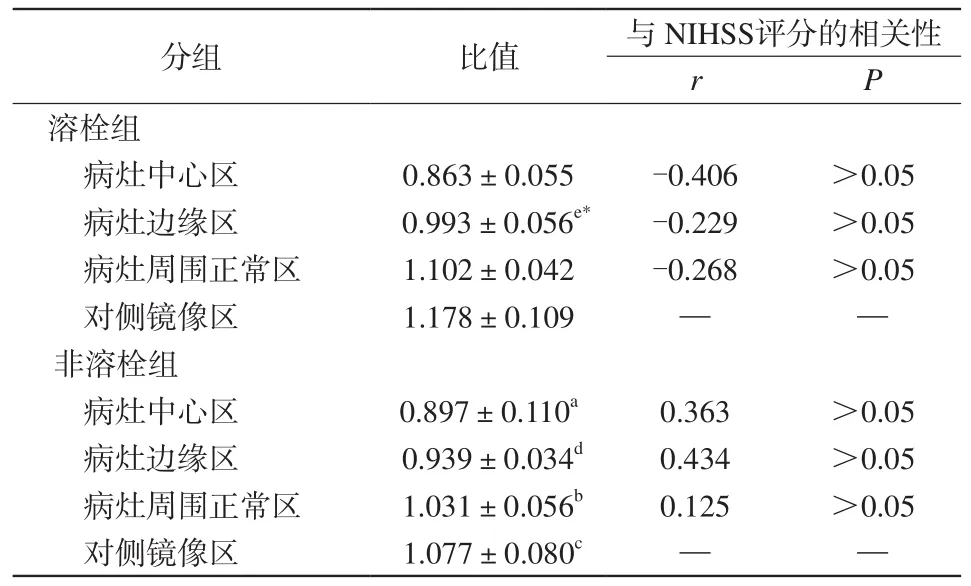
表1 溶栓组与非溶栓组梗死灶中心区、边缘区及周围正常区与自身镜像区NAA/Cr比值的比较Tab.1 Comparison of ratio of NAA/Cr in the infraction center,the border region, the normal region around the lesion and the contralateral area between thrombolysis group and nonthrombolysis group
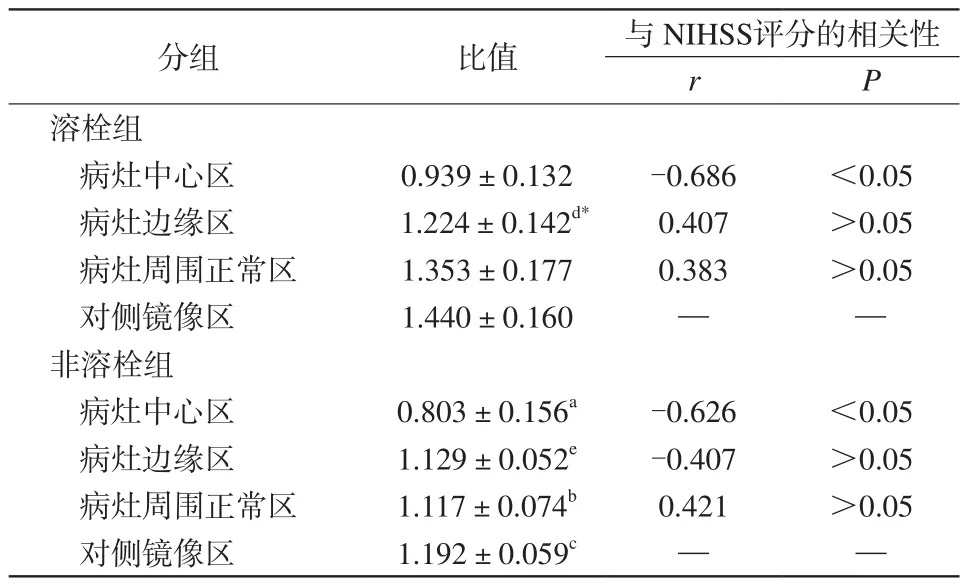
表2 溶栓组与非溶栓组梗死灶中心区、边缘区及周围正常区与自身镜像区NAA/Cho比值的比较Tab.2 Comparison of ratio of NAA/Cho in the infraction center, the border region, the normal region around the lesion and the contralateral area between thrombolysis group and non-thrombolysis group
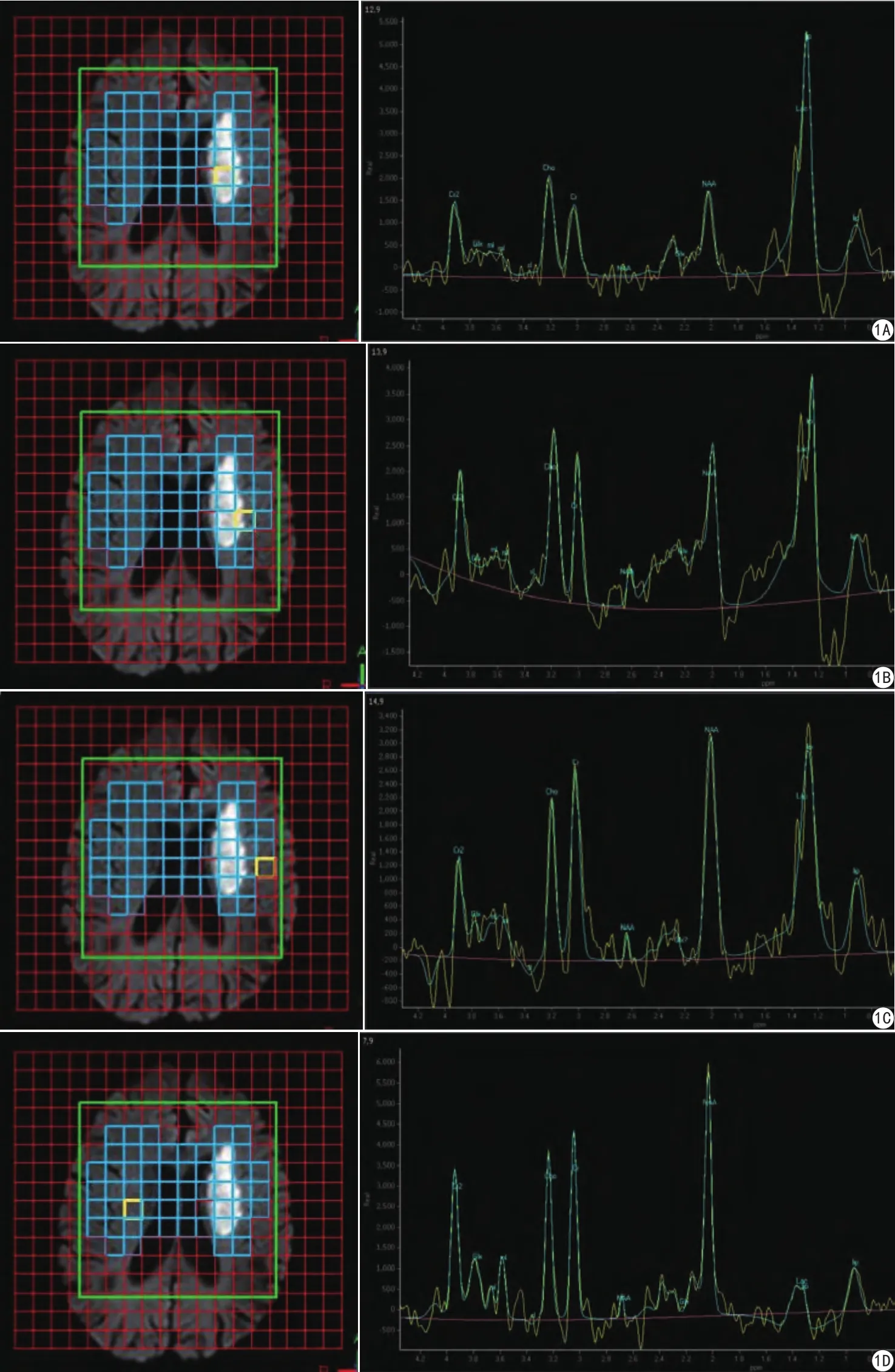
图1 男,69岁,因“右侧肢体乏力伴口齿不清6 h”入院,非溶栓治疗。A为病灶中心区MRS谱,B为病灶边缘区MRS谱,C为病灶周围正常区MRS谱,D为病灶中心对侧镜像区MRS谱。MRS谱线显示病灶侧区域的NAA、Cho、Cr、NAA/Cr、NAA/ Cho较对侧镜像区不同程度下降;Cho/Cr、Lac/Cr等值升高Fig. 1 Male, 69 years old, admitted to the hospital for " weakness of the right limb with speak with a lisp for 6 hours", and was not treated with thrombolytic therapy. A was the MRS in the infraction center, B was the MRS in the border region of the lesion, C was the MRS in the normal region around the lesion, and D was the MRS in the the contralateral area of the infraction center. The MRS showed that the concentration of NAA, Cho, Cr and the ratios of NAA/Cr and NAA/Cho in the infraction center decreased to some extent compared with contralateral area, the ratios of Cho/Cr and Lac/Cr increased.
2.2 超急性期脑梗死患者溶栓组与非溶栓组病灶不同区域NAA/Cr值比较
非溶栓组病灶中心区NAA/Cr值均明显低于其他区域(P<0.05),病灶边缘区NAA/Cr比值明显低于病灶周围正常区域(P<0.05);各病灶区域NAA/Cr值与出院时临床NIHSS评分无明显相关性(P>0.05)。溶栓组病灶边缘区NAA/Cr比值明显低于对侧镜像区域(P<0.05),各病灶区域NAA/Cr值与出院时临床NIHSS评分无明显相关性(P>0.05)。溶栓组病灶边缘区域NAA/Cr值明显高于非溶栓组,差异具有统计学意义(P<0.05),见表1。
2.3 超急性期脑梗死患者溶栓组与非溶栓组病灶不同区域NAA/Cho值比较
非溶栓组病灶中心区NAA/Cho值均明显低于其他区域(P<0.05),病灶边缘区NAA/Cho比值明显低于对侧镜像区域(P<0.05);病灶中心区NAA/Cho值与出院时临床NIHSS评分呈明显负相关(P<0.05)。溶栓组病灶边缘区NAA/Cho比值明显低于病灶周围正常区域(P<0.05),病灶中心区NAA/Cho值与出院时临床NIHSS评分呈明显负相关(P<0.05)。溶栓组病灶边缘区域NAA/Cho值明显高于非溶栓组,差异具有统计学意义(P<0.05),见表2。
2.4 超急性期脑梗死患者溶栓组与非溶栓组病灶不同区域Cho/Cr值比较
溶栓组与非溶栓组病灶中心区Cho/Cr值明显高于病灶边缘区(P<0.05),与其他区域比较差异无统计学意义(P>0.05),溶栓组与非溶栓组病灶中心区Cho/Cr值与出院时临床NIHSS评分具有明显相关性(P<0.05)。溶栓组与非溶栓组组间比较差异无统计学意义(P>0.05),见表3。
2.5 超急性期脑梗死患者溶栓组与非溶栓组病灶不同区域Lac/Cr值比较
溶栓组与非溶栓组病灶各区域间Lac/Cr值比较差异无统计学意义(P>0.05),溶栓组与非溶栓组病灶边缘区域Lac/Cr值与出院时临床NIHSS评分具有明显相关性(P<0.05)。溶栓组病灶中心区、病灶边缘区及病灶周围正常区Lac/Cr值明显低于非溶栓组,差异具有统计学意义(P<0.05),见表4。
2.6 超急性期脑梗死患者溶栓组与非溶栓组病灶不同区域mI/Cr值比较
非溶栓组病灶中心区mI/Cr值均明显高于病灶边缘区域(P<0.05);病灶各区域mI/Cr值与出院时临床NIHSS评分无明显相关性(P>0.05)。溶栓组病灶边缘区mI/Cr值明显低于对侧镜像区域(P<0.05),病灶中心区mI/Cr值与出院时临床NIHSS评分呈明显负相关(P<0.05)。溶栓组病灶边缘区域mI/Cr值明显高于非溶栓组,差异具有统计学意义(P<0.05),见表5。
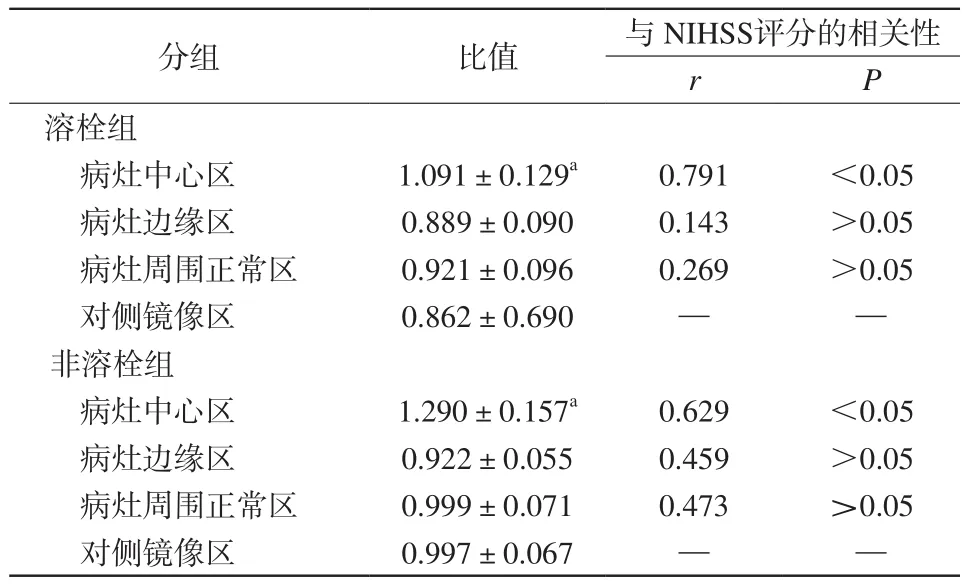
表3 溶栓组与非溶栓组梗死灶中心区、边缘区及周围正常区与自身镜像区Cho/Cr比值的比较Tab.3 Comparison of ratio of Cho/Cr in the infraction center,the border region, the normal region around the lesion and the contralateral area between thrombolysis group and nonthrombolysis group
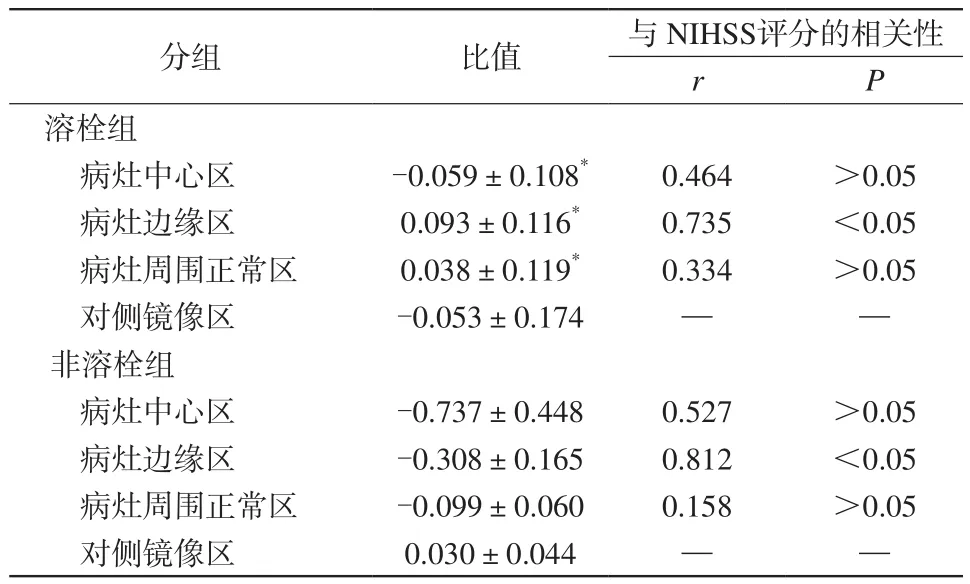
表4 溶栓组与非溶栓组梗死灶中心区、边缘区及周围正常区与自身镜像区Lac/Cr比值的比较Tab.4 Comparison of ratio of Lac/Cr in the infraction center,the border region, the normal region around the lesion and the contralateral area between thrombolysis group and nonthrombolysis group
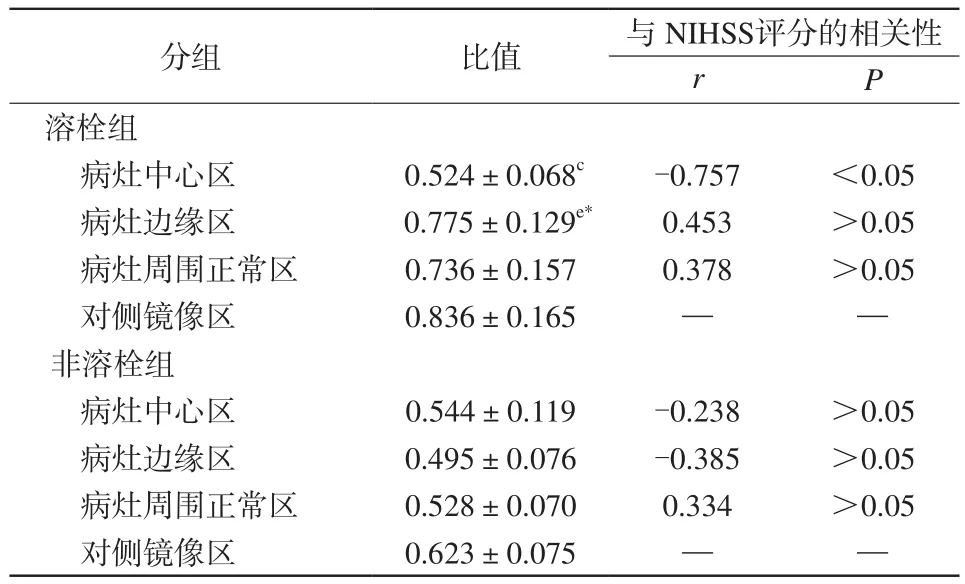
表5 溶栓组与非溶栓组梗死灶中心区、边缘区及周围正常区与自身镜像区mI/Cr比值的比较Tab.5 Comparison of ratio of mI/Cr in the infraction center,the border region, the normal region around the lesion and the contralateral area between thrombolysis group and nonthrombolysis group

表6 溶栓组与非溶栓组梗死灶中心区、边缘区及周围正常区与自身镜像区Glx/Cr比值的比较Tab.6 Comparison of ratio of Glx/Cr in the infraction center,the border region, the normal region around the lesion and the contralateral area between thrombolysis group and nonthrombolysis group
2.7 超急性期脑梗死患者溶栓组与非溶栓组病灶不同区域Glx/Cr值比较
非溶栓组病灶中心区Glx/Cr值均明显高于对侧镜像区域(P<0.05);病灶中心区Glx/Cr值与出院时临床NIHSS评分呈明显负相关性(P<0.05)。溶栓组各区域Glx/Cr值比较差异无统计学意义(P>0.05),病灶中心区Glx/Cr值与出院时临床NIHSS评分呈明显负相关性(P<0.05)。溶栓组病灶中心区Glx/Cr值明显高于非溶栓组,差异具有统计学意义(P<0.05),见表6。
3 讨论
3.1 磁共振波谱扫描序列
脑血管疾病是神经系统常见的危重疾病,而脑梗死占脑血管疾病的80%~85%[4],严重威胁着人类生命健康和生活质量,及早发现与治疗对患者预后尤为重要。MRS通过检测脑组织内某些代谢物质的水平来反映神经细胞内物质与能量代谢的状况,是一种无创性测定体内代谢与生化变化的医学影像学技术,目前临床上多用于脑、心脏、肝脏等方面的功能成像重要课题来研究,其中以脑部的研究最为广泛[2-3]。用于检测氢质子波谱成像最常用的MR序列是点解析波谱(point resolved spectroscopy,PRESS)和激励回波采集方式(stimulated-echo method,STEAM),由于PRESS序列具有信噪比高、对扩散不敏感等优点[5-6],国内外学者[7-8]绝大多数主要研究NAA、Lac、Cho及Cr等物质在急性脑梗死中的改变,故多采用PRESS序列、长回波时间(time of echo,TE)进行MRS扫描;而STEAM序列检测可以使用短TE进行扫描且在短TE条件下对T2弛豫的敏感性优于PRESS序列[5-6,9],因此不仅能检测出NAA、Lac、Cho及Cr等物质,亦可检测到短T2物质如mI和Glx代谢物质,故本研究采用STEAM序列、TE=35 ms进行MRS扫描,旨在检测更多代谢物在急性脑梗死中的改变。
3.2 长T2代谢物质含量的改变及其与预后的相关性
NAA分布在神经元胞体、突起中,可较好地反映神经元功能状态,是神经元密度标志物,当脑缺血时,神经元代谢受到抑制,使得NAA密度减低,若出现NAA耗尽,提示神经功能不可逆转[7-8,10]。Cho由甘油磷酸胆碱、磷酸胆碱和磷脂酰胆碱组成,是细胞膜和鞘磷脂的标志物,其含量由膜磷脂中的胆碱及乙酰胆碱浓度决定,当鞘磷脂分解增加时,可致Cho升高,如脑缺血[11]。Lac是无氧糖酵解的产物,可作为梗死早期的标志物,其升高幅度反映了脑缺血的严重程度[12]。Cr为机体组织中肌酸及磷酸肌酸总浓度,其在机体病理代谢条件下,组织中Cr含量相对恒定且均匀分布,被用作体内标衡量其他代谢物含量指标之一[13]。本研究显示溶栓组与非溶栓组患者的梗死病灶中心区与病灶边缘区NAA含量均具有不同程度的下降,且溶栓组病灶边缘区域NAA含量明显高于非溶栓组,溶栓组与非溶栓组患者病灶中心区Cho明显升高,溶栓组病灶中心区、病灶边缘区及病灶周围正常区Lac含量明显低于非溶栓组,虽然病灶中心出现不可逆损伤,鞘磷脂分解使Cho升高,但是脑梗死患者在发病6 h内通过再灌注或神经保护使脑组织缺血、缺氧得到改善,减轻了神经损伤,挽救了部分可逆性组织,特别是缺血半暗带区,且溶栓组代谢物恢复更显著[14],与NIHSS评分的改善相一致。同时病灶中心区NAA含量和Cho含量与临床神经功能评分的相关程度高,NAA含量越低、Cho含量越多,NIHSS评分越高,患者神经功能恢复越差;病灶边缘区Lac含量与临床神经功能评分呈正相关,Lac含量越高,NIHSS评分越高,患者神经功能恢复越差,与国内外研究[7,14]结果一致。本研究亦发现3例梗死面积较大的患者,梗死灶侧NAA、Lac等含量改变越明显,NIHSS分值越高,神经损伤越重,预后不良,亦证实梗死灶的大小不仅影响病灶区各代谢物的含量,同时影响患者的预后[15-16]。
3.3 短T2物质代谢物质含量的改变及其与预后的相关性
mI作为胶质细胞的标志物,主要存在于胶质细胞内,在脑梗死时可出现胶质细胞增生mI浓度的升高[17]; Glx主要包含兴奋性神经递质谷氨酰胺和抑制性神经递质γ-氨基丁酸,有研究显示在脑梗死随访中发现Glx含量均有升高[18]。本研究显示溶栓组患者病灶中心区和病灶边缘区mI含量明显高于对侧正常区,可能存在脑梗死后胶质细胞释放营养因子,促进神经存活、神经再生等有关,是胶质细胞在应对脑缺血的一种可塑性表现[19],说明mI可能和脑梗死预后有关[20],而本研究mI含量与临床神经功能评分呈明显负相关性证实了该观点。溶栓组与非溶栓组患者的梗死病灶中心区Glx含量明显高于对侧正常区,溶栓组明显高于非溶栓组,且Glx含量与临床神经功能评分呈明显负相关性,可能是病灶中心区脑组织缺氧最严重时,出现了大量神经毒性物质,使Glx含量有所升高,同时表明Glx含量在患者预后中具有一定的作用[21]。
综上所述,磁共振波谱采用STEAM序列、短回波时间扫描,可以检测到更多代谢物的变化,能更全面地评估超急性脑梗死患者脑组织损伤程度及临床治疗后效果,能客观地评估患者的预后,为临床诊治脑梗死提供有价值的影像学依据。然而本次研究样本量较少,且存在较多因素干扰MRS扫描结果,因而还需要进一步研究。
参考文献 [References]
[1]Guo YL, Li SJ, Zhang ZP, et al. Parameters of diffusional kurtosis imaging for the diagnosis of acute cerebral infarction in different brain regions. Experimental & Therapeutic Med, 2016, 12(2): 933-938.
[2]Liu C, Dong Z, Xu L, et al. MR image features predicting hemorrhagic transformation in acute cerebral infarction: a multimodal study.Neuroradiology, 2015, 57(11): 1145-1152.
[3]Jiang Y, Zhou Y, Wang B, et al. Clinical research of scalp acupuncture combined with rehabilitation training treating patients with cerebral infarction in recovery period based on1H-MRS. Rehabilitation Med,2016, 26(1):10.
[4]Arnberg F, Lundberg J, Soderman M, et al. Image-guided method in the rat for inducing cortical or striatal infarction and for conteolling cerebral blood flow under MRI. Stroke, 2013, 43(9): 2437-2443.
[5]Zhu XX, Zheng L, Wang JP, et al. A comparative study of PRESS and STEAM in diagnosis of brain tumors with proton magnetic resonance spectroscopy. Radiol Practice, 2003, 18(5): 359-360.朱锡旭, 郑玲, 王俊鹏, 等. 磁共振氢质子波谱序列PRESS和STEAM比较. 放射学实践, 2003, 18(5): 359-360.
[6]Carmelo P, Armando P. New techniques of1H spectroscopy on the liver:Reworking of NMR sequences. Radiography, 2014, 1(7): 124-130.
[7]Krishna A, Li A, Erica C, et al. Multivoxel MR spectroscopy in acute ischemic stroke comparison to the stroke protocol MRI. Stroke,2012, 43(11): 2962-2967.
[8]Zhang T, Nie TT, Jia YL, et al. Spatiotemporal evolution of blood brain barrier damage associated with changes of brain metabolites following ischemia onset. Chin J Magn Reson Imaging, 2014, 5(6):473-478.章桃, 聂婷婷, 贾岩龙, 等. 超急性脑卒中血脑屏障和相关脑代谢物变化的研究. 磁共振成像, 2014, 5(6): 473-478.
[9]Zeng C, Li YM, Xie P, et al. Value of point resolved spectroscopy and stimulated echo acquisition mode of1H-magnetic resonance indetection of multi plesclerotic foci in brain white matter with normal appearance. J Third Mili Med Univ, 2010, 32(13):1408-1412.曾春, 李咏梅, 谢鹏, 等. PRESS和 STEAM波谱在多发性硬化病灶和看似正常表现脑白质区中的价值. 第三军医大学学报, 2010,32(13): 1408-1412.
[10]Janik R, Lam T, Stanisz AM, et al. Magnetic resonance spectroscopy reveals oral lactobacillus promotion of increases in brain GABA,N-acetyl aspartate and glutamate. Neuroimage, 2015, 125(11): 988.
[11]He CN, Li J. Application value of magnetic resonance spectroscopy in vertebrobasilar blood supply insufficiency. Chin Clin Med Imaging, 2015, 26(5): 359-361.贺春妮, 李军. 磁共振波谱成像对椎基底动脉供血不足的应用价值. 中国临床医学影像杂志, 2015, 26(5): 359-361.
[12]Lu SS, Liu S, Zu QQ, et al. Multimodal magnetic resonance imaging for assessing lacunar infarction after proximal middle cerebral artery occlusion in a canine model. Chin Med J, 2013, 126(2): 311-317.
[13]Zhu X, Cao L, Hu X, et al. Brain metabolism assessed via proton magnetic resonance spectroscopy in patients with amnestic or vascular mild cognitive impairment. Clin Neurol & Neuro, 2014,130(12): 80.
[14]Shang WW, Yin XD, Xue HL, et al. The application of magnetic resonance spectroscopic imaging in thrombolytic therapy of hyperacute cerebralinfarction. Chin J Magn Reson Imaging, 2016,7(5): 359-364.尚文文, 殷信道, 薛海林, 等. MR波谱成像在超急性脑梗死溶栓治疗中的应用研究. 磁共振成像, 2016, 7(5): 359-364.
[15]Coon AL, Arias-Mendoza F, Colby GP, et al. Correlation of cerebral metabolites with functional outcome in experimental primate stroke using in vivo1H-magnetic resonance spectroscopy.AJNR Am J Neuroradiol, 2006, 27(5): 1053-1058.
[16]Li SJ, Zhai J, Zhang JP, et al. The value of1H-MRS in monitoring single acute cerebral infarction with whole infarction lesion sample before and after treatment. J Clin Radiol, 2012, 31(3): 332-337.李石坚, 翟健, 张金平, 等.1H-MRS对单发急性脑梗死治疗前与后病灶整体取样的监测价值. 临床放射学杂志, 2012, 31(3): 332-337.
[17]Carmen MC, William MB, Sorin CC, et al. Primary motor cortex in stroke a functional MRI-guided protonMR spectroscopic study.Stroke, 2011, 42(4): 1004-1009.
[18]Wang X, Li YH, Li MH, et al. Glutamate level detection by magnetic resonance spectroscopy in patients with post-stroke depression. Eur Arch Psychiatry Clin Neurosci, 2012, 262(1): 33-38.
[19]Huang MM, Cao XW, Shen GQ, et al. A longitudinal study of changes of brain metabolites in vascular cognitive impairment rats using 3.0 T1H-MRS. Chin J Magn Reson Imaging, 2017, 8(9): 691-696.黄明明, 曹笑婉, 沈桂权, 等. 应用3.0 T1H-MRS技术纵向评估血管性认知障碍大鼠脑内代谢物改变. 磁共振成像, 2017, 8(9): 691-696.
[20]Shibuya M. Brain angiogenesis in developmental and pathological processes: therapeutic aspects of vascular endothelial growth factor.FEBS J, 2009, 276(17): 4636-4643.
[21]Cirstea CM, Brooks WM, Craciunas SC, et al. Primary motor cortex in stroke: a functional MRI-guided proton MR spectroscopic study.Stroke, 2011, 41(4): 1004-1009.