内镜黏膜下剥离术联合前哨淋巴结活检术与根治性切除治疗早期胃癌的效果对比分析
姬 乐,李小宝,高永涛,刘 涛,白 浪
早期胃癌是指癌灶仅位于胃黏膜下层或胃黏膜层,不论癌灶大小及淋巴结转移情况[1-2]。手术是治疗早期胃癌的“金标准”,根治性手术治疗是传统的手术方式,疗效公认。随着微创技术的发展,内镜黏膜下剥离术(ESD)已广泛应用于早期胃癌患者的手术治疗,且具有创伤小、恢复快等优点[3]。但是早期胃癌患者易发生淋巴结转移,会对手术切除范围及患者预后造成影响[4]。前哨淋巴结(SLN)是指原发肿瘤引流最初的淋巴结,是最可能发生转移的淋巴结[5]。对SLN进行检测可评估淋巴结转移情况进而为手术范围的选择提供参考[6]。故ESD联合SLN活检术可提高早期胃癌的手术治疗效果及减少创伤。本研究通过对比分析ESD联合SLN活检术与根治性切除治疗早期胃癌的效果,旨在为临床上早期胃癌治疗方法的选择提供理论依据,具体内容报告如下。
1 资料与方法
1.1一般资料 选取2010年3月—2014年10月延安大学附属医院收治的92例早期胃癌患者的临床资料进行回顾性分析。①纳入标准:所有患者均在术前经胃镜等辅助检查显示有早期病灶及明确病变起源层次,并排除腹腔脏器及淋巴结转移,术后病理结果均为癌前病变或早期胃癌;所有患者均为初次诊治,符合相关手术治疗指征。②排除标准:术前伴远处转移者;伴急性血液系统感染者;患有神经、精神疾病者;合并严重肝肾功能障碍者。根据手术方式的不同将患者分为A组和B组,每组46例。其中A组男26例,女20例;年龄45~75(61.62±4.83)岁;肿瘤位置:胃上1/3者4例,胃中1/3者12例,胃下1/3者30例;肿瘤分化程度:高分化34例,中分化11例,低分化1例;肿瘤直径(1.79±0.53)cm。B组男27例,女19例;年龄46~74(62.02±4.86)岁;肿瘤位置:胃上1/3者5例,胃中1/3者13例,胃下1/3者28例;肿瘤分化程度:高分化32例,中分化12例,低分化2例;肿瘤直径(1.81±0.56)cm。两组性别、年龄、肿瘤位置、肿瘤分化程度和肿瘤直径比较差异均无统计学意义(P>0.05),具有可比性。
1.2手术方法 A组给予ESD联合SLN活检术治疗。①SLN活检术:嘱患者取平卧位,全身麻醉建立气腹,主操作孔选择左腋前线肋缘下2 cm,做1.2 cm切口,副操作孔选择在脐左5 cm偏上1 cm处,做0.5 cm切口。借助胃镜在癌灶四周黏膜下层分4点注射0.5%专利蓝3 ml。SLN即为注射后15 min内出现蓝染的淋巴结。将蓝染的周围组织及淋巴结用超声刀分离,送快速病理切片。病理结果显示为阴性26例行ESD术治疗,阳性20例行腹腔镜D2根治术。②ESD术:在癌灶周围0.5 cm处进行电凝标记,标记处黏膜下多点注射甘油果糖和没蓝的混合液将癌灶抬起,将黏膜沿着标记缘进行切开,再剥离病灶部位黏膜,剥离的过程中注意出血、止血。最后进行常规创面止血,手术完成。测量切除病灶大小,固定好送病理检测。③腹腔镜胃癌D2根治性切除:大网膜采用超声刀进行离断及将横结肠系膜前叶剥离,清扫第4组淋巴结,再将胃网膜右血管裸化清扫第6组淋巴结。向上分离十二指肠动脉,清扫第12a组及5组淋巴结,自右向左沿肝固有动脉清扫第7组、8a组、9组、11p组淋巴结,自上而下沿胃小弯清扫第3组、1组淋巴结,最后在上腹做一切口将标本取出,行Ⅰ式吻合,留置腹腔引流管,常规送病理检测。B组给予根治性切除治疗,给予全身麻醉后行常规胃大部切除术。
1.3观察指标 随访3年,术后每间隔2个月复查肿瘤指标及胃镜,每间隔6个月复查CT。记录两组的住院时间、术中出血量、并发症的发生情况以及术后1、3年复发率和术后3年生存率等。
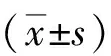
2 结果
2.1复发率和生存率比较 两组术后1、3年复发率及术后3年生存率比较差异均无统计学意义(P>0.05)。见表1。
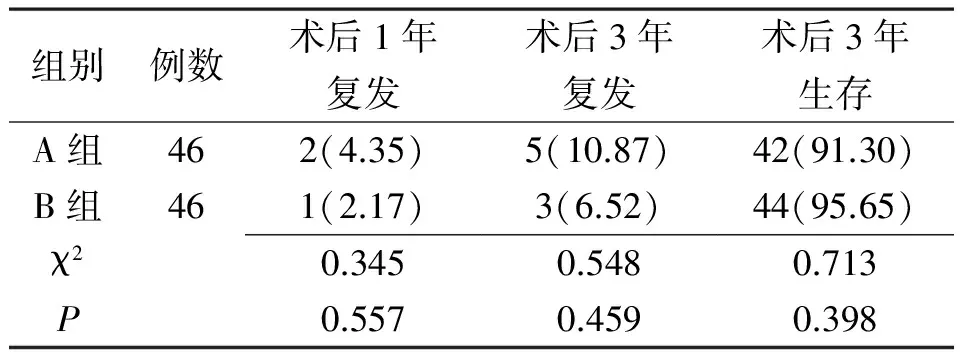
表1 两组早期胃癌患者的复发率和生存率比较[例(%)]
注:A组给予内镜黏膜下剥离术联合前哨淋巴结活检术治疗,B组给予根治性切除治疗
2.2住院时间及术中出血量比较 A组住院时间和术中输血量均少于B组(P<0.01)。见表2。
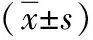
表2 两组早期胃癌患者的住院时间及术中出血量比较
注:A组给予内镜黏膜下剥离术联合前哨淋巴结活检术治疗,B组给予根治性切除治疗
2.3并发症情况 A组发生胃穿孔1例、胃出血2例,并发症总发生率为6.52%。B组发生切口感染2例、肠粘连1例、腹腔脓肿1例、吻合口狭窄1例,并发症总发生率为10.87%。两组并发症总发生率比较差异无统计学意义(χ2=0.548,P=0.459)。且两组发生的并发症经对症处理后均能缓解。
3 讨论
胃癌是我国常见的恶性肿瘤,发病率仅次于肺癌,死亡率也位居癌症死亡的第四位[7-8]。早期胃癌的治疗原则为根除癌灶、预防复发及最大程度的延长患者生存时间[9-10]。手术治疗仍是临床上公认的有可能治愈的唯一手段,根治性切除手术是传统的治疗方式,可有效的切除癌灶,但是存在手术创伤大、术后恢复慢等不足[11-13]。随着内镜技术的发展,ESD已广泛应用于早期胃癌的治疗,可减少手术应激、创伤,有利于促进患者生理及心理的康复。日本胃癌学会将微创手术作为早期胃癌的标准术式之一[14-15]。由于ESD只对原发病灶进行切除,很少系统性的进行淋巴结清扫,故易引起淋巴结转移及复发问题出现[16-17]。有研究报道,癌灶侵犯黏膜下层时的淋巴结转移率可高达11.0%,且胃癌的淋巴回流吻合支路、回流路径多,故可引起多向性淋巴结转移[18-21]。因此,ESD对于有淋巴结转移的早期胃癌患者存在一定局限性。
SLN活检术可对早期胃癌患者淋巴结转移情况进行评估[22-23]。SLN活检术最早在恶性黑色素瘤和乳腺癌治疗中应用,然后逐渐在胃癌、肝癌等实体瘤中应用[24]。在早期胃癌患者术中切取SLN并进行快速病理送检,对于SLN阳性患者则表示存在淋巴结转移,此时可行胃癌D2根治性手术治疗,可有效地改善患者预后[25-27]。对于SLN阴性患者,则行ESD术治疗,可不清扫或减小淋巴结清扫的范围以及避免没必要的胃切除术,能够促进患者康复,提高术后生命质量[6]。相关研究报道,根治性切除治疗早期胃癌患者的5年生存率可高达85%~96%[28]。本研究结果显示,两组术后1、3年复发率、术后3年生存率以及并发症总发生率比较均无差异。这表明ESD联合SLN活检术与根治性切除治疗早期胃癌的效果相当,通过ESD可有效地清除病灶且不会增加复发危险性,安全可靠。根治性切除治疗可在直视情况下进一步将引流区域淋巴结清扫,故复发率较低[29]。ESD术在SLN活检术基础上,淋巴结转移阳性检出率也较低,故复发率也低,所以疗效相当。另外,ESD术水平或垂直切缘阴性率更高,故肿瘤残端所引起的复发率也较低[30]。本研究结果还显示,ESD联合SLN活检术相比传统根治性切除可缩短患者住院时间、减少术中输血量,从而促进患者康复。
综上所述,ESD联合SLN活检术与根治性切除治疗早期胃癌的效果相当,但ESD联合SLN活检术可缩短住院时间、减小手术创伤,故对于符合ESD联合SLN活检术治疗指征的患者,如绝对适应证:肿瘤直径<2 cm的分化型黏膜内癌,无溃疡,不论内镜形态。扩大适应证:①肿瘤直径≥2 cm的分化型黏膜内癌,不伴溃疡;②肿瘤直径<2 cm的未分化型黏膜内癌,无溃疡;③肿瘤直径<3 cm的分化型黏膜内癌,有溃疡者。可首选ESD联合SLN活检术进行治疗。
[参考文献]
[1] 史俊峰,许示心,费伯健,等.微创外科联合前哨淋巴结活检术治疗早期胃癌[J].中华普通外科杂志,2015,30(10):766-769.
[2] 牛应林,蔡军,李鹏,等.内镜黏膜下剥离术联合腹腔镜淋巴结切除术治疗有淋巴结转移风险的早期胃癌的临床探讨[J].中华消化内镜杂志,2017,34(7):508-509.
[3] 米亚赛尔·力提甫,郭沁,高峰.内镜黏膜下剥离术治疗早期胃癌的疗效及安全性分析[J].山西医药杂志,2017,46(14):1734-1736.
[4] 朱俊宇,时强,周平红,等.内镜黏膜下剥离术后追加胃切除术对早期胃癌患者预后的影响[J].中华胃肠外科杂志,2016,19(8):912-916.
[5] 时强,朱俊宇,戴春红,等.内镜黏膜下剥离术治疗残胃早期癌或癌前病变的疗效分析[J].中华胃肠外科杂志,2015,18(2):155-158.
[6] 姚镇东,徐刚,万荣,等.内镜下黏膜剥离术及外科手术治疗137例早期胃癌的临床分析[J].中国中西医结合消化杂志,2016,24(10):754-757,761.
[7] 凌亭生,陈光侠,王雷,等.内镜黏膜下剥离术治疗残胃腺上皮高级别上皮内瘤变及早期癌临床意义探讨[J].中华消化内镜杂志,2015,32(7):427-431.
[8] 钟晓刚,王晓通,殷舞,等.进展期胃癌根治术(毕Ⅱ式)后幽门螺旋杆菌感染情况及药物干预的临床效果观察[J].中国临床新医学,2016,9(10):851-853.
[9] 高波,王丽.系统护理结合个体化干预在内镜黏膜下剥离术治疗早期胃癌中的应用[J].实用临床医药杂志,2015,19(20):125-127.
[10] 杜玉秀.胃镜下黏膜染色联合黏膜切除术在早期胃癌和癌前病变中的应用[J].中国煤炭工业医学杂志,2013,16(8):1322-1323
[11] 佘青,李有怀,程永刚,等.全腔镜乳房皮下腺体切除术联合腔镜前哨淋巴结活检术治疗早中期乳腺癌的技巧探讨[J].川北医学院学报,2016,31(5):756-758.
[12] 于芷晗,常铁君,赵雪峰.内镜黏膜下剥离术及手术治疗胃黏膜下癌的手术指征分析[J].医学与哲学,2015,36(12B):38-40.
[13] 严建宇,陈伦牮,杨钦清,等.腹腔镜胃癌根治术对T细胞亚群及CRP、IL-6表达水平的影响[J].武警后勤学院学报:医学版,2013,22(7):595-597.
[14] 李全营,秦长江,郭国校,等.二级前哨淋巴结活检技术在进展期胃癌手术中的应用[J].中国普通外科杂志,2015,24(6):892-894.
[15] 任玮,张松,王萌,等.前哨淋巴结导航技术在早期胃癌内镜非治愈性切除后腹腔镜处理中的应用价值[J].中华消化内镜杂志,2016,33(12):826-828.
[16] 龚庆豪,蔡一亭,陈海群,等.胃癌患者血清HMGB1及前哨淋巴结检测与肿瘤标志物含量、肿瘤组织恶性分子表达量的关系[J].海南医学院学报,2016,22(16):1855-1858.
[17] 何元.二级前哨淋巴结技术在D2胃癌根治术中的临床应用[J].空军医学杂志,2016,32(3):192-195.
[18] 吴凯,刘伟,冯旭刚,等.前哨淋巴结定位检测在早期诊断进展期胃癌中的作用分析[J].海南医学院学报,2015,21(6):805-807.
[19] 涂敏,朱振舒,时林森,等.胃癌转移淋巴结评估手段的研究现状及远景[J].中华胃肠外科杂志,2012,15(2):197-200.
[20] 王征,周志祥,梁建伟,等.早期胃癌的淋巴结转移规律及预后分析[J].癌症进展,2011,9(3):315-319.
[21] 李丹丹.早期胃癌临床病理特征与淋巴结转移的相关分析[J].中国现代医生,2017,55(11):94-96.
[22] Han J P, Hong S J, Kim H K,etal. Risk stratification and management of non-curative resection after endoscopic submucosal dissection for early gastric cancer[J].Surg Endosc, 2016,30(1):184-189.
[23] 周博,杨言通,王公平,等.前哨淋巴结导航技术在老年早期胃窦部腺癌手术中的应用价值[J].新乡医学院学报,2017,34(4):316-319.
[24] 费挺,余勤,齐长磊.进展期胃癌根治术中二级前哨淋巴结技术的应用[J].中华胃肠外科杂志,2016,19(10):1184-1186.
[25] 汪志仿.术中分站淋巴结活检在进展期胃癌根治术中的临床意义[J].现代医学,2015,43(6):775-777.
[26] 赵刚,武青生,穆元忠,等.腹腔镜辅助下D2根治术对进展期远端胃癌患者临床疗效、术后并发症及住院时间的影响[J].癌症进展,2017,15(11):1335-1337,1341.
[27] 刘红权,刘传渊,方传发.腹腔镜胃癌D2根治术与传统开腹胃癌D2根治术的疗效与安全性比较[J].中国当代医药,2013,20(32):24-25,27.
[28] 梁丽,张继新,戎龙,等.80例早期胃癌及癌前病变内镜黏膜下剥离术标本的处理及病理学评估[J].中华消化内镜杂志,2016,33(9):589-597.
[29] 屠惠明,费伯健,杨帆,等.术前活检方法对早期胃癌及上皮内瘤变内镜黏膜下剥离术手术过程的影响[J].中华消化内镜杂志,2015,32(11):743-746.
[30] 武育卫,何双丽,胡文华,等.内镜黏膜下剥离术治疗食管和胃早期癌及上皮内瘤变的临床研究[J].临床内科杂志,2017,34(2):123-125.

