不同剂型和负荷剂量西罗莫司的毒性作用分析
孔祥瑞,李 静,周 林,肖 漓,石炳毅
西罗莫司(SRL)具有免疫抑制、抗肿瘤、抗真菌的多重作用,被广泛应用于实体器官移植[1-2],尤其是对恶性肿瘤受者,虽取得较好的临床疗效,但却常因黏膜溃疡、高胆固醇和甘油三酯血症、高血压以及由于骨髓抑制增加感染和淋巴瘤的风险,使其应用受到限制[3]。近年来,虽然发现SRL治疗可引起严重的骨髓抑制、血小板减少以及肺炎,但仍有较多的研究证实肝移植后肝癌患者转换mTORi免疫抑制方案有助于肿瘤复发的防治[4-5]。本研究在动物实验中发现,不同药物剂型、剂量和给药方式的不良反应差异明显,且对大鼠的生存有较大影响,对SRL在动物实验中应用及临床用药有一定的指导意义。
1 材料与方法
1.1实验材料
1.1.1实验动物:SPF级雄性SD大鼠60只,体重200~220 g,均购于解放军军事医学科学院实验动物中心,许可证:SCXK-(军)2012-004。
1.1.2试验试剂:西罗莫司片剂(美国惠氏制药有限公司)由海正辉瑞制药有限公司惠赠,西罗莫司口服液由杭州中美华东制药有限公司惠赠,缓释剂牛胶原蛋白活性肽由北京紫霞环保生物工程技术有限公司资助。
1.2实验设计
1.2.1实验分组:SD雄性大鼠60只随机分为A1组、A2组、A3组、B1组、B2组、B3组,每组10只。
1.2.2实验干预:A1组给予SRL高剂量片剂普通灌胃、A2组给予SRL高剂量片剂缓释灌胃、A3组给予SRL低剂量片剂缓释灌胃、B1组给予SRL高剂量口服液普通灌胃、B2组给予SRL高剂量口服液缓释灌胃、B3组给予SRL低剂量口服液缓释灌胃。A1、A2、B1、B2组负荷剂量1 mg/kg,1/d;A3、B3组负荷剂量0.5 mg/kg,1/d。除A1、B1组外其余各组药物均进行缓释处理;实验持续30 d。
1.2.3缓释方案:西罗莫司片剂捣碎粉末状,以注射用灭菌用水溶解,牛胶原蛋白活性肽溶于水溶液,终浓度为5%;西罗莫司口服液缓释剂用牛胶原蛋白活性肽直接溶于稀释后的西罗莫司口服液,终浓度为5%。
1.3观察指标及方法 记录各组大鼠的饮食情况和体重变化;详细记录各组大鼠的器官病变情况、死亡率以及生存时间。对死亡大鼠解剖,标本固定,拍照;试验结束后所有存活大鼠,均麻醉状态下处死,取材,标本固定,拍照。器官病变情况主要观察肝脏色泽轻度为颜色略变深,重度为颜色深暗、发黑;肺脏结节病变轻度为结节<5个,中度为5~10个,重度为>10个;胃溃疡轻度为侵犯黏膜层,中度为侵犯黏膜下层至肌层,重度为侵犯肌层及浆膜层、胃呈透明薄膜状。
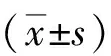
2 结果
2.1一般情况及死亡率 药物干预后第3天开始,所有实验组大鼠食欲有不同程度降低,以A1和B1组最为明显,A2和B2组次之,A3和B3组变化最小,随着实验持续,各组大鼠饮食状况逐渐好转。定期监测所有大鼠体重,直至实验终止,各组体重变化情况,见表1。第30天,A1、A2、A3组间体重比较差异具有统计学意义(F=7.566,P=0.002);B1、B2、B3组间体重比较差异具有统计学意义(F=25.481,P<0.001)。第30天,A1组与B1组、A2组与B2组、A3组与B3组体重比较差异均无统计学意义(t=-1.736、-0.674、-1.927,P=0.100、0.509、0.070)。从第5天开始,实验大鼠出现死亡;至第30天时,A1、A2、A3、B1、B2、B3组分别死亡10只(100%)、6只(60%)、1只(10%)、8只(80%)、3只(30%)、0只。A1组死亡率高于A2组(χ2=5.000,P=0.025),A2组死亡率高于A3组(χ2=5.494,P=0.019)。B1组死亡率显著高于B2组(χ2=5.051,P=0.025),但B2组与B3组比较差异无统计学意义(χ2=3.529,P=0.06)。A1组与B1组、A2组与B2组、A3组与B3组死亡率比较差异均无统计学意义(χ2=2.222、1.818、1.053,P=0.136、0.074、0.136)。
2.2器官病变情况 对各组大鼠进行解剖发现,在负荷剂量、剂型不同的情况下,各组大鼠肝、肺、胃、肾、小肠等脏器出现轻重不同的病变;且与高负荷剂量组相比,低负荷剂量组大鼠肝、肺、胃脏器的病变明显减少,病变程度轻。见表2。
2.3生存时间比较 各组最短生存时间为5 d,最长生存时间30 d(至实验终止时)。对各组生存时间进行Kaplan-Meier分析,采用log-rank法进行比较,统计结果显示,低负荷剂量组具有良好生存效益,生存时间显著延长,组间差异有统计学意义(P<0.001)。见图1。

表1 6组大鼠各实验阶段的体重变化情况
注:A1组西罗莫司片剂普通灌胃,A2组西罗莫司片剂缓释灌胃,A3组西罗莫司片剂缓释灌胃,B1组西罗莫司口服液普通灌胃,B2组西罗莫司口服液缓释灌胃,B3组西罗莫司口服液缓释灌胃;第30天A1、A2、A3组间比较,F=7.566,P=0.002;第30天B1、B2、B3组间比较,F=25.481,P<0.001

表2 6组大鼠的器官病变情况(只)
注:A1组西罗莫司片剂普通灌胃,A2组西罗莫司片剂缓释灌胃,A3组西罗莫司片剂缓释灌胃,B1组西罗莫司口服液普通灌胃,B2组西罗莫司口服液缓释灌胃,B3组西罗莫司口服液缓释灌胃

图16组大鼠的生存时间比较
A1组西罗莫司片剂普通灌胃(1 mg/kg),A2组西罗莫司片剂缓释灌胃(1 mg/kg),A3组西罗莫司片剂缓释灌胃(0.5 mg/kg),B1组西罗莫司口服液普通灌胃(1 mg/kg),B2组西罗莫司口服液缓释灌胃(1 mg/kg),B3组西罗莫司口服液缓释灌胃(0.5 mg/kg)
3 讨论
SRL又称雷帕霉素于1999年开始用于治疗器官移植排斥反应,与普乐可复(FK506)的结构相似,但免疫抑制机制却截然不同,FK506抑制T淋巴细胞由G0期至G1期的增殖[6];而SRL则通过不同的细胞因子受体阻断信号传导,阻断T淋巴细胞及其他细胞由G1期至S期的进程。与FK506相比,SRL可阻断T淋巴细胞和B淋巴细胞的钙依赖性和非钙依赖性信号传导通路,抑制机体的免疫反应[7]。动物实验及临床应用表明,SRL是一种免疫抑制作用良好,毒性较低,基本无肾毒性的新型免疫抑制剂[8]。
近年研究发现,SRL治疗可引起高脂血症、严重的骨髓抑制、血小板减少以及肺炎等不良反应[9]。然而有越来越多的研究表明,在器官移植后SRL替代钙调磷酸酶抑制剂类药物可以明显减少这类药物的肾毒性和神经毒性[10-12],尤其有助于恶性肿瘤患者移植术后肿瘤复发的防治。近年来的研究结果显示,SRL在保护移植物的同时还可以抑制肿瘤的生长[13]。
有研究在以SRL为基础方案的预防肝移植术后肿瘤复发的临床治疗中发现,因服药方式的不同,部分患者出现难治性黏膜溃疡(口腔溃疡、胃溃疡),在单用SRL超剂量时部分患者会出现较严重间质性肺炎、骨髓抑制及血小板降低等[5]。在早期动物实验中,SRL负荷剂量以文献报道的1 mg/kg为标准干预量,结果发现药物毒性作用明显,尤其黏膜溃疡及难治性肺炎,多数研究对象在短期内出现明显体重减轻及死亡。本研究是基于以上问题而设计,旨在探索合适的负荷剂量及干预方式,为动物实验提供合适的药物剂量参考。
本研究发现,在高负荷剂量(1 mg/kg)及干预方式相同情况下(A1组与B1组、A2组与B2组),虽然SRL片剂与口服液毒性作用无明显组间差异,但二者所产生的毒性作用严重且致死率较高,说明在高负荷剂量时,无论采取何种干预方式,片剂和口服液均有较大的毒性作用。然而对同一剂型在负荷剂量相同情况下采用不同干预方式发现(A1组与A2组;B1组与B2组),虽然药物毒性作用依然显著,半数致死量大,但组内差异显著,提示药物缓释技术有助于减轻SRL严重毒性作用。低负荷剂量(0.5 mg/kg)干预时,不同剂型组间死亡率和生存时间比较,差异无显著性意义,与高负荷剂量相比,不同剂型组内差异显著。此外本研究还发现,低负荷剂量缓释SRL药物干预对大鼠体重增加、生存时间延长有明显的促进作用。
既往文献报道,SRL干预剂量为1 mg/kg时,经反复试验验证毒副作用明显,且耐受性差[14]。本研究认为虽然剂型不同,但低负荷剂量缓释SRL耐受性良好,毒性作用小,与高负荷剂量SRL干预相比,具有良好的生存效益,因而建议在动物实验中采用低负荷剂量缓释SRL的干预方式,以减轻因剂量及给药不同所产生的毒性作用。
本研究结果显示,在动物基础药效研究中,SRL口服液比片剂更容易使用,缓释药液容易制备,且浓度均一,并可节约实验成本。临床治疗中,虽然没有明确的界定,但因片剂的方便性,目前广泛应用,在药物口服过程中,包裹缓释空胶囊是较好的选择,并可能实现药效持续释放。至于缓释技术是否能提高药物的吸收及药效,还需要进一步研究进行证实。本研究受样本量和实验时间影响具有一定的局限性,需要更大样本量、长时间随访结果来进一步证实低负荷剂量缓释SRL干预的效益,亦需要相关临床研究证实缓释技术对药效的影响。
[参考文献]
[1] Zuckermann A, Eisen H, See T S,etal. Sirolimus conversion after heart transplant: risk factors for acute rejection and predictors of renal function response[J].Am J Transplant, 2014,14(9):2048-2054.
[2] White M, Boucher A, Dandavino R,etal. Sirolimus immunoprophylaxis and renal histological changes in long-term cardiac transplant recipients: a pilot study[J].Ann Pharmacother, 2014,48(7):837-846.
[3] 安玉玲,张婷婷,蔡常洁.西罗莫司用于治疗肝癌肝移植术后肿瘤复发患者的疗效分析[J].器官移植,2011,2(2):73-76.
[4] 潘明杰,杜蓉,陈鹰,等.西罗莫司新剂型的研究概述[J].中国药师,2016,19(6):1183-1186.
[5] 周林,郑永根,杜国盛,等.肝癌肝移植术后西罗莫司转换治疗的免疫学效应分析[J].解放军医药杂志,2017,29(4):24-28.
[6] 李立新,贺强,陈大志,等.肝癌肝移植术后雷帕霉素与普乐可复为主免疫抑制治疗结果初探[J].中华肝胆外科杂志,2008,14(6):368-370.
[7] 霍文.肾移植后西罗莫司致不良反应的文献分析[J].中国组织工程研究与临床康复,2010,14(31):5825-5828.
[8] 马田甜,王彦娥,李馥伶,等.肾移植术后免疫抑制治疗方案的研究进展[J].中国新药与临床杂志,2016,35(9):603-610.
[9] 薛孟娟,吕朝阳,张尧,等.抗器官排斥药物和方案对器官移植术后血脂变化的影响[J].中华内分泌代谢杂志,2015,31(9):816-818.
[10] 陈小娟,黄晓宁,李勇.西罗莫司对比他克莫司用于肾移植后抗排异疗效和安全性的Meta分析[J].中国药房,2016,27(27):3821-3824.
[11] 刘力玮,何金丹,王晓硕,等.肾移植术后应用他克莫司与西罗莫司为初始免疫抑制剂的荟萃分析[J].中华器官移植杂志,2015,36(12):741-747.
[12] Sereno J, Vala H, Nunes S,etal. Cyclosporine A-induced nephrotoxicity is ameliorated by dose reduction and conversion to sirolimus in the rat[J].J Physiol Pharmacol, 2015,66(2):285-299.
[13] 俞能旺,郝俊文,刘贞,等.肾移植术后并发恶性肿瘤患者应用西罗莫司的经验[J].中华器官移植杂志,2015,36(6):373-374.
[14] 蔡蕤,王军,张新乐.西罗莫司不同血药浓度对肾移植患者肝肾功能的影响[J].中国实用医药,2016,11(4):124-125.

