大麦表皮蜡质的组分及晶体结构分析
王 聪,王嘉欢,汪 勇,王中华,权 力
(西北农林科技大学农学院,陕西杨凌 712100)
植物表皮蜡质是附着在植物最外层的疏水性物质,是植物防止非气孔性水分散失,抵抗病虫害入侵,防止昆虫蚕食,抵抗紫外辐射和霜冻,以及维持植物表皮清洁与植物表面防水的一层保护膜,对植物的生长发育及抗虫、抗旱等具有重要作用[1-4]。植物表皮蜡质主要由可溶于有机溶剂的超长链脂肪族化合物及其衍生物组成[5]。不同物种的蜡质组分及晶体结构均有差异,同一物种不同器官的蜡质组成及晶体结构也不同,有些植物蜡质的晶体结构随着植物的生长发育而呈现多种形态[6]。前人研究发现,拟南芥、水稻、小麦等表皮蜡质的组分为烷烃、醛、酮、酯、脂肪酸、初级脂肪醇、次级脂肪醇、萜类、酚类、固醇等物质;蜡质的晶体结构呈现片状、管状、波浪状、线状等多种形态,其中以片状和管状居多[7-9]。片状蜡质的主要组分是伯醇或三萜类化合物,管状蜡质的主要组分为β-二酮、仲醇和二醇等化合物[10]。在植物生长发育过程中,蜡质的组分和晶体结构与环境条件密切相关,晶体结构会随蜡质组分的改变而改变[10]。
干旱影响大麦等作物的生理代谢、生长发育、产量及品质[11-15],植株器官表皮蜡质性状与作物抗旱性密切相关。但是,有关大麦表皮蜡质组分及晶体结构的研究鲜有报道。本研究以大麦品种Morex为研究对象,采用气相色谱-质谱联用仪(Gas Chromatography-Mass Spectrometry,GC-MS)和扫描电镜对其不同时期不同器官表皮蜡质组分及其含量、晶体结构进行检测与分析,以期了解大麦表皮蜡质组成及其晶体形态随生育进程变化的特点,为大麦叶片、穗下茎及叶鞘表皮蜡质的合成及大麦蜡质合成相关基因的研究奠定基础。
1 材料与方法
1.1 材料与设计
供试材料为大麦Morex,由西北农林科技大学小麦分子生物学与育种实验室提供。于2016年10月种植大麦于西北农林科技大学北校区西区科研试验田,翌年分别选取叶片、孕穗期和扬花期穗下茎及叶鞘进行蜡质浸提,并对其进行气相色谱分析和扫描电镜分析。
1.2 方 法
1.2.1 样品制备
分别用镊子随机选取大麦种植日后100、130、160、190、210和240 d的顶部叶片作为供试样品;在大麦孕穗期和扬花期,随机选取穗下茎和叶鞘作为供试样品,每种样品4个重复。用扫描仪分别对样品进行扫描,用Image J 软件计算表面积,计算方法:在Image J软件中打开需要计算面积的叶片,在Set Scale菜单中设定已知距离,选定待测叶片后,待测叶面积被红色自动填充,在Analyze菜单栏中选择Analyze Particles计算叶面积,若需计算总面积,可勾选Summarize,输出结果可粘贴至Excel表中进行处理。
1.2.2 蜡质提取及GC-MS 样品制备
室温条件下,在通风橱内将样品浸没在装有30 mL 氯仿的50 mL 玻璃烧杯中,1 min 后取出(期间用镊子轻翻叶片使其充分被氯仿浸没),加入10 μL C24烷烃(1 mg·mL-1)作为内标,混匀。待氯仿部分挥发后,将剩余溶液过滤至15 mL 样品瓶中,吸取3 mL 氯仿漂洗烧杯2次并全部过滤至样品瓶中。待过滤液在通风橱挥发至1 mL 时,将其转入GC 样品瓶中,吸取1 mL 氯仿漂洗过滤液样品瓶并全部转入GC 样品瓶。用氮气将样品吹干,加入30 μL 吡啶、30 μL双(三甲基硅烷基)三氟乙酰胺[Bis(trimethylsilyl) trifluoroacetamid],立即盖好瓶盖,70 ℃衍生反应60 min,用氮气恒温吹干仪将反应液吹至完全干燥后加入1 mL 氯仿回溶,供GC-MS分析。
1.2.3 蜡质成分分析
采用气相色谱-质谱联用仪(GC-MS-QP2010,日本岛津)测定、分析蜡质成分。
检测条件:进样量1 μL,进样口温度280 ℃,分流比2∶1,检测器温度320 ℃,扫描离子50~600 amu,载气为氦气(He2)。升温程序:50 ℃ 保持2 min;以20 ℃·min-1升温至240 ℃,保持2 min;以1.5 ℃·min-1升温至320 ℃,保持15 min。
根据质谱数据库,对蜡质各组分进行定性分析和鉴定。利用Lab Solution 软件对各组分离子峰的面积进行积分,参照C24内标定量分析蜡质各组分化合物。
蜡质绝对含量=各组分化合物离子峰面积/内标C24离子峰面积×内标C24体积/样品体积
相对含量=绝对含量/总含量×100%
1.2.4 扫描电镜观察
选择边缘平整、形态良好的叶片、穗下茎和叶鞘用回形针固定在白纸上,放置于干燥箱中,待完全干燥后进行扫描电镜观察并拍照。
扫描电镜方法:将完全干燥的样品取出,用小刀切取2.5 mm×2.5 mm 的正方形放在导电胶上,将导电胶粘贴在托盘上,抽真空后喷金镀膜(Hitachi,E-1045),在冷场发射扫描电子显微镜(Hitachi,S-4800)中扫描观察蜡质晶体。
1.3 数据分析
用Excel 2010和DPS 7.05对数据进行统计分析,使用Duncan新复极差法对数据进行差异显著性分析。
2 结果与分析
2.1 大麦表皮蜡质组分各化合物的碳链分布
由GC-MS分析气相色谱离子峰图的分布情况可以得出,大麦不同组织表皮蜡质各化合物得到了很好的分离,经质谱数据库检索,各组织表皮蜡质化合物种类共鉴别出20种,分别为烷烃、初级醇、脂肪醛、脂肪酸和二酮。其中,烷烃有5种,主要是奇数碳原子,碳链长度为C25~C33烷烃;初级醇有5种,主要是偶数碳原子,碳链长为C22~C30初级醇;醛有4种,主要是偶数碳原子,碳链长为C24~C30;脂肪酸有4种,主要是偶数碳原子,碳链长为C22~C28;二酮有2种,分别为碳链长为C31的β-二酮和其衍生物羟基-β-二酮。
2.2 大麦不同时期叶片表皮的蜡质组分及含量
对大麦叶片蜡质组分进行定量分析,结果(图1)表明,大麦叶片表皮蜡质化学组分有初级醇、烷烃、醛、二酮和脂肪酸。初级醇是大麦叶表蜡质的主要成分,以C26醇的含量最高(图2)。在叶片发育100~190 d期间,大麦叶片蜡质总量持续稳定增加,生长至210 d,叶片蜡质总量呈逐渐降低的趋势,在240 d时趋于稳定(图1)。由此可见,大麦叶片蜡质含量随发育进程推移呈先增加后降低趋势。由表1可知,在大麦发育100~190 d时,叶片的表皮蜡质组成主要是初级醇(78.25%~85.44%),其次是烷烃(5.20%~7.48%)、醛(4.15%~6.03 %)、二酮(1.94%~7.88%)和脂肪酸(0.91%~0.97%);210~240 d时,叶片蜡质主要成分是初级醇(79.39%~80.12%),其次是二酮(7.77%~9.38%)、烷烃(5.78%~6.66%)、醛(3.87%~4.19%)和脂肪酸(1.58%~1.27%)。由此可见,在大麦不同发育时期,叶片表皮各蜡质组分之间存在差异。发育100~240 d期间,大麦叶片蜡质组分中初级醇的含量先升高后降低。100 d时,由于大麦处于蜡质发育初期阶段,蜡质各组分含量均较低。120 d 时,蜡质组分中初级醇含量急剧增加,达到了12.35 μg·cm-2,且处于主导地位,烷烃、醛、脂肪酸和二酮有少量增加。在190 d时初级醇含量达到最大值(14.53 μg·cm-2),烷烃、醛和脂肪酸的含量也达到顶峰。在发育后期(210~240 d)初级醇的含量持续降低并趋于稳定,烷烃、醛和脂肪酸的含量也在逐渐减少。初级醇的绝对含量在100 d和190 d之间直续增加,但其相对含量却在190 d时最低;210~240 d时,初级醇的绝对含量和相对含量均较100~160 d有所下降;而二酮的相对含量整体呈增加趋势,在240 d时最大(9.38%)(图1,表1)。

图1 大麦叶片蜡质各组分和总蜡质含量Fig.1 Absolute components and total wax content of barley leaf wax
大麦蜡质中初级醇分别为C22醇、C24醇、C26醇、C28醇和C30醇的偶数碳链长度。其中,C26醇是大麦叶片蜡质初级醇的主要成分,在大麦发育的各个时期含量均最高,C24醇、C28醇和C22醇次之,C30醇最少。大麦生长至190 d 时,各碳链长度的初级醇含量均达到最高,以C26醇的含量最高。综上所述,在此时期大麦叶片在进行充分地蜡质合成,初级醇的合成最活跃。210~240 d时,C26醇剧减,其他碳链长度的初级醇也有明显降低(图2)。
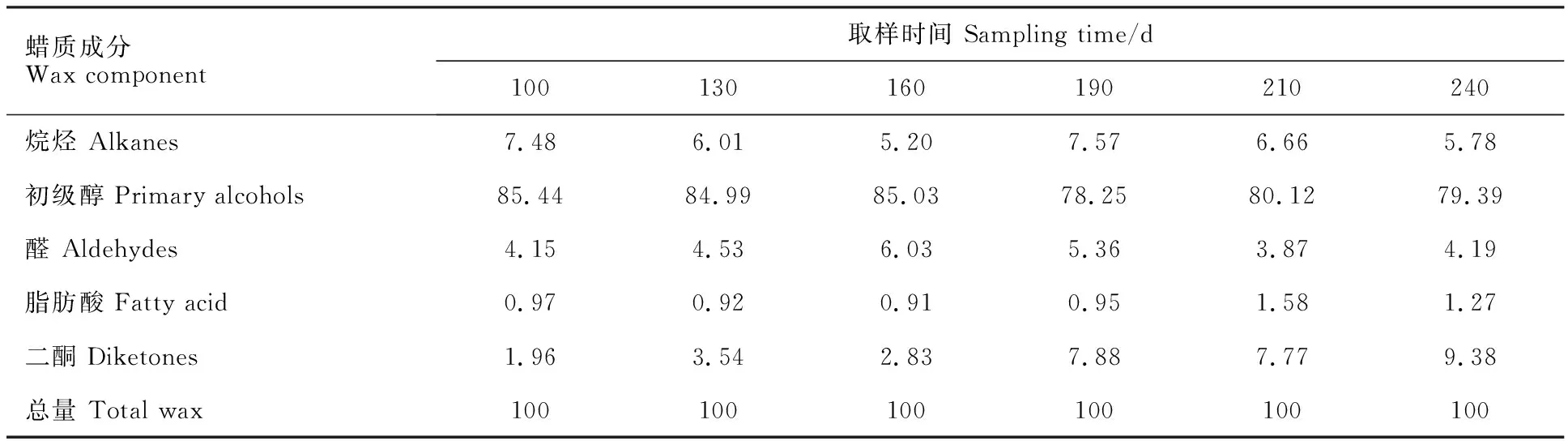
表1 大麦叶片蜡质各组分的相对含量Table 1 Relative contents of wax components of barley leaves %

图2 大麦叶片蜡质不同碳链长度初级醇含量Fig.2 Content of different carbon chains of primary alcohols in barley leaf wax
2.3 大麦孕穗期及扬花期穗下茎和叶鞘的蜡质组分及含量
对大麦孕穗期和扬花期穗下茎和叶鞘蜡质进行分析,结果表明,穗下茎和叶鞘表皮蜡质主要成分均由烷烃、初级醇、醛、脂肪酸和二酮组成,以二酮含量高,初级醇次之,烷烃、醛和脂肪酸含量较少。大麦从孕穗期到扬花期,穗下茎和叶鞘蜡质总量及各组分含量均呈现增加的趋势(图3)。不同器官在不同时期蜡质各组分的含量不同,叶鞘蜡质总量均比穗下茎高。穗下茎中,二酮含量最高(73.84%~75.47%),初级醇(7.97%~15.08%)、烷烃(8.25%~12.39%)和醛(1.65%~2.35%)次之,脂肪酸(0.87%~1.43%)最少;在叶鞘中,同样是二酮含量最高(69.82%~86.85%),初级醇(7.13%~16.35%)、烷烃(3.87%~7.96%)和醛(1.28%~3.79%)次之,脂肪酸(1.01%~2.07%)最少(表2)。在大麦扬花期,穗下茎和叶鞘蜡质各组分含量均达到最高,以二酮含量最高,分别达到了5.43 μg·cm-2和17.20 μg·cm-2(图2)。
比较各蜡质组分的链长分布(图4)发现,穗下茎中,不同碳链长度的烷烃以C31烷烃为主,其次是C29、C27和C25烷烃,C33烷烃最少,且在扬花期的含量均略高于孕穗期;初级醇主要由C22、C24、C26、C28和C30醇构成,其中,C30醇的含量最高,C26醇、C28醇和C24醇次之,C22醇最少,且在扬花期含量均明显增加;醛以碳链长度为C24醛为主,其次是C30醛和C26醛,C28醛最少,且在孕穗期和扬花期间无明显差异;脂肪酸主要由C22、C24、C26和C28酸构成,在孕穗期,C28酸占主导地位,在扬花期,C26酸占主导地位,C22和C24酸的含量在两个时期差异不明显。在叶鞘中,烷烃中C29烷烃含量最高,其次是C31、C27和C25烷烃,C33烷烃最少,且其在扬花期含量均较高,以C29烷烃的含量变化最明显。初级醇各碳链长度醇含量依次为C30、C26、C28、C24和C22,且在扬花期的含量均较高,其中C30初级醇含量增加最明显。不同碳链长度的醛以C30醛为主,其次是C24和C28醛,C26醛相对较少,且在扬花期的含量均明显较高,其中C30醛的含量增加最明显。不同链长的脂肪酸中,C28脂肪酸的含量最高,其次是C24和C22脂肪酸,C26脂肪酸最少,且在扬花期的含量均明显较高,以C22脂肪酸增幅最大。结果表明,孕穗期和扬花期大麦各器官表皮中的不同链长的蜡质组分含量存在差异,且各组分在扬花期的含量均较高。

图3 大麦孕穗期和扬花期不同器官中蜡质各组分含量Fig.3 Absolute contents of wax components in different organs of barley at booting stage and flowering stage表2 大麦孕穗期和扬花期不同器官表面蜡质各组分的相对含量Table 2 Relative contents of wax components in different organs of barley at booting stage and flowering stage %
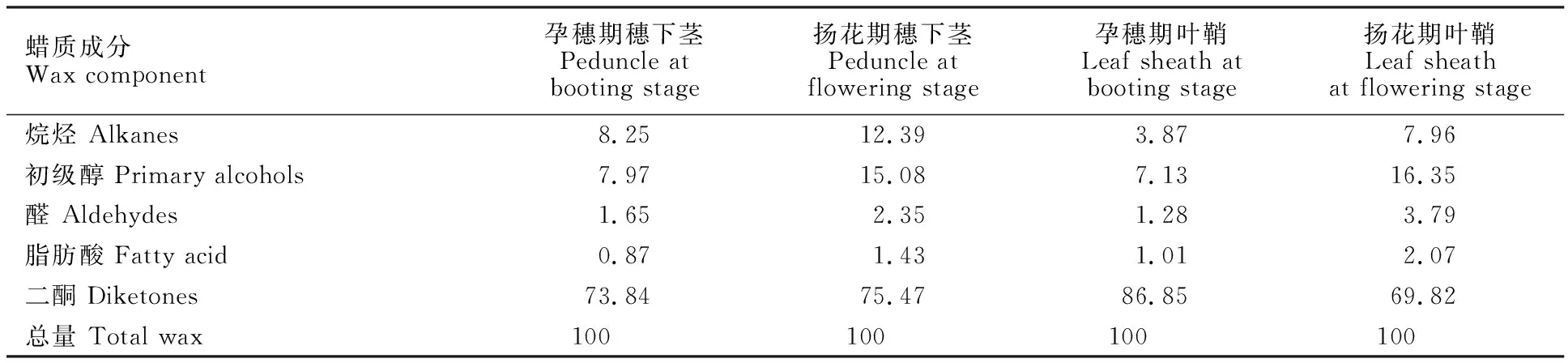

图4 大麦孕穗期和扬花期不同器官表面蜡质各组分不同碳链长度蜡质含量Fig.4 Absolute contents of wax in different organs of different carbon chains in barley at booting stage and flowering stage
由表3可知,不同时期大麦穗下茎和叶鞘表皮蜡质组分二酮差异程度不同。大麦孕穗期和扬花期,叶鞘中β-二酮的含量、羟基-β-二酮的含量及其总含量均高于穗下茎,经观察,大麦扬花期叶鞘的白霜状物质较孕穗期更明显。穗下茎和叶鞘中β-二酮的含量均显著高于羟基-β-二酮(P<0.05)。孕穗期,叶鞘中β-二酮、羟基-β-二酮及总二酮的含量显著低于扬花期,与穗下茎中的含量差异均不显著。
2.4 大麦不同时期叶片表皮蜡质晶体结构的变化
大麦叶片表皮蜡质晶体的扫描电镜结果(图5)显示,大麦发育不同时期叶片上下表面的蜡质晶体均呈现片状结构,且不均匀覆盖在整个叶片表面上。不同发育时期表皮蜡质片状晶体的密度存在明显差异。在发育100 d时,片状晶体分布较稀疏,且叶片上表面片状晶体的分布较下表面更密集(图5A、B)。随着大麦的生长发育,片状晶体的分布越来越致密,160 d(图5E、F)和190 d(图5G、H) 晶体分布最致密,与大麦叶片蜡质总量变化一致,210 d 片状晶体相对较稀疏(图5I、J),240 d 时蜡质晶体致密程度基本保持不变(图5K、L)。结合初级醇在各时期的含量变化推测,初级醇的生成可能是导致大麦叶片蜡质晶体呈现片状的原因之一。

表3 大麦孕穗期和扬花期不同器官表皮蜡质二酮的绝对含量Table 3 Absolute contents of diketones in different organs in barley at flowering stage and mature stage μg·cm-2
同列数据后不同字母表示差异在0.05水平显著。
Different letters following the values in same column indicate significant difference at 0.05 levels.

A和B:叶片上下表面(100 d);C和D:叶片上下表面(130 d);E和F:叶片上下表面(160 d);G和H:叶片上下表面(190 d);I和J:叶片上下表面(210 d);K和L:叶片上下表面(240 d)。
A and B:Adaxial and abaxial surface of leaf(100 d); C and D:Adaxial and abaxial surface of leaf(130 d); E and F:Adaxial and abaxial surface of leaf(160 d); G and H:Adaxial and abaxial surface of leaf(190 d); I and J:Adaxial and abaxial surface of leaf(210 d); K and L:Adaxial and abaxial surface of leaf(240 d).
图5大麦叶片表皮晶体的扫描电镜观察
Fig.5Cuticularwaxcrystalsontheleafsurfaceofbarley
2.5 大麦穗下茎和叶鞘表皮蜡质晶体结构
如图6显示,大麦穗下茎和叶鞘的蜡质晶体均呈棒状结构。与孕穗期比较,扬花期穗下茎和叶鞘表皮蜡质晶体分布均更致密,其中,叶鞘表皮蜡质晶体变化较为明显,且孕穗期和扬花期叶鞘表皮蜡质晶体较穗下茎更为致密。
3 讨 论
本研究从大麦叶片、穗下茎和叶鞘表皮蜡质共鉴定出20种蜡质化合物,分别为烷烃、初级醇、醛、脂肪酸和二酮,其含量存在明显差异,这与对拟南芥表皮蜡质组成的研究结果一致[7]。研究发现,拟南芥表皮蜡质的合成通路主要为合成初级醇的酰基还原途径与合成醛、烷烃、酮的脱羰途径两种[16]。依据大麦叶片蜡质组分推测,大麦叶片表皮蜡质的合成途径与拟南芥相似,但供试材料的穗下茎和叶鞘主要合成二酮,与拟南芥不同,这与罗文巧等[9]研究结果一致,推测大麦表皮蜡质的合成基因可能与拟南芥存在差异。

A:孕穗期穗下茎;B:扬花期穗下茎;C:孕穗期叶鞘;D:扬花期叶鞘。
A:Peduncle at booting stage; B:Peduncle at flowering stage; C:Leaf sheath at booting stage; D:Leaf sheath at flowering stage.
图6大麦孕穗期和扬花期不同器官表皮蜡质晶体的扫描电镜观察
Fig.6Cuticularwaxcrystalsonthesurfaceindifferentorgansofbarleyatfloweringstageandmaturestage
不同时期大麦叶片表皮蜡质成分存在很大的差异,大麦从三叶期(100 d)到扬花期(190 d)蜡质含量逐渐增加,随后逐渐降低并趋于稳定。穗下茎和叶鞘中蜡质总量变化趋势同叶片,推测在大麦的扬花期(190 d)之前,大麦表皮处于蜡质合成和发育阶段,蜡质合成活跃,各组织蜡质含量逐步增加。进入成熟期(210~240 d)后,蜡质合成减弱,蜡质发育基本完成,因此蜡质含量也降低。汪 勇等[17]研究发现,在小麦叶片发育早期(100 d),初级醇的含量最高,随后逐渐降低。而本研究发现,在大麦叶片发育早期(100 d),初级醇的含量极低,随后呈现逐渐增加的趋势,并在190 d达到最高。推测可能是因为品种不同所致。分析不同碳链长度的蜡质组分,发现大麦叶片表皮蜡质成分主要是C22~C30偶数碳链长度的初级醇,以C26醇含量最高,其次是烷烃和醛,分别以C25~C33奇数碳链和C24~C30偶数碳链为主,二酮和脂肪酸的含量相对较少,其中脂肪酸的碳链长度以C22~C28偶数碳链为主。大麦叶片表皮蜡质组成中,C26初级醇的含量最高,且叶片上下表皮蜡质晶体均呈现密集的片状结构,推测初级醇可能是使表皮蜡质呈现片状晶体结构的主要原因,这与张芸芸等[18]发现小麦叶片下表皮蜡质晶体结构为柱状的研究结果不同,可能由于大麦表皮蜡质组成与小麦存在差异。
大麦不同器官的表皮蜡质成分也存在很大的差异。孕穗期和扬花期穗下茎和叶鞘的蜡质主要成分为二酮,且蜡质晶体呈现棒状形态,这与拟南芥茎秆的片状晶体不同,与长角果茎秆的晶体形态一致[19]。Barthlott等[20]研究证明,棒状晶体的形成主要是因为蜡质中的二酮成分比较高。本研究发现,叶鞘和穗下茎表皮二酮的含量显著高于其他蜡质组分,且蜡质晶体呈棒状形态,可初步认为大麦中蜡质晶体呈现棒状形态与二酮有关。Zhang等[21]研究发现,二酮的含量是影响白霜状表型差异的主要原因之一。本研究中,扬花期大麦叶鞘和穗下茎表面的有明显白霜状蜡质,推测大麦叶鞘和穗下茎表面的白霜状与高含量二酮有关。植物表皮蜡质的合成及晶体形态与环境胁迫直接相关,干旱条件下植物为防止水分散失,表皮蜡质的含量普遍增多,且蜡质晶体密布植物表皮。一般认为蜡质含量越高,植物的抗旱性越强,抗病虫害能力越好[22]。本研究中,大麦不同器官的表皮有着丰富的蜡质,这些蜡质成分对于大麦对抗干旱等逆境有着重要的作用。本研究首次对大麦叶片蜡质的发育进行了研究,分析了大麦不同组织的蜡质成分变化,对今后进一步研究大麦蜡质组分的合成机理奠定了基础。
参考文献:
[1] 王美芳,陈巨莲,原国辉.植物表面蜡质对植食性昆虫取食行为的影响[J].生态环境学报,2009,18(3):1155.
WANG M F,CHEN J L,YUAN G H.Effects of plant epicuticular waxes on phytophagous insects behavior [J].EcologyandEnvironmentalScienses,2009,18(3):1155.
[2] SIEBER P,SCHORDERET M,RYSER U,etal.Transgenic Arabidopsis plants expressing a fungal cutinase show alterations in the structure and properties of the cuticle and postgenital organ fusions [J].ThePlantCell,2000,12(5):721.
[3] STEINKAMP M P.Ultrastructure of lesions produced byCercosporabeticolain leaves of beta vulgaris [J].PhysiologicalPlantPathology,1979,15(1):13.
[4] 宋 超,王 婧,郭彦军,等.植物表皮蜡质对环境胁迫的响应[J].植物生理学通讯,2011,47(10):951.
SONG C,WANG J,GUO Y J,etal,Response of plant epicuticular wax to environmental factors [J].PlantPhysiologyCommunications,2011,47(10):951.
[5] 李灵之,马 杰,向建华,等.植物角质层内外蜡质的差异及其与抗逆性的关系[J].植物生理学通讯,2011,47(7):680.
LI L Z,MA J,XIANG J H,etal.Composition differences of epicuticular and intracuticular wax layers and the relationship between cuticle and plant stress tolerance [J].PlantPhysiologyCommunications,2011,47(7):680.
[6] 杨昊虹,史 雪,夏凌峰,等.不同小麦品种(系)穗部表皮蜡质的成分及含量分析[J].麦类作物学报,2017,37(3):403.
YANG H H,SHI X,XIA L F,etal.Analysis on composition and content of cuticular waxes on spikes of different wheat varities(lines) [J].JournalofTriticeaeCrops,2017,37(3):403.
[7] STEPHEN G,WEN M,DAVID B,etal.The cytochrome P450 enzyme CYP96A15 is the midchain alkane hydroxylase responsible for formation of secondary alcohols and ketones in stem cuticular wax ofArabidopsis[J].PlantPhysiology,2007,145(3):653.
[8] MAO B G,CHENG Z J,LEI C L,etal.Wax crystal-sparse leaf 2,a rice homologue of WAX2/GL1,is involved in synthesis of leaf cuticular wax [J].Planta,2012,235(1):39.
[9] 罗文巧,吴洪启,赵 帅,等.小麦品系CP98(11)不同器官表皮蜡质组分和蜡质晶体结构的差异分析[J].西北植物学报,2017,37(3):495.
LUO W Q,WU H Q,ZHAO S,etal.Analysis of cuticular wax components and crystal structures in different organs of wheat line CP98(11) [J].ActaBotanicaBoreali-OccidentaliaSinica,2017,37(3):495.
[10] KERSTIN K,ENSIKAT H J.The hydrophobic coatings of plant surfaces:Epicuticular wax crystals and their morphologies,crystallinity and molecular self-assembly [J].Micron(Oxford,England:1993),2008,39(7):759.
[11] 胡继超,姜 东,曹卫星,等.短期干旱对水稻叶水势、光合作用及干物质分配的影响[J].应用生态学报,2004,15(1):63.
HU J C,JIANG D,CAO W X,etal.Effect of short-term drought on leaf water potential,photosynthesis and dry matter partitioning in paddy rice [J].TheJournalofAppliedEcology,2004,15(1):63.
[12] COCHARD H,COLL L,LE ROUX X,etal.Unraveling the effects of plant hydraulics on stomatal closure during water stress in walnut [J].PlantPhysiol,2002,128(1):282.
[13] KOLODZIEJEK I,KOZIOL J,WALEZA M,etal.Ultrastructrue of mesophyll cells and pigment content in senescing leaves of maize and barley [J].JournalofPlantGrowthRegulation,2003,22(3):217.
[14] 杨金华,程加省,于亚雄,等.不同栽培方式对大麦叶片性状的影响[J].西南农业学报,2010,23(1):37.
YANG J H,CHENG J S,YU Y X,etal.Effect of different cultivation model on barley leaf characteristics [J].SouthwestChinaJournalAgriculturalSciences,2010,23(1):37.
[15] 陈文利,徐朗莱,沈文飚,等.盐胁迫下两品种大麦叶片H2O2累积及其清除酶活性的变化[J].南京农业大学学报,1999,22(2):97.
CHEN W L,XU L L,SHEN W B,etal.Changes of hydrogen peroxide accumulation and hydrogen peroxide-scavenging enzyme activity in the leaves of two barley species under salt stress [J].JournalofNanjingAgriculturalUniversity,1999,22(2):97.
[16] ROWLAND O.CER4 encodes an alcohol-forming fatty acyl-coenzyme a reductase involved in cuticular wax production inArabidopsis[J].PlantPhysiology,2006,142(3):866.
[17] WANG Y,WANG J,CHAI G.Developmental changes in composition and morphology of cuticular waxes on leaves and spikes of glossy and glaucous wheat(TriticumaestivumL.) [J].PloSOne,2015,10(10):e0141239.
[18] 张芸芸,李婷婷,孙瑜琳,等.小麦叶片表皮蜡质成分及含量分析[J].麦类作物学报,2014,34(7):963.
ZHANG Y Y,LI T T,SUN Y L,etal.Analysis on composition and content of leaf cuticular waxes of wheat(Triticumaestivum) detected by GC-MS [J].JournalofTriticeaeCrops,2014,34(7):963.
[19] BERNARD A I.Arabidoosiscuticular waxes:Advances in synthesis,export and regulation [J].ProgressinLipidResearch,2013,52(1):110.
[20] BARTHLOTT W,NEINHUIS C,DACID C,etal.Classification and terminology of plant epicuticular waxes [J].BotanicalJournaloftheLinneanSociety,1998,126(3):237.
[21] ZHANG Z.Genetic interactions underlying the biosynthesis and inhibition of 2-diketones in wheat and their impact on glaucousness and cuticle permeability [J].PloSOne,2013,8(1):e54129.
[22] SANCHEZ F J.Residual transpiration rate,epicuticular wax load and leaf colour of pea plants in drought conditions.Influence on harvest index and canopy temperature [J].EuropeanJournalofAgronomy,2001,15(1):57.

