旗叶蜡质含量不同小麦近等基因系的抗旱性
徐 文申 浩郭 军余晓丛李 祥杨彦会马 晓赵世杰,*宋健民,*
1作物生物学国家重点实验室 / 山东农业大学生命科学学院, 山东泰安271018;2山东省农业科学院作物研究所, 山东济南 250100
旗叶蜡质含量不同小麦近等基因系的抗旱性
徐 文1,2申 浩1,2郭 军2余晓丛2李 祥1杨彦会1马 晓1赵世杰1,*宋健民2,*
1作物生物学国家重点实验室 / 山东农业大学生命科学学院, 山东泰安271018;2山东省农业科学院作物研究所, 山东济南 250100
于2013—2014和2014—2015年度, 以多蜡质和少蜡质的4个小麦近等基因系为材料, 采用田间旱棚方式控制土壤水分, 研究了蜡质含量与小麦抗旱性的关系。结果表明, 干旱处理后, 多蜡质小麦品系旗叶的蜡质含量平均为15.15 mg g-1, 较少蜡质小麦品系(8.43 mg g-1)高79.8%; 多蜡质小麦品系旗叶的水势较高, 干旱处理后下降幅度明显小于少蜡质小麦品系, 水分散失率也显著低于少蜡质品系(P < 0.05); 多蜡质小麦品系旗叶的光合速率平均下降 7.5%,而少蜡质小麦品系下降9.8%; 多蜡质小麦品系旗叶PSII最大光化学效率(Fv/Fm)平均下降幅度为3.4%, 少蜡质小麦品系下降幅度达到5.8%; 多蜡质小麦品系的籽粒产量高于少蜡质品系, 平均高3.7%; 多蜡质小麦品系的抗旱指数和干旱敏感指数均显著低于少蜡质小麦品系(P < 0.05)。以上结果表明, 蜡质能够提高小麦的抗旱性, 旗叶蜡质含量可以作为抗旱小麦品种的选择指标。
小麦; 近等基因系; 蜡质含量; 抗旱性
干旱对小麦产量影响巨大[1-2], 一般减产 10%~ 15%, 严重时达80%~100%[3], 如2006年的干旱造成澳大利亚小麦减产 46%[4]。干旱胁迫下植物会产生一系列耐旱或避旱反应, 如叶片气孔迅速关闭、叶面积缩小等, 以减少蒸腾失水, 同时积累渗透调节物质(如脯氨酸等), 维持较高的细胞膨压, 减缓或减轻干旱伤害[5]; 其中, 诱导植物叶片蜡质产生或蜡质层增厚是植物对干旱胁迫的一种重要反应[6-7]。
蜡质与角质结合形成一层脂质角质层, 覆盖在植物叶片或茎秆表面。蜡质主要是由超长脂肪酸链及其衍生物(包括烷烃、醇、醛、脂肪酸和酯类)组成,还包括萜类和其他微量次生代谢物, 如固醇和类黄酮类物质[8-10]。另外, 不同物种或同一植物的不同器官, 其蜡质组分不尽相同[11]。蜡质对植物具有重要的保护作用, 可以阻止植物组织内水分的非气孔性散失[12], 防止强光、紫外线等有害光线对植物的伤害[13]和避免被病菌侵害和防止昆虫取食[14-17]等。
尽管对植物蜡质的组成和功能已有很多研究报道, 但较少研究蜡质对小麦抗旱性的影响, 并且不同研究采用不同的品种[14-17], 无法避免遗传背景对研究结果的影响。近等基因系(near isogenic lines, NIL)是指一组遗传背景相同或相近, 而某个特定性状有显著差异的品系, 是研究特定性状或基因功能的最佳材料[18]。本研究利用旗叶蜡质差异显著的 4个近等基因系, 探讨干旱胁迫下蜡质含量对小麦旗叶的水势和水分散失速率、光合特性以及产量的影响, 为抗旱小麦品种的选育提供理论依据。
1 材料与方法
1.1 植物材料的种植与处理
从小麦品种藁城 9411×ATHLET后代中选育出旗叶蜡质含量显著不同的4个近等基因系(F6代), 其中JM205和JM208为多蜡质品系, JM204和JM206为少蜡质品系。于2013—2014和2014—2015年度,将这2对材料分别种植于山东农业大学农学试验站,进行正常浇水和干旱胁迫处理。对于干旱处理, 在拔节期搭建人工干旱遮雨棚, 小区四周用塑料膜纵向隔离水分, 控制土壤中水分含量, 晴天时揭掉旱棚遮雨膜, 减少处理间光照差异, 收获时拆除旱棚。随机区组设计, 3次重复。小区面积1.5 m ×4.0 m, 每小区种6行, 行距25 cm, 播种密度为300万株 hm-2,按高产田常规栽培措施管理。
每年在抽穗初期(Zadoks, Z51)[19]选取生长健壮、发育一致的植株挂牌标记, 于灌浆中期(花后15 d左右)取样测定旗叶蜡质含量、水势和光合特性等指标, 每次测定5~10片叶计算平均值, 成熟收获时计算籽粒产量和干旱相关指数。
1.2 蜡质含量测定
2013—2014年度, 分别取对照和干旱处理的小麦旗叶按照Adamski等[20]描述的方法提取和测定蜡质含量, 取样时不要损伤表皮蜡质。
1.3 土壤水势、旗叶水势和旗叶水分散失速率的测定
2013—2014和2014—2015年度, 分别于小麦开花盛期(Z65)、灌浆中期(花后15 d左右)、灌浆后期(花后25 d左右), 用PSYPRO露点水势仪(Wescor, 美国),参照使用说明书中介绍的方法测定土壤水势。
2013—2014年度, 小麦灌浆中期, 于晴天 8:30 —9:30, 用相同设备测定旗叶水势; 分别取对照和处理旗叶, 充分浸泡使水分饱和后, 置室温黑暗中(气孔完全关闭), 按Zhang等[21]描述的方法测定旗叶水分散失速率。
1.4 小麦旗叶光合特性和叶绿素荧光参数的测定
2013—2014年度, 于小麦灌浆中期, 选择晴天8:30—10:30, 用CIRAS-2光合作用测定系统(PP Systems, 美国)测定旗叶的光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)、蒸腾速率(E), 测定条件为LED光源, 光强1200 μmol m-2s-1, CO2浓度380 μmol mol-1, 大气湿度和温度。
在测定光合参数的当天, 分别于晴天7:30和12:00, 经过暗适应30 min后, 利用Handy-PEA植物效率仪(Hansatech, 英国)测定旗叶叶绿素荧光动力学曲线, 计算相应的荧光参数[22-23]。
1.5 籽粒产量测定和干旱相关指数计算
由于取样管理造成面积的微小差异, 为准确计产, 成熟时进一步精确测量小区的收获面积, 收获小区全部植株, 测定小区产量, 计算单位面积产量。于2013—2014和2014—2015年度进行产量比较试验,每年度3次重复, 取平均值作为该处理的产量。
采用抗旱指数(tolerance, TOL)和干旱敏感指数(stress susceptible index, SSI)评价抗旱性[24-25]。
抗旱指数= 对照产量- 干旱处理产量

1.6 统计分析
利用SAS 9.0软件进行方差分析和差异显著性检验, 品系间的差异用LSD法来表示; 利用SigmaPlot 12.0软件绘制柱形图和折线图, 并利用PhotoShop CS 6.0软件处理图片。
2 结果与分析
2.1 小麦近等基因系旗叶蜡质含量比较
少蜡质品系JM204和JM206植株叶片和叶鞘的蜡质较少, 植株青绿; 而多蜡质品系 JM205和JM208植株叶片和叶鞘表面覆盖了一层蜡质(图1-A, B)。不论是在正常浇水还是干旱胁迫后, 多蜡质与少蜡质近等基因系间旗叶蜡质含量的差异均达到显著水平(图1-C)。正常浇水条件下, 2个多蜡质小麦品系旗叶蜡质含量平均为7.05 mg g-1, 显著高于少蜡质品系(平均为3.38 mg g-1); 干旱胁迫处理后, 多蜡质小麦品系旗叶蜡质含量平均为 15.15 mg g-1, 较少蜡质品系高79.8%。干旱胁迫后, 4个小麦品系旗叶蜡质含量都增加1倍以上, 多蜡质小麦品系旗叶蜡质增加 115.2%, 少蜡质小麦品系增加 150.7%, 少蜡质小麦品系增加的幅度显著大于多蜡质小麦品系。

图1 不同小麦近等基因系的表型和两种水分条件下旗叶蜡质含量比较Fig.1 Phenotypes of different NILs at flowering stage and comparison of flag leaf cuticular wax contents under two soil moisture conditions
2.2 干旱胁迫对旗叶水势和水分散失速率的影响
小麦开花期, 正常浇水处理的土壤水势为-0.12 MPa, 而干旱处理的土壤水势降到-0.75 MPa, 直到灌浆后期土壤含水量一直维持在中度水分胁迫程度。正常浇水条件下, 多蜡质品系旗叶平均水势比少蜡质品系高 34.4%; 而干旱处理条件下, 多蜡质品系旗叶平均水势比少蜡质品系高35.2% (图2)。说明不论在正常浇水条件下, 还是干旱胁迫条件下,多蜡质品系旗叶都能保持更多的水分, 有利于减轻干旱胁迫伤害。
在黑暗室温条件下, 小麦旗叶脱水速度非常快,蜡质含量对叶片自然脱水有明显影响。自然脱水2 h, 4个小麦品系脱水都达到 40%左右, 少蜡质品系旗叶的水分散失速率稍高于多蜡质品系; 脱水 2~4 h,少蜡质品系继续快速脱水, 而多蜡质品系脱水速率明显下降, 二者差异显著(P < 0.05); 脱水4 h时, 少蜡质品系JM204和JM206叶片水分散失率分别达到75.3%和66.9%, 而多蜡质品系JM205和JM208仅为48.7%和47.3%; 脱水4 h后, 少蜡质品系脱水速率显著变缓, 多蜡质品系叶片脱水速率虽然高于少蜡质品系, 但脱水8 h时, 多蜡质品系水分散失率仍显著低于少蜡质品系(图3)。由此说明, 多蜡质品系旗叶的脱水速度慢, 保水能力强, 能够维持较高的叶片含水量。
2.3 干旱胁迫对小麦近等基因系旗叶光合特性的影响
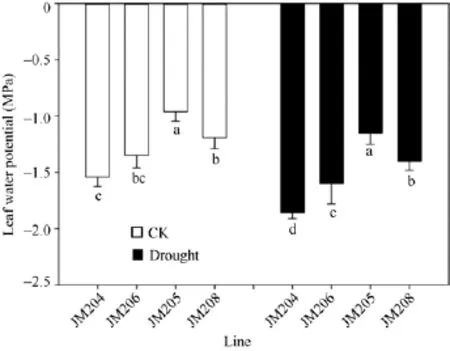
图2 正常浇水(CK)和干旱胁迫(drought)下不同小麦近等基因系灌浆中期旗叶水势比较Fig.2 Comparison of flag leaf water potential of wheat NILs under well-watered (CK) and drought conditions in the middle stage of grain filling
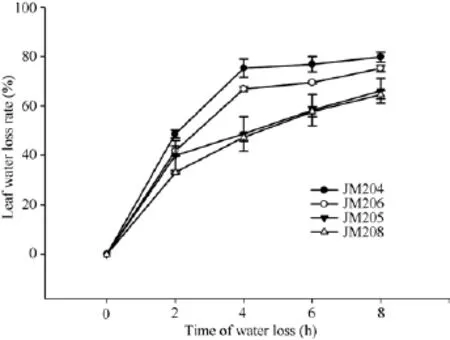
图3 干旱胁迫对不同小麦近等基因系灌浆中期旗叶水分散失速率的影响Fig.3 Effect of drought stress on water loss rate of flag leaf in wheat NILs in the middle stage of grain filling
正常浇水条件下, 多蜡质品系JM205和JM208旗叶平均Pn显著高于少蜡质品系JM204和JM206 (P < 0.05), 并且其Gs、E和Ci也显著高于JM204和JM206。干旱胁迫后, 4个品系的Pn均降低, 多蜡质和少蜡质品系的平均Pn分别下降7.5%和9.8%, 多蜡质品系仍显著高于少蜡质品系(图4-A); 多蜡质品系旗叶的Gs平均降低5.1%, 而少蜡质品系旗叶的Gs显著升高, 平均升高14.9% (图4-D); 多蜡质品系旗叶E减少10.1%, 而少蜡质品系旗叶E增加13.5% (图4-C);干旱处理后, Ci升高, 多蜡质品系增加幅度(4.3%)小于少蜡质小麦品系7.5% (图4-B)。总之, 干旱胁迫处理后, 4个品系光合速率均降低、Ci增加, 但多蜡质品系Gs、E减小, 而少蜡质品系Gs、E增大。
结果表明, 不论是正常浇水还是干旱处理条件下, 中午高温强光条件下, 小麦品系旗叶Fv/Fm均下降, 但干旱胁迫条件下, 多蜡质小麦品系旗叶 Fv/Fm平均下降幅度显著小于少蜡质小麦品系(P < 0.05),前者下降3.4%, 后者达5.8% (图4-E)。由此说明, 蜡质能够减轻干旱胁迫造成的光抑制, 维持旗叶较高的光能转换效率。
2.4 小麦近等基因系籽粒产量比较和抗旱性评价
由表1可知, 正常浇水条件下, 多蜡质品系的籽粒产量低于少蜡质品系, 2年平均低4.1%; 干旱胁迫处理后, 4个小麦品系的籽粒产量均明显下降, 多蜡质品系JM205和JM208籽粒产量两年平均分别下降11.3%和4.7%, 少蜡质品系JM204和JM206分别下降15.2%和18.5%, 多蜡质品系产量下降幅度显著较小, 干旱处理后的籽粒产量高于少蜡质品系, 平均高出3.7%, JM208甚至高出JM206达8.3%。另外,多蜡质品系的抗旱指数和干旱敏感指数值也显著低于少蜡质品系。
3 讨论
干旱缺水是制约作物产量的重要因素[26-27]。大量研究表明, 蜡质对于提高小麦抗干旱能力有明显的作用, 然而这些研究所用的材料来自不同的国家和地区, 且遗传背景差异很大[14-17]。因此, 本研究利用4个旗叶蜡质含量差异显著的小麦近等基因系,探究蜡质对小麦抗旱性的影响。结果表明, 无论正常浇水还是干旱胁迫条件下, 多蜡质小麦品系旗叶蜡质含量均显著高于少蜡质品系(图1); 干旱胁迫后,小麦近等基因系旗叶蜡质含量均显著增加(P < 0.05),这说明干旱胁迫可以诱导小麦蜡质合成相关基因的大量表达, 生成较多的蜡质[28], 从而减轻干旱对植物生长造成的不利影响。
叶片水势和水分散失速率是衡量植物抗旱性的重要指标, 水势越高, 水分散失速率越慢, 其抗旱性越强[21]。然而, 到目前为止, 未见关于小麦蜡质与叶片水势关系的研究报道。本研究结果表明,干旱条件下, 叶片表皮蜡质含量增加(图1-C), 叶片水分散失速率降低(图3), 从而维持较高的叶片水势(图2)。小麦旗叶蜡质与叶片水分散失速率和叶片水势间存在密切关系, 即多蜡质小麦品系旗叶水分散失速率显著小于少蜡质小麦品系, 抗旱能力更强。
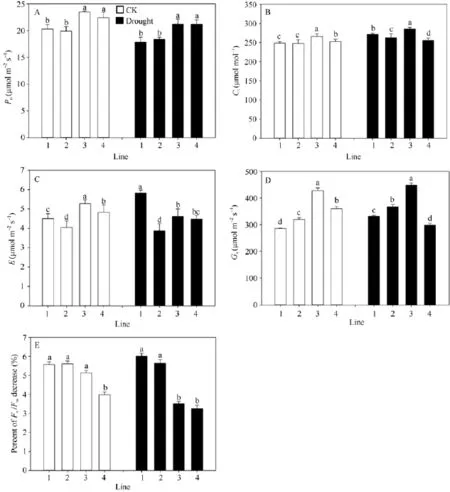
图4 不同蜡质含量小麦近等基因系旗叶光合速率Pn(A)、胞间CO2浓度Ci(B)、蒸腾速率E (C)、气孔导度Gs(D)和Fv/Fm(E)Fig.4 Flag leaf photosynthetic rate Pn(A), intercellular CO2concentration Ci(B), transpiration rate E (C), stomatal conductance Gs(D), and Fv/Fm(E) in wheat NILs with different cuticular wax contents under well-watered and drought stress conditions
光合作用是作物干物质积累和产量的基础, 极易受干旱胁迫的影响[29-30], 干旱胁迫导致植物光合速率和PSII活性显著降低。黄玲等[1]研究表明, 在干旱条件下灌浆后期小麦叶片表面的蜡质含量与光合速率和产量呈正相关。在本研究中, 无论正常浇水还是干旱胁迫条件下, 灌浆中期多蜡质小麦品系光合速率显著高于少蜡质品系(P < 0.05), 干旱胁迫后, 多蜡质小麦旗叶光合速率下降幅度明显较小(图4-A)。
植物受到干旱胁迫, 叶片细胞膨胀势或水势下降, 一般会关闭气孔, 这是植物对水分缺失的最初响应[31]。气孔关闭减少了蒸腾作用, 同时也减少了叶绿体中CO2的同化量[31]。本研究发现, 旗叶蜡质含量与气孔导度下降、胞间CO2浓度升高、蒸腾速率下降有一定关系。干旱胁迫后, 旗叶光合速率下降, 胞间CO2浓度均升高, 但与少蜡质小麦品系气孔导度、蒸腾速率均增加相比, 多蜡小麦品系蒸腾速率和气孔导度均明显降低(图4-C和D), 说明多蜡质小麦是由于气孔限制造成了光合速率的下降, 而少蜡质小麦则是叶肉光合活性降低导致光合速率的下降。干旱胁迫后, 旗叶蜡质含量增加, 减缓了叶片水分散失, 进而减轻干旱胁迫引起的光合速率下降, 维持了相对较高的光合速率, 这可能是蜡质增强抗旱性、提高籽粒产量的重要原因(表1)。
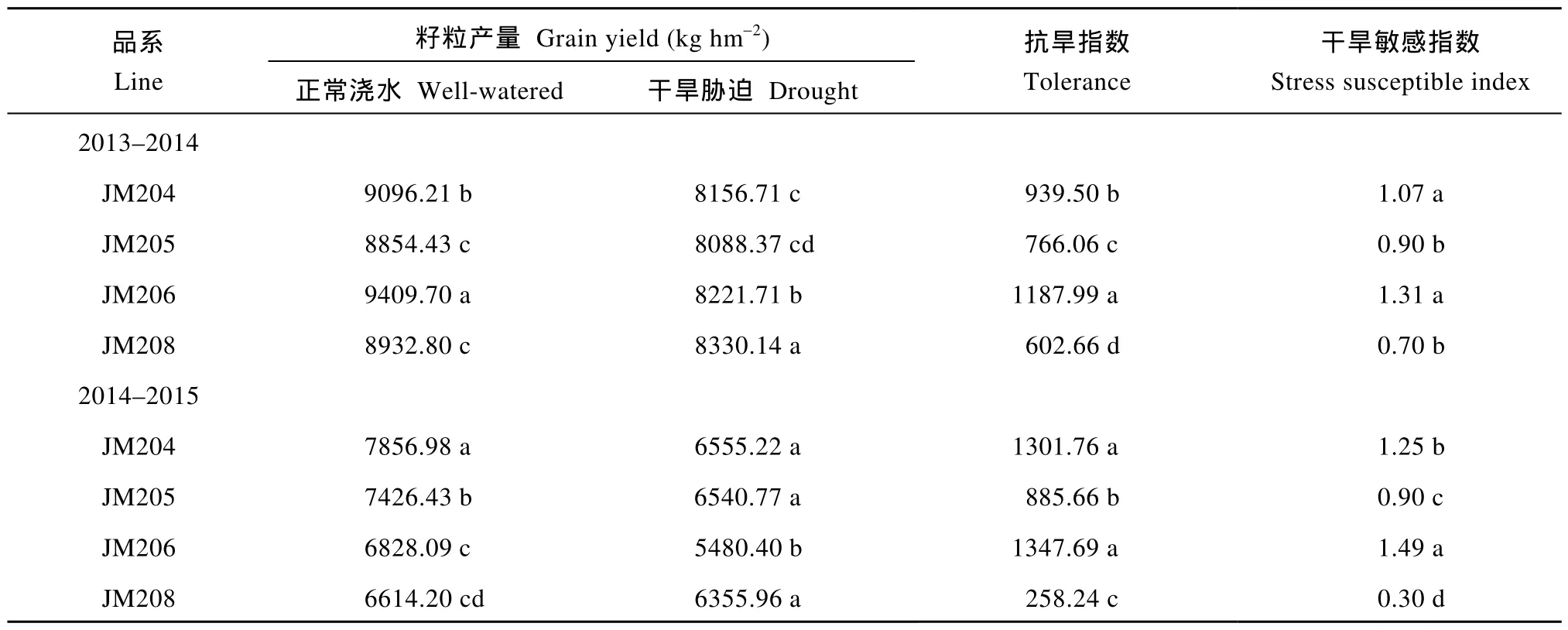
表1 小麦不同蜡质含量近等基因系的籽粒产量和抗旱性Table1 Grain yield and drought tolerance of NILs with different cuticular wax contents
Fv/Fm是PSII活性受抑制程度的衡量指标, 植物受到逆境胁迫(如高温强光)后, Fv/Fm降低。本研究发现, 多蜡质和少蜡质小麦品系间Fv/Fm下降幅度存在明显差异(图4-E)。干旱条件下, 多蜡质小麦旗叶光抑制程度较低, 而少蜡质小麦光抑制较重(图4-E),说明干旱胁迫条件下, 蜡质含量的增加有利于对过剩光能的反射和散射, 植物吸收的有效光能减少,光抑制减轻[32]。多蜡质小麦较多的蜡质一方面降低了水分散失速率, 保持较高水势, 另一方面也提高了干旱条件下的PSII活性, 减轻了光抑制, 使叶片维持了相对较高的光合速率, 这可能是蜡质影响籽粒产量的又一原因。另外, 干旱胁迫条件下, 多蜡质小麦品系灌浆后期叶片持绿期延长, 衰老变慢(图5),平均比少蜡质品系持绿时间延长2 d, 这也可以有效地提高籽粒产量。

图5 干旱胁迫条件下小麦少蜡质和多蜡质近等基因系灌浆后期田间生长情况Fig.5 Phenotype of wheat NILs with different cuticular wax contents in leaves at late grain-filling stage under drought stress
培育节水抗旱品种是解决干旱缺水制约作物产量这一问题的最经济、有效的方法, 很多科学工作者开展了小麦抗旱分子标记辅助育种或分子设计育种工作[26-28]。尽管分子标记辅助选择已经在育种中得到广泛应用, 但由于工作量相对巨大, 经济投入较高[33-34], 再加上目前有效的抗旱分子标记较少,因此, 仍然需要寻找更方便、更经济的抗旱选择指标。而与抗旱相关的生理指标为解决上述问题提供了有效的途径, 目前, 脯氨酸含量、抗旱指数和干旱敏感指数等[5, 24]已初步应用于小麦抗逆辅助选择育种。本研究发现, 干旱胁迫后, 小麦可以通过调控与蜡质合成相关基因的表达, 促进蜡质的合成, 进而提高叶片蜡质含量, 并通过降低叶片水分散失速率、维持较高水势, 关闭气孔、降低蒸腾速率和减小Fv/Fm下降幅度等一系列反应, 减轻干旱危害, 使小麦叶片维持相对较高的光合速率, 制造更多光合产物分配到籽粒中, 最终维持相对较高的籽粒产量。
4 结论
干旱胁迫条件下, 小麦多蜡质品系旗叶蜡质含量平均为15.15 mg g-1, 而少蜡质品系仅为8.43 mg g-1。前者比后者旗叶的脱水速度慢, 保水能力强,能减轻干旱胁迫造成的光抑制, 使旗叶维持较高的光合速率和延长光合持续期, 为最终获得较高产量奠定基础。多蜡质品系的平均籽粒产量比少蜡质品系高 3.7%, 且抗旱指数和干旱敏感指数显著低于少蜡质小麦, 表现更强的抗旱能力。
[1] 黄玲, 张正斌, 崔玉亭, 刘孟雨, 柴守玺, 陈兆波.小麦叶片蜡质含量与水分利用效率和产量的关系.麦类作物学报, 2003, 23(3): 41–44
Huang L, Zhang Z B, Cui Y T, Liu M Y, Chai S X, Chen Z B.Relationship between cuticular wax content and water use efficiency of leaf and yield in wheat.J Triticeae Crops, 2003, 23(3): 41–44 (in Chinese with English abstract)
[2] Johnson D A, Richards R A, Turner N C.Yield, water relations, gas exchange, and surface reflectances of near-isogenic wheat lines differing in glaucousness.Crop Sci, 1983, 23: 318–325
[3] Foulkes M J, Sylvester-Bradley R, Weightman R, Weightman, Snape J W.Identifying physiological traits associated with improved drought resistance in winter wheat.Field Crops Res, 2007, 103: 11–24
[4] FAO.Drought.2013.http://www.fao.org/docrep/017/aq191e/ aq191e.pdf
[5] 柴凌燕, 董易凡, 李士伟, 史团省.植物角质膜及其渗透性与抗旱性研究进展.植物研究, 2010, 30: 763–768
Chai L Y, Dong Y F, Li S W, Shi T X.Research progress in permeability and drought resistance of plant cuticular.Bull Bot Res, 2010, 30: 763–768 (in Chinese with English abstract)
[6] 李魏强, 张正斌, 李景娟.植物表皮蜡质与抗旱及其分子生物学.植物生理与分子生物学报, 2006, 32: 505–512
Li W Q, Zhang Z B, Li J J.Plant epicuticular cuticular wax and drought resistance as well as its molecular biology.J Plant Physiol Mol Biol, 2006, 32: 505–512 (in Chinese with English abstract)
[7] 李婧婧, 黄俊华, 谢树成.植物蜡质及其与环境的关系.生态学报, 2011, 31: 565–574
Li J J, Huang J H, Xie S C.Plant cuticular wax and its response to environmental conditions: an overview.Acta Ecol Sin, 2011, 31: 565–574 (in Chinese with English abstract)
[8] Pollard M, Beisson F, Li Y H, Ohlrogge J B.Building lipid barriers: biosynthesis of cutin and suberin.Trends Plant Sci, 2008, 13: 236–246
[9] Kunst L, Samuel L.Plant cuticles shine: advances in cuticular wax biosynthesis and export.Plant Biol, 2009, 12: 721–727
[10] Bianchi G, Lupotto E, Borghi B, Corbellini M.Cuticular cuticular wax of wheat.The effects of chromosomal deficiencies on the biosynthesis of cuticular wax components.Planta, 1980, 148: 328–331
[11] Suh M C, Samuels A L, Jetter R, Kunst L, Pollard M, Ohlrogge J, Beisson F.Cuticular lipid composition, surface structure, and gene expression in Arabidopsis stem epidermis.Plant Physiol, 2005, 139: 1649–1665
[12] Premchandra G S, Saneoka H, Fujita K, Ogata S.Leaf water relations osmotic adjustment cell membrane stability epicuticular cuticular wax load and growth as affected by increasing water deficit in Sorghum.J Exp Bot, 1992, 43: 1569–1576
[13] Bames J D, Percy K E, Poul N D.The influence of UV-B radiation on the physicochemical nature of tobacco (Nicotiana tabacum L.) leaf surface.J Exp Bot, 1996, 47: 99–109
[14] Eigenbrode S D, Espelie K E.Effects of plant epicuticular lipids on insect herbivores.Annu Rev Entomol, 1995, 40: 171–194
[15] Kosma D K, Jill A, Nemacheck.Changes in properties of wheat leaf cuticle during interactions with Hessian fly.Plant J, 2010, 63: 31–43
[16] 王美芳, 陈巨莲, 原国辉, 雷振生, 吴政卿, 赵献林.植物表面蜡质对植食性昆虫的影响研究进展.生态环境学报, 2009, 18: 1155–1160
Wang M F, Chen J L, Yuan G H, Lei Z S, Wu Z Q, Zhao X L.Effects of plant epicuticular cuticular waxes on phytophagous insects behaviour.Ecol Environ Sci, 2009, 18: 1155–1160 (in Chinese with English abstract)
[17] 刘勇, 陈巨莲, 程登发.不同小麦品种(系)叶片表面蜡质对两种麦蚜取食的影响.应用生态学报, 2007, 18: 1785–1788
Liu Y, Chen J L, Cheng D F.Effects of wheat leaf surface cuticular waxes on the feeding of two wheat aphid species.Chin J Appl Ecol, 2007, 18: 1785–1788 (in Chinese with English abstract)
[18] 李希峰, 董娜.小麦近等基因系的构建及应用进展.安徽农业科学, 2012, 40: 2577–2579
Li X F, Dong N.Progress in construction and application of near-isogenic line in wheat.J Anhui Agric Sci, 2012, 40: 2577–2579 (in Chinese with English abstract)
[19] Zadoks J C, Chang T T, Konzak C F.A decimal code for growth stages of cereals.Weed Res, 1974, 14: 415–421
[20] Adamski N M, Bush M S, Simmonds J, Turner A S, Mugford S G, Jones A, Findlay K, Pedentchouk N, von Wettstein-Knowles P, Uauy C.The Inhibitor of wax 1 locus (Iw1) prevents formation of β-and OH-β-diketones in wheat cuticular waxes and maps to a sub-cM interval on chromosome arm 2BS.Plant J, 2013, 746: 989–1002
[21] Zhang Z, Wang W, Li W.Genetic interactions underlying the biosynthesis and inhibition of β-diketones in wheat and their impact on glaucousness and cuticle permeability.PLoS One, 2013, 8: e54129
[22] 李鹏民, 高辉远, Strasser R.快速叶绿素荧光诱导动力学分析在光合作用研究中的应用.植物生理与分子生物学学报, 2005, 31: 559–566
Li P M, Gao H Y, Strasser R.Application of the fast chlorophyll fluorescence induction dynamics analysis in photosynthesis study.Acta Photophysiol Sin, 2005, 31: 559–566 (in Chinese with English abstract)
[23] Strasser R, Tsimill-Michael M, Srivastava A.Analysis of the chlorophyll a fluorescence transient.In: Papageorgiou G C, Govindjee, eds.Advances in Photosynthesis and Respiration.Volume 19: Chlorophyll a Fluorescence: A Signature of Photosynthesis.Berlin: Springer, 2004.pp 321–362
[24] Fischer R A, Maurer R.Drought resistance in spring wheat cultivars: I.Grain yield responses.Aust J Agric Res, 1978, 29: 897–912
[25] Rosielle A A, Hamblin J.Theoretical aspects of selection for yield in stress and non-stress environment.Crop Sci, 1981, 21: 943–946
[26] Fleury D, Jefferies S, Kuchel H, Langridge P.Genetic and genomic tools to improve drought tolerance in wheat.J Exp Bot, 2010, 61: 3211–3222
[27] Piao S, Ciais P, Huang Y, Huang Y, Shen Z, Peng S, Li J, Zhou L, Liu H, Ma Y, Ding Y, Friedlingstein P, Liu C, Tan K, Yu Y, Zhang T, Fang J.The impacts of climate change on water resources and agriculture in China.Nature, 2010, 467: 43–51
[28] Shinozaki K, Yamaguchi-Shinozaki K, Seki M.Regulatory network of gene expression in the drought and cold stress responses.Curr Opin Plant Biol, 2003, 6: 410–417
[29] Reddy A R, Chaitanya K V, Vivekanandan M.Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants.J Plant Physiol, 2004, 161: 1189–1202
[30] Yordanov I, Velikova V, Tsonev T.Plant responses to drought, acclimation, and stress tolerance.Photosynthetica, 2000, 38: 171-186
[31] Parent B, Shahinnia F, Maphosa L, Berger B, Rabie H, Chalmers K, Langridge, Fleury D.Combining field performance with controlled environment plant imaging to identify the genetic control of growth and transpiration underlying yield response to waterdeficit stress in wheat.J Exp Bot, 2015, 66: 5481–5492
[32] 高杨.小麦叶片表皮蜡质的测定及其对光合和农艺性状的效应分析.西北农林科技大学硕士论文, 陕西杨凌, 2014.pp 21–34
Gao Y.Determination of Epidermal Wax Content in Wheat Leaves and Analysis on Its Effect on Photosynthetic and Agronomic Traits.MS Thesis of Northwest A&F University, Yangling, China, 2014.pp 21–34 (in Chinese with English abstract)
[33] Mir R R, Zaman-Allah M, Sreenivasulu N, Trethowan R, Varshney R K.Integrated genomics, physiology and breeding approaches for improving drought tolerance in crops.Theor Appl Genet, 2012, 125: 625–645
[34] Tuberosa R, Maccaferri M.Genomics approaches to dissect the genetic basis of drought resistance in durum wheat.In: Yasunari Q, Shigeo T, Hirokazu H, eds.Advances in Wheat Genetics: from Genome to Field.Springer, Japan, 2015.pp 213–223
Drought Resistance of Wheat NILs with Different Cuticular Wax Contents in Flag Leaf
XU Wen1, 2, SHEN Hao1, 2, GUO Jun2, YU Xiao-Cong2, LI Xiang1, YANG Yan-Hui1, MA Xiao1, ZHAO Shi-Jie1,*, and SONG Jian-Min2,*
1State Key Laboratory of Crop Biology / College of Life Sciences, Shandong Agricultural University, Tai’an 271018, China;2Crop Research Institute, Shandong Academy of Agricultural Sciences, Jinan 250100, China
The relationship of flag leaf cuticular wax content with leaf water potential, excised-leaf water loss, leaf photosynthesis characteristics and wheat yield under drought stress were analyzed in 2013–2014 and 2014–2015 wheat seasons using four wheat nearly isogenetic lines (NILs) differing in cuticular wax content in flag leaf.Under drought stress condition, the average flag leaf cuticular wax content of the high-wax NILs (15.15 mg g-1) was 79.8% higher than that of the low-wax NILs (8.43 mg g-1).Compared with the low-wax NILs, the high-wax NILs showed significantly higher water potential in flag leaf and lower water loss rate (P < 0.05).In response to drought stress, photosynthetic rate (Pn) and Fv/Fmof flag leaf declined in both types of NILs, however, the decrease percentages were lower in the high-wax NILs (7.5% and 3.4%, respectively) than in the low-wax NILs (9.8% and 5.8%, respectively).As a result, the average yield of the high-wax NILs was 3.7% higher than that of the low-wax NILs, and the drought tolerance (TOL) and stress susceptible index (SSI) of the high-wax NILs were significantly less than those of the low-wax NILs (P < 0.05).These results indicate that cuticular wax content in flag leaf is closely related to drought tolerance and can be used as a physiological indicator of drought resistance in wheat selection.
Common wheat (Triticum aestivum L.); Nearly isogenetic lines (NILs); Cuticular wax content; Drought resistance
10.3724/SP.J.1006.2016.01700
本研究由国家自然科学基金项目(31271635), 国家现代农业产业技术体系建设专项(CARS-03-1-8)和山东省自主创新重大关键技术计划项目(2014GJJS0201-1)资助。
This study was supported by the National Natural Science Foundation of China (31271635), the China Agriculture Research System (CARS-03-1-8), and the Innovation Project for Key Technologies in Shandong Province (2014GJJS0201-1).
*通讯作者(Corresponding authors): 赵世杰, E-mail: sjzhao@sdau.edu.cn; 宋健民, E-mail: song_jianmin@163.com
联系方式: E-mail: 18866929285@163.com
稿日期): 2016-01-14; Accepted(接受日期): 2016-06-20; Published online(
日期): 2016-08-01.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160801.1034.002.html

