滴灌甜菜对块根膨大期水分亏缺的补偿性响应
李阳阳 费 聪 崔 静 王开勇 马富裕樊 华
新疆石河子大学农学院 / 新疆生产建设兵团绿洲生态农业重点实验室, 新疆石河子 832003
研究简报
滴灌甜菜对块根膨大期水分亏缺的补偿性响应
李阳阳 费 聪 崔 静 王开勇 马富裕*樊 华*
新疆石河子大学农学院 / 新疆生产建设兵团绿洲生态农业重点实验室, 新疆石河子 832003
为探讨滴灌甜菜块根膨大期干旱胁迫及复水的生长补偿效应, 设置70% (T1)、50% (T2)和30% (T3)田间持水量,调查块根膨大期缺水对滴灌甜菜产量、农艺性状以及理化指标的影响。结果表明, 当土壤为30%田间持水量时, 甜菜产量比70%和50%田间持水量分别提高51.7%和17.6%, 产糖量分别提高48.7%和7.7%。与70%田间持水量相比, 50%和30%田间持水量条件下, 块根膨大期甜菜电导率、脯氨酸以及过氧化物酶活性均在复水1 d时显著增加。主成分分析表明, 细胞膜透性、抗氧化酶活性、渗透调节物质以及农艺特性共同调控块根膨大期甜菜抵御干旱胁迫, 其中块根可溶性糖含量不能作为甜菜抗旱性鉴定的指标。因此, 滴灌甜菜块根膨大期, 当土壤含水量下降至田间持水量的30%时及时补充灌溉, 不但不影响甜菜生长, 还有利于增加块根含糖量。
补偿效应; 水分亏缺; 甜菜; 滴灌
水分不足是干旱区农业生产的主要限制因子。大量研究表明, 植物对水分胁迫-复水的响应方式是在胁迫解除后存在短暂的快速生长, 以部分补偿胁迫造成的损失, 主要表现为根系生长及叶面积增大[1]。同时, 水分亏缺可造成细胞内活性氧增加[2-3], 引发细胞膜脂过氧化, 导致细胞相对电导率和丙二醛含量上升。为应对于干旱诱导的氧化应激, 植物抗氧化酶活性增加[4]以清除过多的活性氧。此时可溶性碳水化合物和脯氨酸等渗透调节物质[5-6]含量上升, 保持细胞膨压增加细胞膜的稳定性[7], 从而与保护酶系统共同维持细胞的正常功能[8-9]。根据水分亏缺程度,植物通常表现出超补偿、近等量补偿、适当恢复以及无恢复 4种状况[10], 这在不同作物和作物不同生长阶段[11]各异, 主要与作物生理特性有关。
甜菜是直根系作物, 根系发达, 主根多且侧根数量也多。同时, 甜菜叶面的角质层较厚, 维管束和栅栏组织发达, 叶脉多而稠密, 具有忍受一定程度干旱胁迫的生理基础。本研究利用甜菜耐旱性强的特点, 选取对水分胁迫较敏感的块根膨大期, 结合滴灌可高精度控水的优点, 从形态学特性到生理响应的角度, 系统揭示块根膨大期缺水对甜菜生长的补偿效应, 以及产生补偿效应所需的土壤水分阈值, 为干旱区滴灌甜菜高产优质节水潜力的挖掘提供理论依据。
1 材料与方法
1.1 试验地概况
新疆石河子大学农学院实验站(45°19′ N, 86°03′ E),海拔 450.8 m, 年平均气温 7.5~8.2℃,日照时数2318~2732 h, 无霜期147~191 d, 年降雨量180~270 mm,年蒸发量1000~1500 mm, 属典型的温带大陆性气候。试验区土壤为灌溉灰漠土, 质地为重壤, 耕层土壤含全氮0.89 g kg–1、速效磷0.022 g kg–1、速效钾0.249 g kg–1、碱解氮0.058 g kg–1、有机质13.25 g kg–1, pH 7.3。耕层土壤容重为1.6 g cm–3, 田间持水量为18% (质量含水量), 地下水埋深大于5 m。
1.2 试验设计
2013年4月至10月和2014年4月至10月两年试验。试材为甜菜品种Beta356。在甜菜块根膨大期(出苗后70 d至出苗后105 d)设置70%田间持水量(T1)、50%田间持水量(T2)、30%田间持水量(T3) 3种土壤水分, 当测定的土壤含水量降到设定范围内即灌水至田间持水量。灌水量由灌水定额计算公式确定[12]。

式中, m为灌水量(mm); ρb为该时段土壤计划湿润层内土壤容重(g cm–3); H为计划湿润层深度(cm), 本试验计划湿润层深度为40 cm; βi为目标含水量(田间持水量乘以目标相对含水量); βj为灌前土壤含水量。灌水量由水表记录。灌水灌溉误差5% (占田间持水量的百分比)。
采用膜下滴灌的方式种植甜菜, 行距为50 cm, 株距为20 cm。滴灌带配置模式为“1管2”模式, 即1条毛管控制2行甜菜。小区面积4 m ×12 m, 小区间设1 m隔离区,随机区组排列, 3次重复。为了保证出苗, 在播种后均滴水至土壤饱和含水量, 于出苗后 75 d通过控制灌水量开始处理, 出苗后110 d 块根膨大期结束。
1.3 测试项目与方法
于块根膨大期每日上午 9:00—10:00用 Watermark (Irrometer Company, Riverside, CA)张力计监测土壤墒情,同时采用烘干法对Watermark读数校准。在甜菜株间、行间、走道间分别于20、40和60 cm处安装Watermark传感器, 测定值可以反映土壤含水量状况, 测定范围为 0~ –2 bar (0 ~ –200 kPa), 0 bar表示土壤处于饱和含水量状态, –2 bar表示土壤极度干旱。块根膨大期每12 d破坏性取样测定甜菜干物质和叶面积, 共取样3次。收获期实收测产小区, 并选取20株测定块根含糖量。产糖量=单株产量×含糖量×公顷理论株数×出苗率。
在各处理复水历时0、24、48和72 h时间段, 用剪刀剪取植株上部完全展开叶片, 一部分材料立刻带回实验室测定丙二醛(MDA)和电导率, 另一部分材料迅速用锡箔纸包裹放至液氮罐内, 用于过氧化物酶(POD)、过氧化氢酶(CAT)、脯氨酸(Pro)、可溶性糖的分析。采用硫代巴比妥酸法测MDA含量, 电导率仪法测电导率, 愈创木酚法测POD活性, 紫外吸收法测CAT活性, 磺基水杨酸法测Pro含量, 蒽酮比色法测可溶性糖[13-14]。
补偿指数(Ci)指各指标在胁迫解除后与对照相比的恢复程度, 可反映甜菜补偿效应的大小。
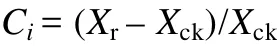
式中, Xr为胁迫解除后指标实测值; Xck为对照相应指标实测值。若Ci为正值则存在补偿现象, 若Ci为负值则说明对于某项指标在胁迫解除后不存在补偿现象[15]。本试验以 T1为对照, 计算T2、T3处理各农艺性状指标的补偿指数。
1.4 数据分析
用 SPSS12.0软件统计分析, 用单因素方差分析(one-way ANOVA)和最小显著差异法(LSD)比较不同数据组间的差异(P<0.05)。
2 结果与分析
2.1 滴灌甜菜产量性状方差分析
3 种土壤水分条件下的甜菜块根产量和产糖量均差异显著, 且随着田间持水量的降低而升高(表1), 其中 T3处理产量较T1、T2处理分别提高51.7%和17.6%, 产糖量分别提高 48.7%和 7.7%; 块根含糖量表现为T2>T1>T3。各处理甜菜块根产量、含糖量以及产糖量在年际间差异不显著, 含糖量在年份与处理的互作差异显著, 块根产量和产糖量在年份和处理的互作差异均不显著, 表明温度及降水等气候因素对滴灌甜菜的产量影响较小。
2.2 滴灌甜菜农艺性状比较
表2表明, 除比叶重外, 灌水后各处理甜菜叶柄、块根、含糖量、根冠比和叶面积指数均较控水前高, 其中叶柄、块根和叶面积指数的变化率均表现为 T1>T2>T3, 处理间含糖量的变化率表现为 T3>T2>T1, 根冠比的变化率表现为T2>T3=T1。从补偿指数可以看出, T2和T3块根含糖量产生正补偿效应, 补偿指数随土壤田间持水量的降低而升高, 比叶重在T3处理下产生正补偿效应, 叶柄、块根、根冠比和叶面积指数不产生补偿效应, 表明块根膨大期控水可抑制地上部分生长, 促进甜菜生长中心向地下部分转移, 有利于块根中糖分积累。

表1 滴灌甜菜产量方差分析Table1 Variance analysis of sugar beet yield under drip irrigation

表2 不同水分条件下滴灌甜菜的农艺性状Table2 Major traits of sugar beet in three water conditions
2.3 滴灌甜菜生理特性比较
灌水前甜菜叶片丙二醛含量和相对电导率均随着土壤含水量的降低而升高, 丙二醛含量的表现较为明显。复水后, 叶片丙二醛含量不断上升, 至复水3 d时超过灌水前水平, 表现为 T2>T3>T1。复水后叶片和块根相对电导率均先上升后降低, 至复水3 d时各处理基本一致, 但显著高出灌水前水平。
灌水前甜菜 CAT随着土壤含水量的降低而降低, POD表现为相反的变化趋势。复水后, 甜菜CAT和POD活性均先上升后下降, 至复水后3 d时CAT活性与灌水前无显著差异, 而 POD活性略高出灌水前水平, 表明叶片和块根POD对水分亏缺的应激反应较CAT明显。
灌水前甜菜叶片脯氨酸随着土壤含水量的降低而降低, 可溶性糖表现为相反的变化趋势。复水后, 叶片脯氨酸及可溶性糖含量均先上升后下降, 而块根可溶性糖含量不断升高, 至复水后3 d均表现为T3>T2>T1。
2.4 主成分分析
从表4可以看出, 主成分分析特征值中4个主成分的累计贡献率达到85.1%, 可以用这4个主成分对滴灌甜菜水分亏缺复水后的补偿效应进行概括分析。糖分积累期水分亏缺处理中决定第一主成分大小的主要是块根过氧化物酶、块根重量、块根和叶片电导率、叶面积指数和根冠比, 决定第二主成分大小的主要是叶片丙二醛、过氧化氢酶、过氧化物酶、可溶性糖、块根脯氨酸和叶柄重量, 决定第三主成分大小的主要是块根过氧化氢酶和比叶重,表明细胞膜透性、抗氧化酶活性、渗透调节物质以及农艺特性共同调控块根膨大期甜菜抵御干旱逆境胁迫。
3 讨论
根、冠生长是通过冠合成的碳水化合物和根系吸收的水分养分分配调节的, 在根、冠调节过程中水力信号和化学信号协同作用。当土壤水分供应与大气蒸腾需要不相适应时, 作物根、冠关系表现出环境效应, 优先支持供应起限制作用的部分[16]。本研究表明, 块根膨大期 T1和 T2水分处理甜菜叶片均未发生发黄萎蔫现象, T3处理甜菜叶片萎蔫, 并伴有部分老叶边缘发黄干枯。块根膨大期T2和T3控水后块根含糖量产生正补偿效应, 而干物质生长不产生补偿效应, 这可能是植物对干旱的一种生存对策, 土壤水分降低会转变植物体内碳分配的格局, 使碳水化合物更多地流向根部, 少量流向叶片, 有利于植物从土壤中获取更多的水分[17]。由于甜菜耐旱性强的特点, 这种生存策略随着土壤水分的变化而转变。糖分积累期当土壤水分供应充足时, 块根膨大期受旱的块根吸收更多的水分, 甜菜体内碳格局重新分配, 最终块根重量随土壤控水下限降低而升高, 50%田间持水量情况下块根含糖量最高。本研究仅探索了甜菜块根膨大期的控水下限, 在其他生育时期均保证水分充足供应。随着甜菜收购企业“以质论价”步伐的加快和国家对种植业“提质增效”的要求, 如何在块根膨大期控水下限的基础上, 调节糖分积累期的土壤水分, 在保证块根重量的前提下, 进一步提高块根含糖量是需要继续研究的内容。
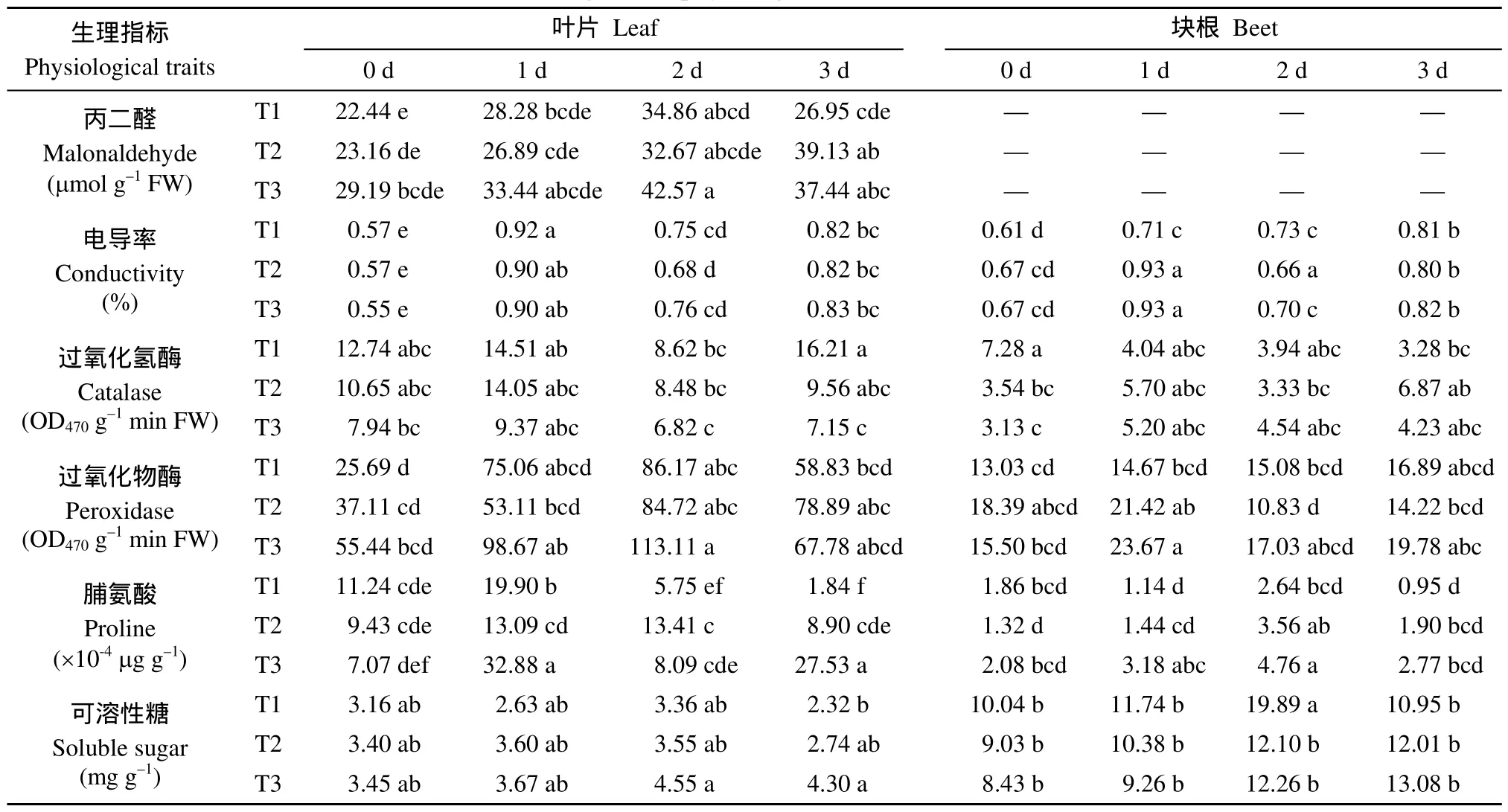
表3 不同水分条件下滴灌甜菜的生理指标Table3 Indices of sugar beet physiological traits in three water conditions

表4 各指标主成分的特征向量及贡献率Table4 Eigen vectors and percentages of accumulated contribution of principal components
水分亏缺可引起作物一系列生理生化特性的变化[18-20],如膜透性、抗氧化酶活性以及渗透调节物质, 复水后生理生化指标亦存在着不同程度的适应性响应。丙二醛和电导率是衡量细胞膜透性的重要指标, 其值越大, 表示电解质的渗漏量越多, 细胞膜受害程度越重[21]。抗氧化防御体系可以清除植株体内过多的活性氧, 而整个抗氧化系统的防御能力是CAT和POD等几种酶共同作用的结果[3]。渗透调节是一种对水分亏缺的响应, 它主要通过细胞积累一些脯氨酸和可溶性糖等有机或无机溶质来调节渗透势。研究表明, 甜菜叶片和块根生理指标反应较为灵敏, 其中块根膨大期T2和T3缺水条件下, 甜菜电导率、脯氨酸以及过氧化物酶活性均在复水 1 d时显著增加。胡义等[22]研究表明香樟幼树经干旱胁迫复水后2 d抗氧化酶系统活性增加, 这与本研究结果不完全一致, 可能与甜菜水分运输距离短, 叶片大而繁茂, 水分运输较快, 从而出现快速反应有关。邵艳军等[23]关于玉米的研究表明, 在重度和深重度干旱下脯氨酸含量均下降, 复水 24 h时脯氨酸含量升高, 复水48 h时脯氨酸含量下降并低于对照, 这与本研究结果一致。而王利彬等[24]关于大豆的研究表明, 干旱胁迫导致叶片游离脯氨酸含量和可溶性糖含量均升高; 复水后, 游离脯氨酸和可溶性糖含量均呈降低趋势, 其中中度胁迫处理产生近等量补偿效应, 而重度胁迫产生部分补偿效应, 这可能与不同作物种类以及同一作物各生育时期对干旱胁迫响应机制有关。
[1] 郝树荣, 郭相平, 王文娟.不同时期水分胁迫对玉米生长的后效性影响.农业工程学报, 2010, 26(7): 71–75
Hao S R, Guo X P, Wang W J.Aftereffects of water stress on corn growth at different stages.Trans CSAE, 2010, 26(7): 71–75 (in Chinese with English abstract)
[2] Campos M K F, Carvalho K, Souza F S, Marur C J, Pereira L F P, Bespalhok F J C, Vieira L G E.Drought tolerance and antioxidant enzymatic activity in transgenic ‘Swingle’ citrumelo plants over-accumulating proline.Environ Exp Bot, 2011, 72: 242–250
[3] Chołuj D, Karwowska M, Ciszewska A, Jasińska M.Influence of long-term drought stress on osmolyte accumulation in sugar beet (Beta vulgaris L.) plants.Acta Physiol Plant, 2008, 30: 679–687
[4] Sarvajeet Singh G, Narendra T.Reactive oxygen species and antioxidant machinery in abiotic stress tolerance in crop plants.Plant Physiol Biochem, 2010, 48: 909–930
[5] Rathinasabapathi B.Metabolic Engineering for stress tolerance: installing osmoprotectant synthesis pathways.Ann Bot, 2000, 86: 709–716
[6] Maroco J P, Pereira J S.Understanding plant responses to drought-from genes to the whole plant.Funct Plant Biol, 2003, 30: 239–264
[7] Javadi T, Arzani K, Ebrahimzadeh H.Study of proline, soluble sugar, and chlorophyll a and b changes in nine Asian and one European pear cultivar under drought stress.Acta Hort, 2008: 241–246
[8] Marcińska I, Czyczyło-Mysza I, Skrzypek E, Filek M, Grzesiak S, Grzesiak M, Janowiak F, Hura T, Dziurka M, Dziurka K, Nowakowska A, Quarrie S.Impact of osmotic stress on physiological and biochemical characteristics in drought-susceptible and drought-resistant wheat genotypes.Acta Physiol Plant, 2013, 35: 451–461
[9] 谢小玉, 马仲炼, 白鹏, 刘晓健.辣椒开花结果期对干旱胁迫的形态与生理响应.生态学报, 2014, 34: 3797–3805
Xie X Y, Ma Z L, Bai P, Liu X J.The morphological and physiological responses of hot pepper (Capsicum annuum L.) to drought stress with different intensity during blossom and fruit period.Acta Ecol Sin, 2014, 34: 3797–3805 (in Chinese with English abstract)
[10] 周磊, 甘毅, 欧晓彬, 王根轩.作物缺水补偿节水的分子生理机制研究进展.中国生态农业学报, 2011, 19: 217–225
Zhou L, Gan Y, Ou X B, Wang G X.Progress in molecular and physiological mechanisms of water-saving by compensation for water deficit of crop and how they relate to crop production.Chin J Eco-Agric, 2011, 19: 217–225 (in Chinese with English abstract)
[11] 郭相平, 康绍忠.玉米调亏灌溉的后效性.农业工程学报, 2000, 16(4): 58–60
Guo X P, Kang S Z.After effect of regulated deficit irrigation (RDI) on maize.Trans CSAE, 2000, 16(4): 58–60 (in Chinese with English abstract)
[12] 韩占江, 于振文, 王东, 王西芝, 许振柱.调亏灌溉对冬小麦耗水特性和水分利用效率的影响.应用生态学报, 2009, 20: 2671–2677
Han Z J, Yu Z W, Wang D, Wang X Z, Xu Z Z.Effects of regulated deficit irrigation on water consumption characteristics and water use efficiency of winter wheat.Chin J Appl Ecol, 2009, 20: 2671–2677 (in Chinese with English abstract)
[13] 李合生.植物生理生化实验原理和技术.北京: 高等教育出版社, 2000
Li H S.Principles and Techniques of Plant Physiological and Biochemical Experiment.Beijing: Higher Education Press, 2000
[14] 张志良, 瞿卫菁.植物生理学实验指导.北京: 高等教育出版社, 2003
Zhang Z L, Qu W J.Experiment Guide of Plant Physiology.Beijing: Higher Education Press, 2003
[15] 王丁, 杨雪, 韩鸿鹏, 张丽琴, 薛建辉.干旱胁迫及复水对刺槐苗水分运输过程的影响.南京林业大学学报(自然科学版), 2015, 39(1): 67–72
Wang D, Yang X, Han H P, Zhang L Q, Xue J H.The impact of drought and rewatering on water transportation process of Robinia pseudoacacia L.seedlings.J Nanjing For Univ, 2015,39(1): 67–72 (in Chinese with English abstract)
[16] 陈晓远, 高志红, 罗远培.植物根冠关系.植物生理学通讯, 2005, 41: 555–562
Chen X Y, Gao Z H, Luo Y P.Relationship between root and shoot of plants.Plant Physiol Commun, 2005, 41: 555–562 (in Chinese with English abstract)
[17] Muller B, Pantin F, Genard M, Turc O, Freixes S, Piques M, Gibon Y.Water deficits uncouple growth from photosynthesis increase C content, and modify the relationship between C and growth in sink organs.J Exp Bot, 2011, 62: 1715–1729
[18] Barcia R A, Pena L B, Zawoznik M S, Benavides M P, Gallego S M.Osmotic adjustment and maintenance of the redox balance in root tissue may be key points to overcome a mild water deficit during the early growth of wheat.Plant Growth Regul, 2014, 74: 107–117
[19] Zhang L C, Zhao G Y, Xia C, Jia J Z, Liu X, Kong X Y.A wheat R2R3MYB gene, TaMYB30-B, improves drought stress tolerance intransgenic Arabidopsis.J Exp Bot, 2012, 63: 5873–5885
[20] 安玉艳, 梁宗锁, 郝文芳.杠柳幼苗对不同强度干旱胁迫的生长与生理响应.生态学报, 2011, 31: 716–725
An Y Y, Liang Z S, Hao W F.Growth and physiological responses of the Periploca sepium Bunge seedlings to drought stress.Acta Ecol Sin, 2011, 31: 716–725 (in Chinese with English abstract)
[21] 薛延丰, 刘兆普.钙离子对盐胁迫下菊芋幼苗生长、生理反应和光和能力的影响理论.农业工程学报, 2006, 22(9): 44–47
Xue Y F, Liu Z P.Effects of calcium ion on growth, physiological responses and photosynthetic ability in salt-stressed Jerusalem artichoke (Helianthus tuberosus L.) seedlings.Trans CSAE, 2006, 22(9): 44–47 (in Chinese with English abstract)
[22] 胡义, 胡庭兴, 陈洪, 王彬, 李晗.干旱胁迫及复水对香樟幼树生理特性及生长的影响.西北植物学报, 2015, 35: 294–301
Hu Y, Hu T X, Chen H, Wang B, Li H.Physiological properties and growth of Cinnamomum camphor saplings under drought stress and rewatering.Acta Bot Boreali-Occident Sin, 2015, 35: 294–301 (in Chinese with English abstract)
[23] 邵艳军, 山仑, 李广敏.干旱胁迫与复水条件下高粱、玉米苗期渗透调节及抗氧化比较研究.中国生态农业学报, 2006, 14(1): 68–70
Shao Y J, Shan L, Li G M.Comparison of osmotic regulation and antioxidation between sorghum and maize seedlings under soil drought stress and water recovering conditions.Chin J Eco-Agric, 2006, 14(1): 68–70 (in Chinese with English abstract)
[24] 王利彬, 祖伟, 董守坤, 刘丽君, 徐亚会, 李雪凝.干旱程度及时期对复水后大豆生长和代谢补偿效应的影响.农业工程学报, 2015(11): 150–156
Wang L B, Zu W, Dong S K, Liu L J, Xu Y H, Li X N.Effects of drought stresses and times on compensation effect after re-watering in soybean.Trans CSAE, 2015(11): 150–156 (in Chinese with English abstract)
Compensation Response of Drip-irrigated Sugar Beets (Beta vulgaris L.) to Different Water Deficits during Storage Root Development
LI Yang-Yang, FEI Cong, CUI Jing, WANG Kai-Yong, MA Fu-Yu*, and FAN Hua*
Agricultural College of Shihezi University / Key Laboratory of Oasis Ecol-Agriculture of Xinjiang Prodution and Construction Group, Shihezi 832000, China
The objective of this experiment was to investigate the compensation response of drip-irrigated sugar beets under drought stress and rewatering during storage root development.The experiment at treatments were field capacity of 70% (T1), 50% (T2), and 30% (T3).The yield, agronomic characteristics, and physical and chemical properties of the beet roots were measured.The sugar yield and technological sugar yield in T3 treatment were 51.7%, 17.6% and 48.7%, 7.7% more than those in T1 and T2 treatments, respectively.At one day after rewatering, electrical conductivity, proline content, POD activity were significantly greater in T2 and T3 treatments than in T3 treatment during storage root development.Principal component analysis showed that a regulation system consisted of membrance permeability, antioxidant enzyme activity, osmotic adjustment and agronomic characteristics resisting drought stress, among which soluble sugar content can not be used as an indicator of drought resistance indentification of sugar beet during the devevelopment of sugar beet storage roots.Therefore, supplemental irrigation should be carried out promptly when the soil water content drops to 30% of field capacity during storage root development, which is beneficial to increase the sugar content and do not affect the growth of sugar beet.
Compensation effect; Water deficit; Sugar beet; drip irrigation
10.3724/SP.J.1006.2016.01727
本文由国家自然科学基金项目(31260299), 教育部科学技术研究重点项目(212201), 新疆生产建设兵团博士基金项目(2014BB012), 国际合作项目(2010DFA32520)和石河子大学杰出青年科技人才培育计划(2015ZRKXJQ03)资助。
This work was supported by the National Natural Science Foundation of China (31260299), the Key Project of Chinese Ministry of Education (212201), Doctoral Program of Higher Education of Xinjiang Production and Construction Corps (2014BB012), the International Cooperation Project (2010DFA32520), and Training Program of Distinguished Young Scientists of Shihezi University (2015ZRKXJQ03).
*通讯作者(Corresponding authors): 马富裕, E-mail: mfy-agr@shzu.edu.cn;樊华, E-mail: fanhua@shzu.edu.cn, Tel: 0993-6650999
联系方式: E-mail: 643831266@qq.com
稿日期): 2016-03-04; Accepted(接受日期): 2016-07-11; Published online(
日期): 2016-08-11.
URL: http://www.cnki.net/kcms/detail/11.1809.S.20160811.1623.018.html

