伊曲康唑抑制小鼠树突状细胞迁移及MMP-2、MMP-3、MMP-12与RANTES的分泌
郑晓丽 梁官钊 史冬梅 沈永年 刘维达 陈官芝
伊曲康唑(itraconazole, ITZ)属三唑类抗真菌药,在临床真菌病治疗中广泛应用。近年研究显示,伊曲康唑存在免疫调节作用,对掌跖脓疱病、扁平苔藓及特应性皮炎等皮肤病存在治疗作用[1-4],机制尚不清楚。树突状细胞(dendritic cells,DCs)是目前已知功能最强的抗原提呈细胞,在免疫应答启动、进展及免疫调控过程中发挥关键作用。DCs参与炎症反应,与趋化因子RANTES等[5]和基质金属蛋白酶(matrix metalloproteinase, MMPs)等[6]表达密切相关,并在肿瘤、感染及皮肤病等病程中扮演重要角色。MMPs能降解细胞外基质蛋白,包括MMP-1~MMP-19,其中MMP-2属于明胶酶类,MMP-3属于基质分解素类,MMP-12属于其他未分类。笔者发现,伊曲康唑可以抑制小鼠DCs RANTES表达和MMP-2、MMP-3和MMP-12分泌,显示伊曲康唑具有免疫调节作用。
1 材料和方法
1.1 材料、药物及仪器 细胞树突状细胞为小鼠骨髓来源单核细胞定向诱导所得。伊曲康唑、脂多糖(lipopolysaccharides, LPS)和二甲基亚砜购于美国Sigma公司。重组小鼠粒-巨噬细胞集落刺激因子(recombinant murine granulocyte-macrophage colony stimulating factor, rmGM-CSF)购于美国Peprotech公司,胎牛血清(fetal bovine serum, FBS)和RPMI1640购于美国Gibco公司,(Sigma,USA); 细胞计数试剂盒(cell counting kit-8, CCK-8)购于上海Yeasen公司;荧光标记抗鼠单克隆抗体CD11c、MHCII、CD40、CD80、CD86、CCR7购于美国eBiosciences公司。Luminex所用试剂盒由BD PharMingen公司提供。所有加伊曲康唑的试验均选用无脂血清进行试验。
1.2 DCs的获取 C57小鼠颈椎脱臼处死,置于75%酒精浸泡3分钟后取出。无菌取出股骨和胫骨,PBS洗涤两次,抽取骨髓,收入15 mL离心管中;1200 rpm离心5 min,弃上清,收集沉淀的骨髓细胞;然后,细胞以2×106个细胞的密度接种于100 mm细菌培养皿,培养皿中含10 mL含10%胎牛血清和20 ng/mL rmGM-CSF的RPMI 1640培养基。在第2天,将10 mL将含20 ng/mL rmGM-CSF RPMI 1640完全培养基加入板中。在第4、6天,收集一半的培养上清液分别离心。细胞沉淀物重新悬浮在10 mL含20 ng/mL rmGM-CSF的新鲜RPMI 1640培养基中,并倒回原板。在第8天,收获DCs用于后面的实验。
1.3 细胞毒性试验 收集培养至第8天的DCs,以每孔2×104个细胞接种于96孔培养板,每孔200 μL RPMI 1640(含10%无脂血清、20 ng/mL rmGM-CSF、1 μg/mL LPS及不同浓度伊曲康唑),伊曲康唑使用浓度为0、0.0625、0.125、0.25、0.5、1、2、4、8、16 μM,处理细胞12、24、48 h后,每孔加入20 μL CCK-8溶液,37℃、5% CO2培养3 h后用酶标仪在450 nm处测吸光度(A)值,每组5个复孔,设置空白对照,实验重复三次。细胞存活率=(处理组细胞A 值-空白组A值)/(正常对照组细胞A -空白组A值)×100%。
1.4 Transwell检测DCs的迁移 取培养至第8天的DCs,用含10%无脂血清、20 ng/mL的rmGM-CSF、1 μg/mL的LPS的RPMI 1640调整细胞浓度至1×106cells/mL,上室加200 μL细胞,下室加500 μL含上述成分的培养基。并分别在上下室加入伊曲康唑,调整其浓度为0.25、0.5和1 μM。4 h 后取出上室,将上室内面用棉签擦净,用95%甲醇固定上室细胞,收下室细胞流式细胞仪计数。上室细胞固定后结晶紫染色,倒置显微镜下观察并拍照。
1.5 Luminex液相芯片技术检测细胞因子 收集培养至第8天的DCs,以每孔1×106的密度接种于12孔板,每孔含1 mL RPMI 1640培养基(含10%无脂血清、20 ng/mL rmGM-CSF、1 μg/mL LPS及0.25、0.5或1 μM伊曲康唑),同时设立对照组,培养12 h后,分别收集上述培养细胞上清;采用Luminex液相芯片技术检测上清液中MMP-2、MMP-3、MMP-8、MMP-12和RANTES的水平,严格按照其操作流程进行检测。
1.6 流式细胞术检测DCs表面分子及CCR7的表达 收集上述处理的各组DCs,制备细胞悬液(1×106cells/mL),流式染色液洗2遍,用100 μL流式染色液重悬后,在Falcon管中加入荧光素标记的CD11c、MHCII、CD40、CD80、CD86 及CCR7单克隆抗体,混匀后室温避光孵育30 min,流式染色液洗涤2次,流式细胞仪分析。同时设阴性对照管。
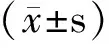
2 结果
2.1 小鼠骨髓单核细胞在体外分化为树突状细胞 小鼠骨髓单核细胞,在rmGM-CSF的诱导下,经过8天的培养和LPS的诱导,细胞体积增大,细胞呈半悬浮生长,表面有树枝状突起(见图1a)。培养至第8天的DCs, CD11c 表达量高(图1b),说明骨髓来源单核细胞大部分已经诱导分化为DCs。
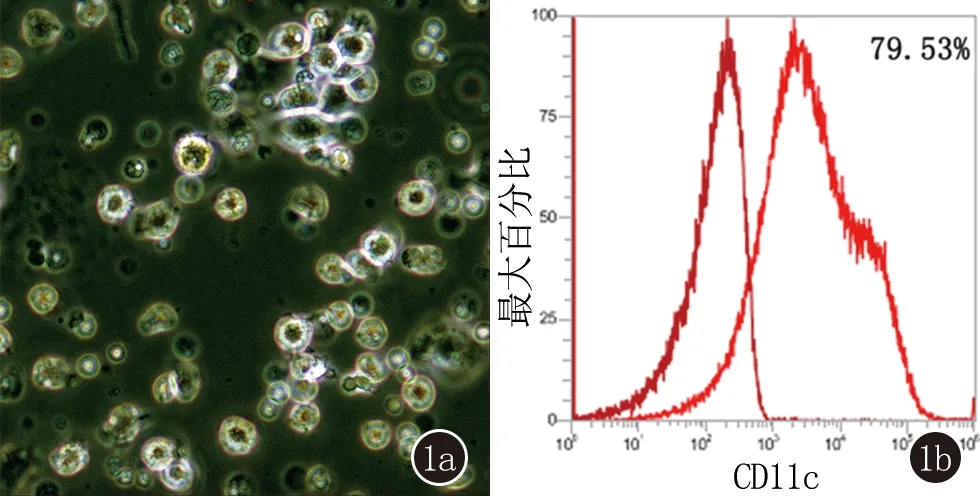
图1 a:培养至第8天的树突状细胞表面有树枝状突起(200×);b:流式细胞仪检测细胞表面CD11c的表达
2.2 伊曲康唑对DCs活力的影响 CCK-8 法检测DCs生长抑制率,结果显示在高浓度时伊曲康唑能明显抑制DCs的生长(P<0.05),伊曲康唑对DCs的生长抑制作用呈时间和剂量依赖性,但在浓度<2 μM)时,其对细胞的抑制率增强不明显,见图2。 然而当伊曲康唑浓度大于2 μM时,在孵育12 h后,伊曲康唑即对DCs显示出明显抑制作用。为了排除因细胞活力受影响造成的阳性结果,我们选用了安全范围之内的0.25、0.5和1 μM相互作用12 h用于后续实验。1 μM 12 h时细胞存活率为(92.33±13.80)%,与对照组相比,细胞活力无明显差异。而我们使用的最高浓度1 μM与临床用量200 mg,一日两次所达到的血药浓度值相当。
2.3 Transwell检测伊曲康唑抑制了DCs的迁移 如图3a所示,流式细胞仪计数显示伊曲康唑抑制了DCs的迁移。倒置显微镜下拍照亦显示随着伊曲康唑浓度的升高,迁移的细胞数减少(图3b)。与对照组相比,伊曲康唑浓度为0.5 μM时,迁移到下室的细胞比例为(1.44±0.16)%,浓度为1 μM时,迁移到下室的细胞比例为(1.42±0.13)%,与对照组(1.85±0.13)%相比,差异有显著意义(图4,P<0.05)。
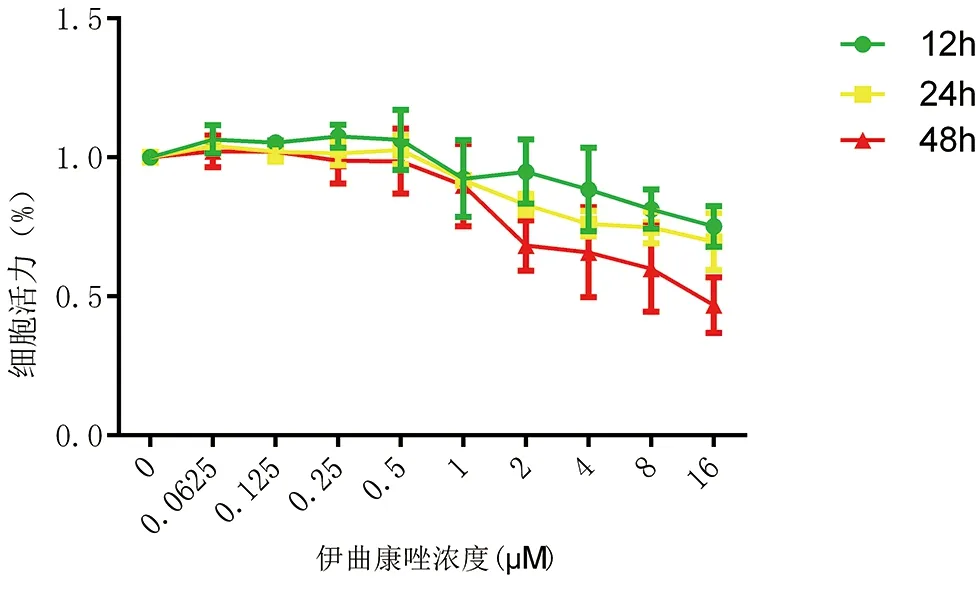
图2 伊曲康唑对树突状细胞活力的影响
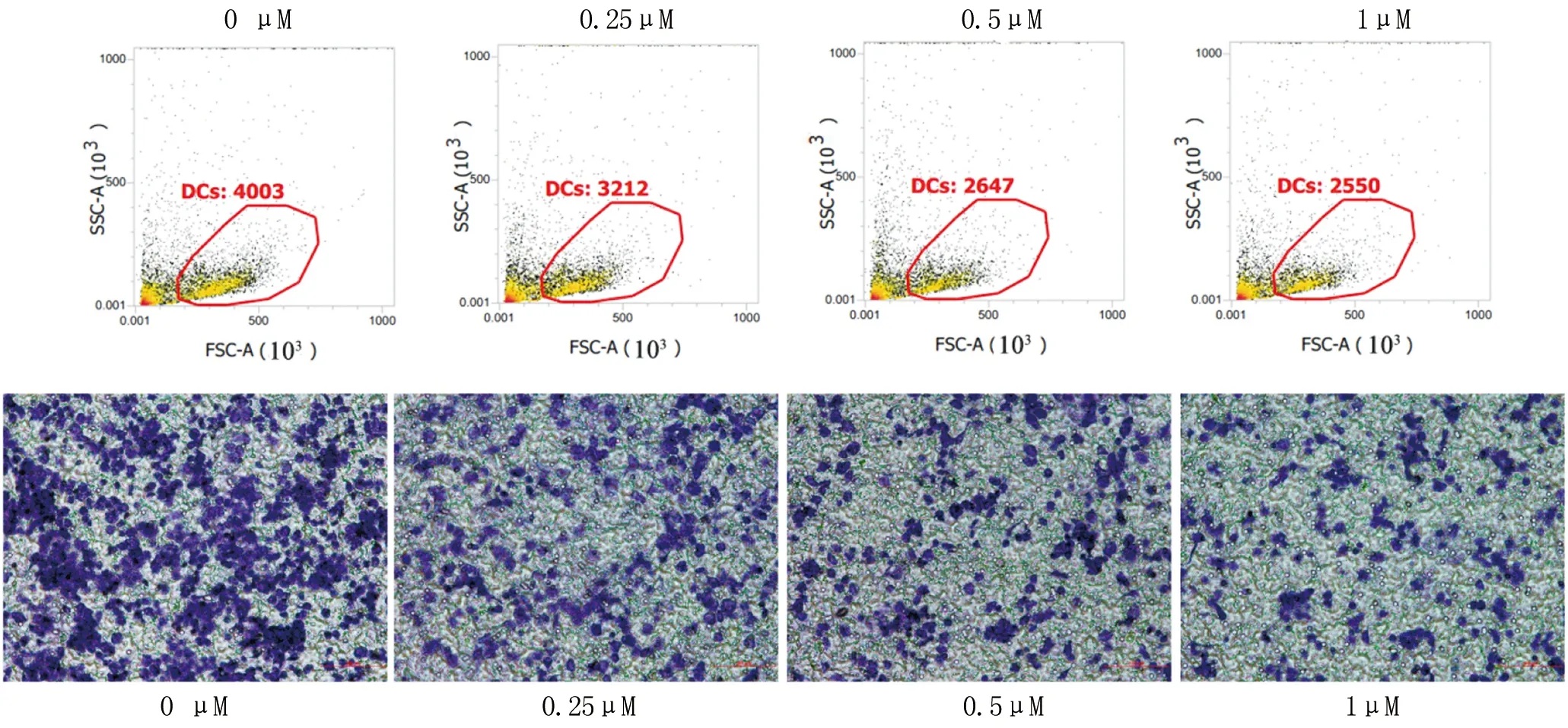
图3 伊曲康唑对树突状细胞迁移的影响 a:流式细胞仪检测下室迁移的细胞数;b:倒置显微镜下拍照上室外侧面迁移的细胞数(100×)
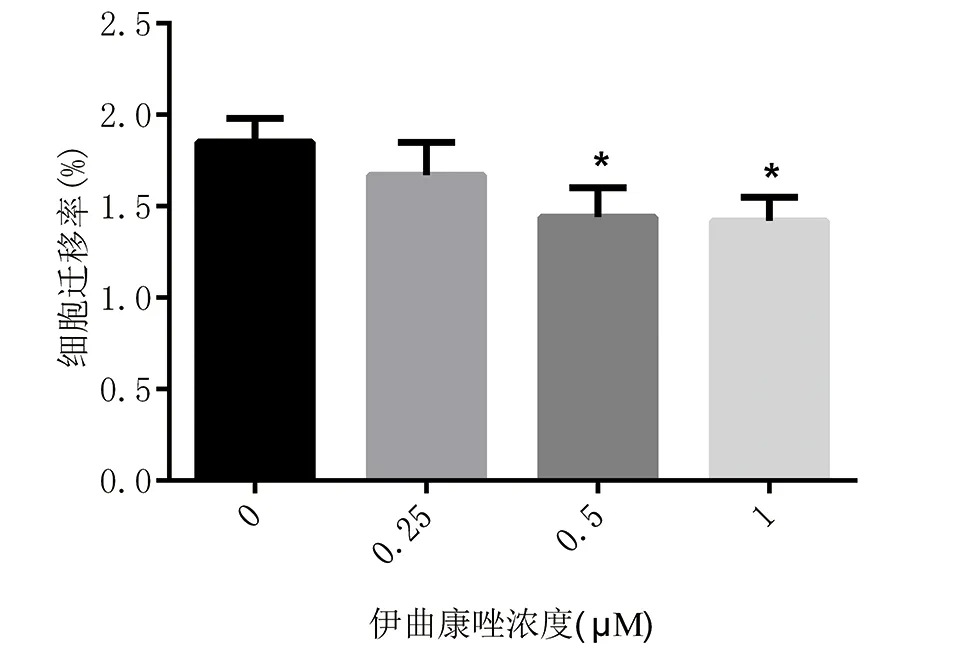
图4 流式细胞仪计数迁移细胞数百分比统计图表(*P<0.05)
2.4 伊曲康唑抑制了MMP-2、MMP-3、MMP-12和RANTES 的分泌,对MMP-8 的分泌无明显影响 如图5所示,在伊曲康唑浓度为0.25 μM时,MMP-2的分泌量为(351.89±8.54)pg/mL;浓度为0.5 μM时,为(340.415±24.77)pg/mL;浓度为1 μM时,为(325.6±6.49) pg/mL,对照组为(400.20±4.86)pg/mL,均P<0.05。对MMP-3的分泌,当在伊曲康唑浓度为0.25 μM时,MMP-3的分泌量为(112.135±10.975)pg/mL;浓度为0.5 μM时,为(110.23±10.79)pg/mL;浓度为1 μM时,为(90.49±0.63)pg/mL,对照组为(161.9525±13.2575) pg/mL,均P<0.05。对MMP-12的分泌,当在伊曲康唑浓度为0.25 μM时,MMP-12的分泌量为(12712±19.80)pg/mL;浓度为0.5 μM时,为(12903±250.32)pg/mL;浓度为1 μM时,为(12512.5±311.83)pg/mL,对照组为(13695.5±147.79)pg/mL,均P<0.05。
对RANTES的分泌,当在伊曲康唑浓度为0.25 μM时,RANTES的分泌量为(888.49±77.53)pg/mL;浓度为0.5 μM时,为(937.34±74.16)pg/mL;浓度为1 μM时,为(794.58±33.38)pg/mL,对照组为(1120.5±55.11)pg/mL,均P<0.05。
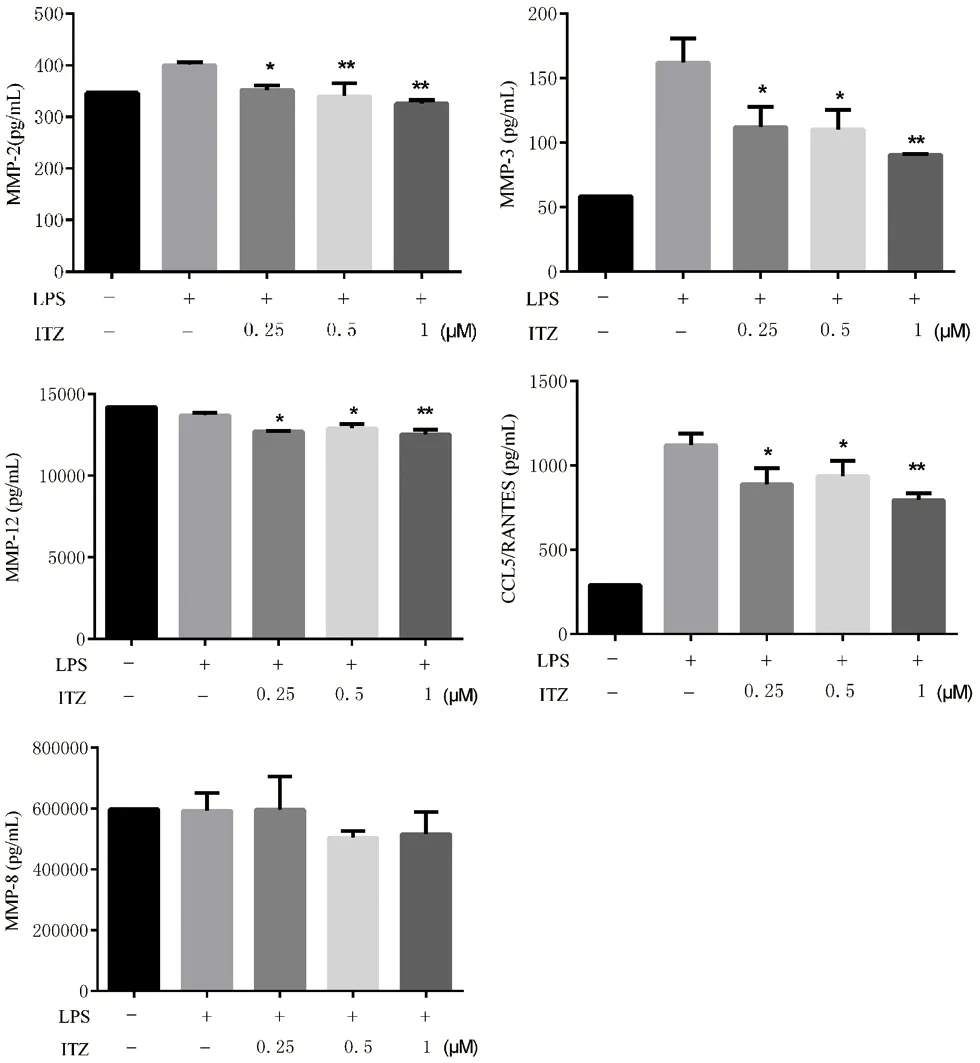
图5 伊曲康唑对MMP2、MMP3、MMP12、RANTES、MMP8分泌的影响(*P<0.05,**P<0.01)
2.5 伊曲康唑对DCs表面分子和CCR7的表达的影响 伊曲康唑处理组与对照组间CD11c、MHCII、CD40、CD80、CD86的表达未见显著差异(P>0.05,数据未示)。对CCR7的表达,如图6所示,当伊曲康唑浓度为1 μM时,CCR7的表达量为(16.77±5.35)%,浓度为0.5 μM时,CCR7的表达量为(14.2±2.52)%,与对照组(14.4±3.73)%相比,差异均无显著意义。
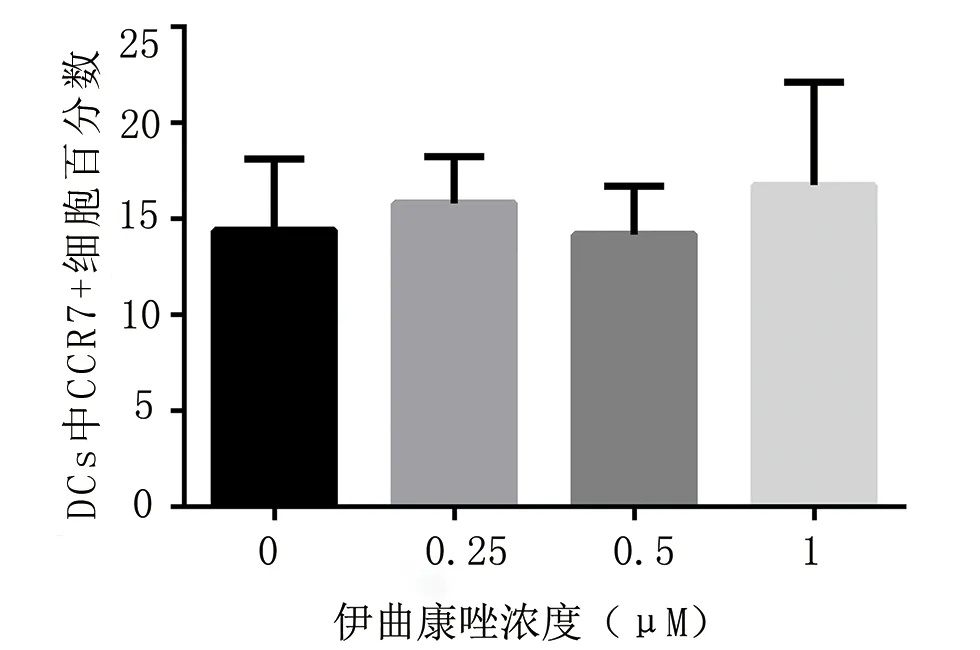
图6 伊曲康唑对树突状细胞CCR7表达的影响(P>0.05)
3 讨论
DCs是体内功能最强大的抗原提呈细胞,它能够显著刺激初始T细胞增殖。未成熟DCs进入外周组织后具有较强的抗原摄取和处理功能,成熟的DCs具有较强的抗原提呈功能并调节Th1/Th2平衡,与感染和免疫性疾病(银屑病等)的发生、发展、治疗和转归密切相关[7]。
RANTES是CC型趋化因子,可由血小板和树突状细胞等分泌,主要作用于T淋巴细胞,使其趋化至皮肤中并将其活化,其还可趋化嗜酸粒细胞、人单核细胞等[8]。RANTES在银屑病和特应性等慢性炎症性疾病发生发展及过敏性疾病中扮演重要角色,银屑病患者皮损处RANTES较非皮损区及正常皮肤高,其可引起皮损T淋巴细胞活化及聚集[9]。David等研究发现银屑病患者治疗后外周血RANTES水平较对照组明显降低。并且,特应性皮炎患者皮肤中RANTES表达升高[10]。
MMPs能够降解细胞外基质、参与新生血管形成、调节细胞黏附、激活潜在活性蛋白。MMP-2、MMP-3和MMP-12参与基质主要成分IV型胶原的降解,对血管生成及细胞微环境调节具有重要意义[11,12]。国内研究显示,寻常型银屑病患者治疗后,血清中MMP-2水平降低[13-15]。Glazewska等[16]发现NB-UVB治疗银屑病,症状缓解后血清MMP-2水平随之降低。Sawa等[17]应用MMP-2抑制剂治疗银屑病有较好疗效, 说明MMP-2是抗银屑病药的药物靶位之一。 MMP-3破坏基底膜及血管壁的完整性使炎性细胞得以进入表皮,后者再与角质形成细胞相互作用,促发了其他的病理改变,这可能在银屑病的发病早期起着一定的作用[18,19]。MMP-12可由巨噬细胞和树突状细胞分泌,在MMP-2和MMP-3的激活过程中起重要作用[20],与银屑病皮损真皮乳头层免疫细胞的浸润相关[21],且皮损部位MMP-12 mRNA表达水平显著高于非皮损部位[22]。本研究发现,伊曲康唑显著抑制了树突状细胞MMP-2、MMP-3和MMP-12的表达,这可能揭示了其部分免疫调节机制。
伊曲康唑抑制小鼠树突状细胞的迁移和MMP-2、MMP-3、MMP-12及RANTES的表达,可能为其免疫调控作用机制之一。然而,我们另有实验发现伊曲康唑可以增强巨噬细胞对白念珠菌的吞噬作用及抗感染免疫能力。我们初步认为,伊曲康唑的免疫调节作用存在疾病特异性,即在不同性质免疫细胞主导的疾病中其发挥的作用可能有差异,然而更深入的机制尚待探讨。
[1] V’Lckova-Laskoska MT, Caca-Biljanovska NG, Laskoski DS, et al. Palmoplantar pustulosis treated with itraconazole: a single, active-arm pilot study[J]. Dermatol Ther,2009,22(1):85-89.
[2] Libow LF, Coots NV. Treatment of lichen planus and lichen nitidus with itraconazole: reports of six cases[J]. Cutis,1998,62(5):247-248.
[3] Abbas Z, Ghodsi SZ, Abedeni R. Effect of itraconazole on the quality of life in patients with moderate to severe seborrheic dermatitis: a randomized, placebo-controlled trial[J]. Dermatol Prac Concept,2016,6(3):11-16.
[4] Brouwers KJ, Vis R, Tupker RA. Itraconazole as a continuous treatment for atopic dermatitis? A case report[J]. J Eur Acad Dermatol Venereol,2016,30(5):873-874.
[5] Verzura J, Ponce L, Pernia M, et al. Effect of leishmania mexicana, Rantes and TNF alpha on splenic dendritic cells of newborn and adult BALB/c mice: phenotypic characteristics and migratory properties[J]. Invest Clin,2012,53(3):237-249.
[6] Hubel J, Hieronymus T. HGF/Met-Signaling contributes to immune regulation by modulating tolerogenic and motogenic properties of dendritic cells[J]. Biomedicines,2015,3(1):138-148.
[7] Qian C, Cao X. Dendritic cells in the regulation of immunity and inflammation[J]. Semin Immunol,2018,35:3-11.
[8] Zhu K, Shen Q, Ulrich M, et al. Human monocyte-derived dendritic cells expressing both chemotactic cytokines IL-8, MCP-1, RANTES and their receptors, and their selective migration to these chemokines[J]. Chin Med J,2000,113(12):1124-1128.
[9] 唐玲,李泉,陈洁,等. RANTES在银屑病患者角质形成细胞中的表达及其作用[J]. 中国麻风皮肤病杂志,2003,19(5):426-427.
[10] Giustizieri ML, Mascia F, Frezzolini A, et al. Keratinocytes from patients with atopic dermatitis and psoriasis show a distinct chemokine production profile in response to T cell-derived cytokines[J]. J Allergy Clin Immunol,2001,107(5):871-877.
[11] Mezentsev A, Nikolaev A, Bruskin S. Matrix metalloproteinases and their role in psoriasis[J]. Gene,2014,540(1):1-10.
[12] Stanciute D, Didziapetriene J, Kadziauskas J. Expression of matrix metalloproteinases in patients with malignant tumors[J]. Medicina (Kaunas),2004,40(12):1143-1150.
[13] 裘宇光. 银屑病患者基质金属蛋白酶-2与基质金属蛋白酶-9的检测价值[J]. 浙江中西医结合杂志,2010,20(11):671-672.
[14] 肖嵘,严开林,黄晋华,等. 基质金属蛋白酶在银屑病患者皮损中的表达[J]. 中华皮肤科杂志,2004,37(10):611-612.
[15] 何秋波,李红文,于建斌. 银屑病患者皮损中血管内皮生长因子和基质金属蛋白酶2的表达[J]. 中华皮肤科杂志,2004,37(7): 398-399.
[16] Glazewska EK, Niczyporuk M, Lawicki S, et al. Therapy of psoriasis with narrowband ultraviolet-B light influences plasma concentrations of MMP-2 and TIMP-2 in patients[J]. Ther Clin Risk Manag,2016,12:1579-1585.
[17] Sawa M, Tsukam oto T, k iyoi T, et al. New strategy for antedrug application: development of metalloproteinase inhibitors as antipsoriatic drugs[J]. J Med Chem,2002,45 (4):930 -936.
[18] McCawley LJ, Matrisian LM. Matrix metalloproteinases: they’re not just for matrix anymore![J]. Curr Opin Cell Biol,2001,13(5):534-540.
[19] Chandran V, Cook RJ, Edwin J, et al. Soluble biomarkers differentiate patients with psoriatic arthritis from those with psoriasis without arthritis[J]. Rheumatology, 2010,49(7):1399-1405.
[20] Matsumoto S, Kobayashi T, Katoh M, et al. Expression and localization of matrix metalloproteinase-12 in the aorta of cholesterol-fed rabbits: relationship to lesion development[J]. Am J Pathol,1998,153(1):109-119.
[21] Suomela S, Kariniemi AL, Snellman E, et al. Metalloelastase (MMP-12) and 92-kDa gelatinase (MMP-9) as well as their inhibitors, TIMP-1 and -3, are expressed in psoriatic lesions[J]. Exp Dermatol,2001,10(3):175-183.
[22] Starodubtseva NL, Sobolev VV, Soboleva AG, et al. Expression of genes for metalloproteinases (MMP-1, MMP-2, MMP-9, and MMP-12) associated with psoriasis[J]. Genetika,2011,47(9):1254-1261.

