不同抗真菌药物诱导白假丝酵母菌L型的实验研究
高张晋,王方坤,尹 洁,王 丽,杨雄斌,杨小琴,郭利军*
(1.大理大学公共卫生学院,云南大理 671000;2.大理大学临床医学院,云南大理 671000)
L型菌是一类细胞壁缺失或缺陷的细菌变异株,因1935年在Lister研究院首次被发现而得名,目前在大多数细菌、螺旋体和真菌中都发现L型的存在,L型菌的形成与长期大量使用抗菌药物有关〔1〕。一般认为破坏细菌细胞壁合成的抗菌药物可诱导细菌转变为L型,但有研究表明,喹诺酮类抗菌药物左氧氟沙星也能诱导出大肠埃希菌和痢疾志贺菌的L型,而喹诺酮类是抑制细菌DNA螺旋酶的抗菌药物〔2〕,说明不只作用于细胞壁的抗菌药物能导致L型菌的产生。目前常用抗真菌药物唑类、多烯类和核苷类都不是作用于真菌细胞壁产生杀菌或抑菌作用。有学者报道,曾从患病者体液中分离出念珠菌的L型,用两性霉素B、酮康唑、氟康唑等抗真菌药物可诱导念珠菌和隐球菌细胞壁缺损而形成L型菌〔3-11〕。但国内对真菌L型的报道较少,迄今为止尚无对诱导真菌L型形成的药物剂量、作用时间的研究,L型真菌的形态改变亦不明确。为此我们拟采用氟康唑、两性霉素B、氟胞嘧啶作为诱导剂,以期在实验条件下诱导出白假丝酵母菌L型,探讨抗真菌药物在白假丝酵母菌L型形成过程中可能的作用。
1 材料和方法
1.1 材料
1.1.1 菌种 白假丝酵母菌TCC10231,由大理大学病原生物学综合实验室提供。
1.1.2 药物 氟康唑(fluconazole,FCZ)、氟胞嘧啶(fluorocytosine,5-FC)和可溶性两性霉素B(ampho⁃tericin B,AmB)均购自北京索莱宝科技有限公司,批号分别为20151127、20160509、319A0529。氟胞嘧啶和可溶性两性霉素B用双蒸水溶解,氟康唑用二甲基甲酰胺(dimethylformamide,DMF)溶解,储存液均配成1 280 μg∕mL,过滤除菌,分装于1.5 mL小离心管,-20℃保存备用。
1.1.3 培养基 高渗液体培养基按文献〔12〕中方法稍加改进:含0.25%NaCl、0.5%葡萄糖、0.1%硫乙醇酸钠、1%蛋白胨、0.5%酵母粉、0.5%牛肉浸膏、0.05%L-胱氨酸、20%蔗糖、10%猪血浆。高渗固体培养基:在上述基础上加1%琼脂。沙保氏琼脂培养基(杭州天和微生物试剂有限公司,批号140110)。上述培养基分别用蒸馏水溶解后,进行高压蒸汽灭菌,固体培养基制成平板,4℃保存备用。
1.1.4 细胞壁染色液 按文献〔12〕中改良方法配制:10%鞣酸水溶液,5%结晶紫水溶液,5%刚果红水溶液。
1.2 诱导方法 参照美国国家临床实验室标准化委员会(National Committee for Clinical Laboratory Standard,NCCLS)推荐的酵母菌液基稀释法真菌药敏试验参考方案〔13〕,在此基础上将RPMI-1640培养基替换为高渗液体培养基,并按一定方案添加抗真菌药物,具体如下。
1.2.1 药物稀释 采用对倍稀释法用高渗液体培养基稀释药物储存液,氟康唑从160 μg∕mL至2.5 μg∕mL,两性霉素B从80 μg∕mL至1.25 μg∕mL,氟胞嘧啶从640 μg∕mL至10 μg∕mL,均为7个稀释度,分装于12 mm×75 mm无菌玻璃试管,每管含0.1 mL抗真菌药物,每种药物均设生长(无药)对照及空白(阴性)对照。
1.2.2 菌液接种 白假丝酵母菌菌种经沙保氏琼脂培养基传代培养2次以上,以激活菌种,挑取3~4个菌落用生理盐水制成菌悬液,调整浊度为0.5麦氏单位,再用高渗液体培养基将此菌悬液稀释2 000倍(接种菌液浓度约为0.5×103~2.5×103CFU∕mL),在上述含药试管中各加入0.9 mL菌液。
1.2.3 培养观察 将接种后的试管置于35℃的恒温培养箱,每24 h参照药物稀释过程继续加入0.1 mL的对应抗真菌药物,培养24 h立即读取每种药物最低抑菌浓度(minimum inhibitory concentration,MIC),并每天对试管中培养物进行涂片,观察白假丝酵母菌细胞壁形态变化情况。
1.3 结果判定
1.3.1 MIC判定 因相较于RPMI-1640培养基,高渗液体培养基中营养更丰富,故以24 h为判定终点。与生长对照管对比,氟康唑以80%抑制生长,两性霉素B和氟胞嘧啶以完全不生长的最低药物浓度作为MIC。
1.3.2 L型判定 每天涂片进行细胞壁染色,在油镜下观察。当观察到白假丝酵母菌染色异常或细胞壁不同程度缺损时且能通过0.8 μm孔径的无菌滤器生长判定为其L型,必要时接种高渗平板分离观察或进行返祖试验。
2 结果与分析
2.1 氟康唑诱导结果 白假丝酵母菌在氟康唑诱导4 d后,在药物浓度为2 μg∕mL的管中出现细胞壁不同程度缺损改变(图1a)或菌体完全深染、皱缩(图1b),此时经0.8 μm滤器过滤未见生长,若继续诱导至第6天,则过滤后有菌生长,涂片后仍可见细胞壁缺损、菌体深染及皱缩的白假丝酵母菌,其余各管在第7天时全部过滤均未见生长。此现象表明白假丝酵母菌细胞壁在早期出现异常改变时,滤过率或滤过后存活率低,当白假丝酵母菌细胞壁改变到一定程度可通过0.8 μm的滤器并生长,在第4天观察到白假丝酵母菌细胞壁形态异常时将其转种至高渗固体平板继续培养24 h,发现部分菌细胞壁缺损严重,呈“凹坑状”(图1c)。
2.2 两性霉素B和氟胞嘧啶诱导结果 与氟康唑诱导结果相似,两性霉素B诱导4 d后,可在药物浓度0.5 μg∕mL的管中观察到细胞壁轻微缺损的白假丝酵母菌(图1d),继续诱导至第6天时能通过0.8 μm的滤器生长,涂片细胞壁染色见大部分白假丝酵母菌细胞壁完整,说明在抗真菌药物抑菌作用减缩或消失后,白假丝酵母菌L型能快速恢复至正常;白假丝酵母菌在氟胞嘧啶诱导1 d后,肉眼可见各管中菌量随药物浓度升高而减少,诱导至第2天肉眼可见各管中菌量与生长对照管无明显差别,说明白假丝酵母菌对氟胞嘧啶耐受较强,氟胞嘧啶对白假丝酵母菌的抑菌作用较差,连续诱导7 d未观察到白假丝酵母菌细胞壁形态异常改变,过滤各管中培养物均无生长。
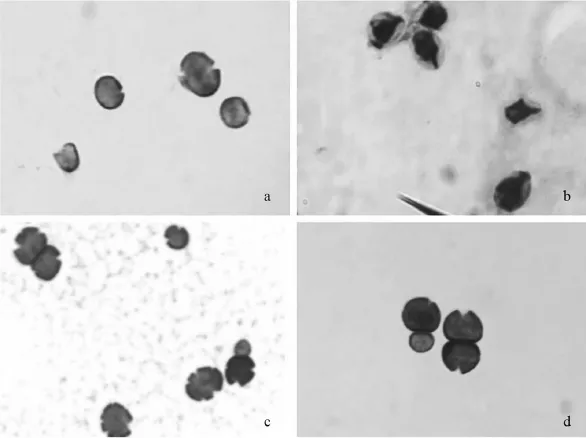
图1 氟康唑和两性霉素B诱导的白假丝酵母菌L型(细胞壁染色,10×100)
2.3 不同药物的MIC及诱导出L型菌的剂量和时间分析 不同抗真菌药物分别诱导白假丝酵母菌24 h后,测定各药物对白假丝酵母菌的MIC。氟康唑的MIC为8 μg∕mL,两性霉素B的MIC为4 μg∕mL,氟胞嘧啶的MIC为64 μg∕mL。将MIC和诱导情况综合分析发现,氟康唑和两性霉素B连续诱导4 d,在MIC之后2~3个对倍浓度的管中均发现细胞壁不同程度缺损或染色异常的白假丝酵母菌,继续诱导2 d后,可通过0.8 μm的滤器生长;氟胞嘧啶在实验浓度下诱导7 d未观察到细胞壁形态异常改变的白假丝酵母菌,过滤后无生长,见表1。除氟胞嘧啶外,氟康唑和两性霉素B均能诱导出白假丝酵母菌L型,且诱导出白假丝酵母菌L型的药物浓度在MIC之后某个浓度附近,说明在临床治疗白假丝酵母菌病时也可能存在其L型,从而对临床检验和治疗产生干扰。
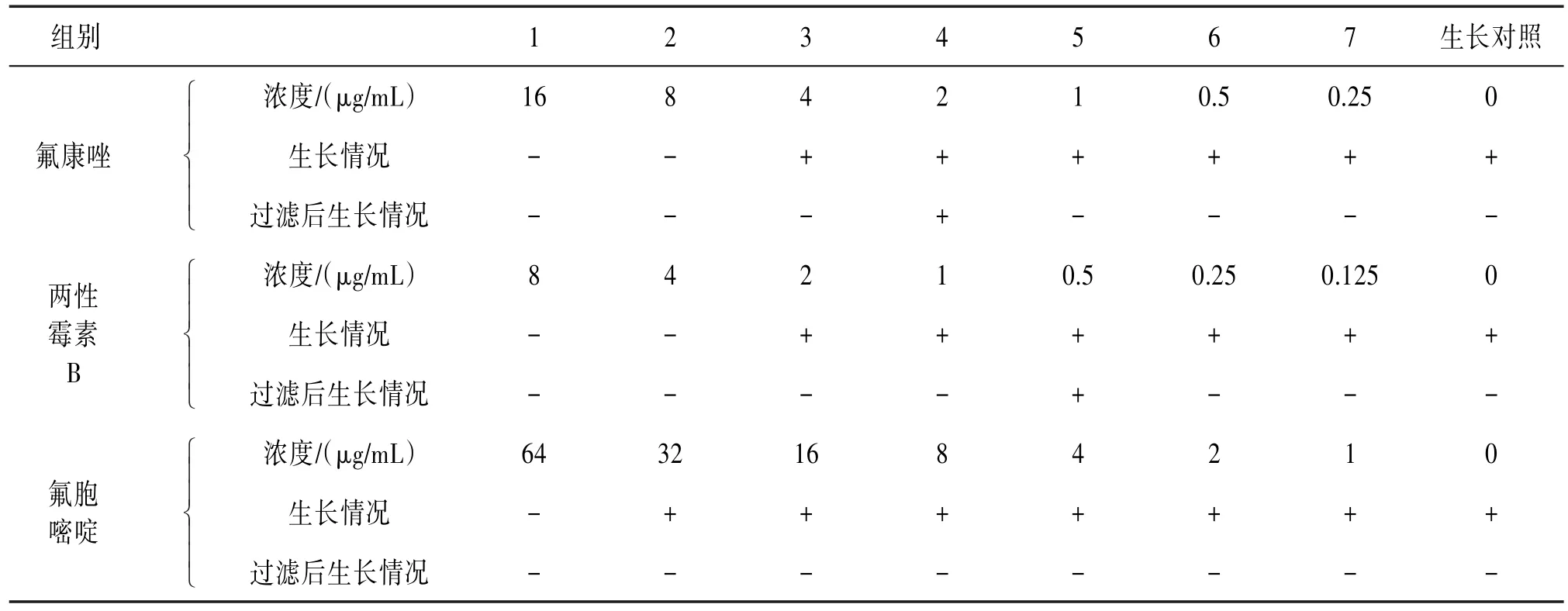
表1 不同抗真菌药物诱导情况
3 讨论
白假丝酵母菌属于条件致病菌,在机体免疫力降低时,可引起皮肤黏膜及内脏器官的感染,尤其对AIDS、结核病等免疫力低下患者威胁更大,是临床上感染率和致死率极高的一种真菌〔14〕。由于抗真菌药物的长期反复治疗,易产生快速耐药性,给临床治疗白假丝酵母菌病增加了难度。因此,研究抗真菌药物的潜在作用靶点及白假丝酵母菌的耐药机制成为当前研究热点〔15〕。目前常用的抗真菌药物中,氟康唑能影响真菌细胞膜麦角固醇合成的关键酶,阻止麦角固醇的生物合成,两性霉素B能直接与细胞膜上的麦角固醇结合,二者均以导致真菌细胞膜通透性增加,细胞膜完整性被破坏而产生抗真菌作用;氟胞嘧啶则是通过进入细胞内,干扰嘧啶碱基的代谢,抑制真菌核酸的合成而产生抗真菌作用〔16〕。但有学者认为,两性霉素B对真菌细胞壁合成具有限速作用,能导致真菌细胞壁产生适应性改变而产生耐药性〔17〕。氟康唑能导致念珠菌因细胞壁损伤而膨胀变形,蔡善民等在电镜下观察到氟康唑注射液能导致几种不同念珠菌细胞壁缺损、扭曲及塌陷变形〔18〕。本研究采用氟康唑、两性霉素B和氟胞嘧啶3种不同作用机制的抗真菌药物,在NCCLS推荐的酵母菌液基稀释法药敏试验的基础上,通过模拟临床给药周期连续给药,在油镜下观察对白假丝酵母菌细胞壁结构产生的影响,结果显示,氟康唑和两性霉素B均能影响白假丝酵母菌细胞壁的完整性,油镜下观察到细胞壁缺损、菌体深染或皱缩,并能通过0.8 μm的滤器继续生长繁殖;氟胞嘧啶在同样条件下未能诱导出。由于氟康唑和两性霉素B均作用于真菌细胞膜,氟胞嘧啶作用于真菌核质,因此白假丝酵母菌L型产生可能是抗真菌药物导致真菌细胞膜损伤后间接影响其细胞壁的生物合成,从而导致真菌细胞壁完整性被破坏。
文献表明〔19〕,真菌受抗真菌药物、人体内溶菌酶或其他因素的作用,能形成与细菌L型相似的缺壁型,真菌的缺壁型仍具有生命力和一定的致病性,在影响因素消除后,能快速恢复,当其细胞壁缺损严重时,菌体易发生变形,可通过0.8 μm的滤器。但对抗真菌药物诱导真菌形成L型的剂量和时间条件并未深入研究,有关真菌L型存在形态的图像资料也有局限性。因此,本研究利用改良细胞壁染色法,在油镜下观察不同药物浓度和时间条件下抗真菌药物诱导白假丝酵母菌形成L型的形态改变情况,发现氟康唑和两性霉素B分别作用4 d后,能在最低抑菌浓度之后2个对倍浓度观察到细胞壁呈明显缺损的白假丝酵母菌L型,主要表现为“凹坑状”、菌体深染或皱缩。据马晟利等〔20〕报道,血链球菌细菌素作用念珠菌24 h可导致念珠菌细胞膜通透性和菌体细胞超微结构发生改变,电镜下可见菌体细胞皱缩,质壁分离,菌体细胞膜及细胞壁凹坑状缺损,细胞壁及细胞膜连续性破坏或断裂等不同形态改变。本实验在油镜下的观察结果与之相似,尽管血链素抑菌机制还未完全阐明,但现阶段研究表明,血链素和氟康唑、两性霉素B等抗真菌药均能促使白假丝酵母菌细胞膜通透性改变,导致细胞壁形态变化,形成L型菌。
本研究还发现,虽然在特定药物浓度和时间条件下,白假丝酵母菌细胞壁可发生不同程度的缺失,但仍然能通过自身修复繁殖。将白假丝酵母菌L型转种到高渗固体平板或沙保氏琼脂培养基,大部分白假丝酵母菌均能恢复完整细胞壁,经0.8 μm的滤器过滤后观察生长的白假丝酵母菌L型,仅能在较少视野中发现,大部分念珠菌细胞壁结构完整。白假丝酵母菌的L型可能是抗真菌药持续作用时,少数白假丝酵母菌与抗真菌药物之间形成的一种暂时平衡状态,当药物作用减弱或消失后便能迅速恢复完整的细胞壁,可能在此平衡状态白假丝酵母菌能较好耐受抗真菌药物而不被杀死,对其具体作用机制还需要进一步实验研究。
〔1〕张群智,周惠平.L型菌的培养、药敏与其所致感染性疾病的研究进展〔J〕.大理学院学报,2003,2(1):82-84.
〔2〕尹秀华,王丽波,陶梅花,等.常用抗菌药物对常见致病菌L型诱导的实验研究〔J〕.大理学院学报,2015,14(2):21-23.
〔3〕朱德全,段新美,王中琰.血和脑脊液同时分离出L型克柔氏念珠菌2例〔J〕.上海医学检验杂志,1994,9(3):157.
〔4〕张杨,张效正,李霞,等.热带念珠菌L型的分离与鉴定〔J〕.微生物学通报,1995,22(2):86-87.
〔5〕董海新,丛鑫.克柔念珠菌L型引起急性肾盂肾炎一例〔J〕.上海医学检验杂志,1997,12(4):217.
〔6〕张元和.白色念珠菌L型的诱导初步探讨〔J〕.临床检验杂志,1989,7(1):18.
〔7〕张宏,黄谷良,林特夫,等.新型隐球菌L型的诱导与形态学观察〔J〕.蚌埠医学院学报,1989,14(4):231-235.
〔8〕张宏,黄谷良,林特夫,等.新生隐球菌L型致病性的实验研究〔J〕.中华皮肤科杂志,1995,28(3):158-160.
〔9〕张宏,黄谷良,林特夫,等.新生隐球菌L型生物学性状研究〔J〕.中国人兽共患病学报,2006,22(1):36-38.
〔10〕苍金荣,任健康,王华,等.唑类抗真菌药物诱导白色念珠菌L型的实验研究〔J〕.现代检验医学杂志,2006,21(5):42-43.
〔11〕席丽艳,郭宁如,沈永年,等.白念珠菌L型研究初报〔J〕.中国医学科学院学报,1992,14(4):305-309.
〔12〕王梅竹,王和.细胞壁染色法的改良及真菌细胞壁染色观察〔J〕.贵阳医学院学报,2004,29(5):460-461.
〔13〕陈兆芳,武有聪,白丽.体外酵母样真菌药物敏感性试验方法研究进展〔J〕.医学综述,2009,15(12):1873-1875.
〔14〕CRUNKHORN S.Fungal infection:Protecting from Candi⁃da albicans.〔J〕.Nat Rev Drug Discov,2016,15(9):604.
〔15〕姜远英,刘伟,曹永兵.念珠菌的耐药机制及应对策略研究〔J〕.中国真菌学杂志,2011,6(4):193-198.
〔16〕谢海伟,杨贤松,吕超田,等.抗真菌药物及其作用机制研究〔J〕.中国微生态学杂志,2015,27(12):1477-1479.
〔17〕杨芳,申元英.抗真菌药物耐药机制的研究进展〔J〕.中华医院感染学杂志,2015,25(18):4317-4320.
〔18〕蔡善民,陈文列,钟秀容.国产氟康唑对念珠菌药物作用的超微结构研究〔J〕.电子显微学报,2007,26(3):217-220.
〔19〕张元和,张宏,黄谷良.真菌的L型〔J〕.中国微生态学杂志,1990,2(4):77-79.
〔20〕马晟利,赵英男,夏雪,等.血链球菌细菌素对念珠菌菌体细胞膜通透性及超微结构的影响〔J〕.口腔医学研究,2014,30(1):21-26.

