白树毒素融合蛋白的筛选及其抗肿瘤作用和凋亡途径研究
翟逸舟 卢美雅 赵健 王富军,3
(1. 华东理工大学生物反应器工程重点实验室,上海 200237;2. 浙江日升昌药业有限公司,东阳 322100;3. 上海中医药大学中药研究所,上海 201203)
核糖体失活蛋白是一类存在于高等植物体内的具有抗肿瘤活性的蛋白,如天花粉蛋白、苦瓜蛋白、白树毒素[1-3]。其能对真核28S核糖体RNA的sarcin/ricin结构域的特定位置(A-4324)的腺嘌呤核糖糖苷键切割,导致不可逆的核糖体失活[4]。白树毒素(Gelonin)是一种来源于东亚热带森林中大戟科植物Gelonium muhiflorum种子中的蛋白,其分子量约为30 kD,属于I型核糖体失活蛋白,具有拓扑异构酶活、N-糖苷酶活等生物学活性[5]。据文献报道,白树毒素具有潜在的抗肿瘤活性,但是,由于Gelonin缺乏和细胞膜结合的结构域,导致Gelonin自身进入细胞的效率极低,从而限制了其生物学活性的发挥[6]。因此将Gelonin高效运送至细胞内,提高其药用价值显得尤为重要[7-8]。
目前能携带大分子货物(包括显像剂、核苷酸、多肽、蛋白质等)进入细胞内的载体主要有纳米颗粒、脂质体、CPP等。其中,由于CPP相对于纳米颗粒和脂质体具有安全、低毒和高效的优点而被广泛研究[9-10]。CPP是一类能够高效转运生物大分子进入细胞的多肽,一般由不超过30个氨基酸组成,由于其组成中富含带正电荷的碱性氨基酸,所以能与细胞膜表面带负电荷的组成成分通过电荷作用而在细胞膜表面聚集[11]。经典的CPP有TAT、R9等由于其具有较强的穿膜活性而被广泛的研究报道[11-12]。本课题组前期研究发现来源于人细胞外超氧化物歧化酶的肝素结合域HBD以及来源于人肝素结合表皮生长因子样生长因子的(heparin binding peptide,HBP)也具有携带大分子蛋白药物进入细胞的能力[13-14]。为了提高Gelonin进入细胞的效率以有效发挥其抗肿瘤活性,本课题首先通过荧光显微镜观察4种CPP(TAT、R9、HBD、HBP)运载EGFP进入HeLa细胞的效率,并用FITC标记Gelonin-CPP重组蛋白进一步考察验证这四种CPP携带Gelonin进入细胞的能力,随后以MTT方法评价了四种Gelonin-CPP重组蛋白的抗肿瘤活性,从中筛选具有穿膜效率最高和抑杀肿瘤活性最强的Gelonin重组蛋白并进行了该药物抗肿瘤活性的分子机制研究。
1 材料与方法
1.1 材料
Gelonin基因由华大基因合成,构建在表达质粒pET28b上。所有表达宿主菌为BL21(DE3)。人宫颈癌细胞(HeLa)、人乳腺癌细胞(MCF-7)、小鼠黑色素瘤细胞(B16)、人肝癌细胞(HepG2)均为本实验室保存。EGFP-pET28a、EGFP-HBD-pET28a、EGFP-TAT-pET28a、EGFP-R9-pET28a和EGFP-HBP-pET28a均为实验室保存。表达载体构建的相关引物由苏州泓迅生物科技有限公司合成。异丙基硫代半乳糖苷(IPTG)和噻唑蓝(MTT)等均购自碧云天生物技术公司。序列测定由华大基因完成。
1.2 方法
1.2.1 重组质粒的构建 通过PCR分别扩增带有酶切 位 点 BamH I和 Xho I的 HBD、HBP、TAT、R9后,再用BamH I和Xho I双酶切回收的PCR产物,与BamH I和Xho I双酶切后的载体Gelonin-pET28b重组得到质粒Gelonin-HBP-pET28b、Gelonin-R9-pET28b、Gelonin-HBD-pET28b、Gelonin-TAT-pET28b。以大肠杆菌DH5α为宿主菌转化重组质粒,以菌液为模板,用上述引物PCR扩增,确定质粒重组完成后,通过序列比对确认重组序列的正确性。
1.2.2 重组蛋白的表达与纯化 将重组质粒转化大肠杆菌BL21(DE3)菌株,筛选得到阳性克隆后,接种到含50 μg/mL卡那霉素的30 mL的LB培养基中,37℃培养12 h。然后将2%的菌液接种于200 mL的LB培养基中于37℃培养,待菌液浓度OD600达到0.4-0.6时,加入1 mmol/L IPTG于16℃诱导表达16 h。300 r/min离心20 min收集菌体,重悬于缓冲液(20 mmol/L Tris-HCl、10% 甘油、0.5 mol/L NaCl、pH 8.5),然后超声破碎,12 000 r/min离心后取上清液在Ni2+柱中亲和纯化。通过梯度洗脱后,用含有200 mmol/L咪唑的缓冲液收集目标蛋白。经过透析液(20 mmol/L Tris-HCl、10% 甘油、0.5 mol/L NaCl、pH 7.3)透析,用SDS-PAGE鉴定目标蛋白。纯化的重组蛋白经除菌过滤后于-80℃保存。
1.2.3 体外细胞的培养 在37℃、5%的CO2浓度下,HeLa细胞株和B16细胞株使用RPMI-1640培养基(含有10%胎牛血清和1%青霉素-链霉素)培养,MCF-7细胞株和HepG2细胞株使用DMEM培养基(含有10%胎牛血清和1%青霉素-链霉素)培养。
1.2.4 荧光实验和激光共聚焦实验 将HeLa细胞接种在24孔板中并培养12 h。然后用FITC标记1μmol/L的Gelonin融合蛋白(Gelonin,Gelonin-HBP、Gelonin-R9、Gelonin-HBD和 Gelonin-TAT)处理细胞24 h,随后加入红色荧光探针(Dil),孵育30 min,用PBS冲洗细胞3次,加入4%多聚甲醛(PFA)。固定30 min后,用PBS洗涤细胞两次,并用DAPI染色45 min。此后,通过激光扫描共聚焦显微镜(LSCM)检测Gelonin融合蛋白的细胞摄取。
1.2.5 流式细胞仪分析 HeLa细胞在6孔细胞板中培养24 h,加入融合蛋白共孵育12 h。用预冷PBS清洗两次后用无EDTA胰蛋白酶消化收集细胞。通过流式细胞仪(激发波长Ex 488 nm、发射波长Em 530 nm)分析细胞内荧光强度。
1.2.6 Gelonin融合蛋白的生物学活性评价 将不同浓度(0.1 mg/μL和 0.5 mg/μL)的 Gelonin融合蛋白加入到20 μL反应体系(1 g质粒DNA、pH 8.5、20mmol/L Tris-HCl、100 mmol/L MgCl2和 100 mmol/L KCl)中。在37℃下孵育4 h,通过1.0%琼脂糖凝胶电泳检测样品,评价其拓扑异构酶活性。N-糖苷酶活性按照TNT® T7/SP6 联合兔网织红细胞裂解物试剂盒(Qcbio科技公司,上海)操作。
1.2.7 药物蛋白的体外细胞生长抑制试验 细胞按1×104接种于96孔细胞板中培养24 h,然后用不同浓度梯度的药物分别孵育HeLa细胞(24 h)、B16细胞(24 h)、HepG2 细胞(48 h)和 MCF-7 细胞(48 h),弃去原有培养基,用5 mg/mL的MTT溶液在37℃孵育4 h。弃去MTT溶液后每孔加入120 μL二甲基亚砜(DMSO)。通过酶标仪(吸收波长490 nm)测定每孔的吸光度以确定细胞存活率。药物对肿瘤细胞的半抑制浓度(IC50)通过GraphPad Prime 6软件计算得到。
1.2.8 凋亡分析 将HeLa细胞接种在6孔板中孵育12 h。分别加入1 μmol/L的 Gelonin、Gelonin-HBP、Gelonin-HBD、Gelonin-TAT和 Gelonin-R9。处理 24h后,收获细胞并用PBS洗涤两次。然后将细胞重新悬浮于500 μL结合缓冲液中。此后,加入5 μL Annexin V-FITC 和 5 μL碘化丙啶(PI),将细胞在20℃下在黑暗中孵育20 min。通过FACScan流式细胞仪对经处理的样品进行分析。
1.2.9 Western blot 分 析 用 1 μmol/L 的 Gelonin、Gelonin-HBP、Gelonin-R9、Gelonin-HBD 和 Gelonin-TAT处理HeLa细胞24 h。通过裂解细胞获得全细胞裂解物,并通过BCA蛋白测定试剂盒测量上清蛋白的浓度。用SDS加载缓冲液处理后,通过SDSPAGE分离样品,然后将凝胶中的蛋白质转移到PVDF膜。转移后,PVDF膜首先在5%的脱脂牛奶中在室温下封闭2 h。然后将膜与特异性一抗在4℃孵育过夜。随后,将辣根过氧化物酶缀合的抗体孵育1 h。通过化学发光成像系统对膜进行显像。
2 结果
2.1 CPP穿膜效率的研究
为了筛选穿膜效率高的CPP将Gelonin有效运输进入肿瘤细胞内发挥其活性,首先以EGFP为示踪蛋白,考察不同CPP(HBD、HBP、TAT、R9)携带大分子蛋白EGFP的跨膜转运效率,将各种CPP与EGFP融合蛋白(5 μmol/L)分别与HeLa细胞共孵育12 h。通过荧光显微镜观察各种CPP的穿膜效率,没有连接CPP的EGFP在HeLa细胞内没有观察到绿色荧光信号,而融合了CPP的EGFP在HeLa细胞内都呈现了明显的绿色荧光信号,其中EGFP-HBP在HeLa细胞内呈现的绿色荧光信号最强(图1-A),表明HBP携带EGFP穿膜效率比经典的CPP(TAT、R9)更强。采用流式细胞术定量分析结果显示,与没有连接CPP的EGFP相比,融合了CPP的EGFP穿膜效率都有提高,EGFP-HBD、EGFP-TAT、EGFP-R9穿膜效率分别提高了5.11、2.51和3.83倍,其中EGFP-HBP的穿膜效率提升效果最显著,提升了19.50倍(图1-B),流式细胞术定量分析结果与荧光显微镜观察的实验结果相一致。

图1 EGFP融合蛋白的荧光显微镜检测(A)及流式细胞术检测(B)
2.2 Gelonin重组蛋白的表达及生物活性研究
将Gelonin与不同的CPP进行融合表达期望通过CPP将Gelonin高效转运到细胞内部更好地发挥其抗肿瘤活性。按本实验1.2.1方法构建获得了带有不同CPP的Gelonin重组表达质粒:Gelonin-TAT-pET28b、Gelonin-R9-pET28b、Gelonin-HBD-pET28b、Gelonin-HBP-pET28b(图2-A)。将其分别转化到大肠杆菌BL21(DE3)细胞中。按照1.2.2方法成功表达了Gelonin-CPP融合蛋白以及Gelonin蛋白,这5种重组蛋白在16℃的温度下均为可溶形式表达,将重组蛋白通过Ni-NTA亲和纯化(图2-B),获得各目的重组蛋白 Gelonin(29.6 kD)、Gelonin-HBP(32.56 kD)、Gelonin-R9(31.47 kD)、Gelonin-TAT(31.4 kD)和Gelonin-HBD(34.23 kD)。纯化的蛋白通过凝胶扫描软件分析,纯度均达到90%以上,无菌过滤后用于后续实验。
天然核糖体失活蛋白具有拓扑失活能力和N-糖苷酶活性,因此可通过超螺旋切割实验和体外翻译抑制实验来验证融合有不同CPP(R9、TAT、HBD和HBP)的重组Gelonin蛋白的生物活性。实验结果(图3-A)显示,与单独Gelonin重组蛋白相比,各种带有CPP的Gelonin融合蛋白(Gelonin-HBP、Gelonin-R9、Gelonin-TAT和 Gelonin-HBD)都可将超螺旋双链质粒DNA切割成线性(L条带)或切口环形(N条带)形式,说明CPP功能域的引入没有影响Gelonin蛋白本身的拓扑异构酶活性,且活性的高低与重组蛋白的浓度正相关。核糖体失活蛋白发挥抗肿瘤活是由于其具有N-糖苷酶活性,我们采用TNT®T7 / SP6联合网织红细胞裂解液系统检测5种Gelonin融合蛋白(Gelonin-HBP、Gelonin-R9、Gelonin-TAT、Gelonin-HBD和Gelonin)对荧光素酶翻译的抑制作用。结果(图3-B)显示所有Gelonin融合蛋白都可降低翻译的萤光素酶的相对量,而且随着浓度的升高N-糖苷酶活性均增强。因此,在Gelonin的羧基末端引入穿膜功能域R9、TAT、HBD和HBP后,仍然保留了原Gelonin蛋白本身具有的N-糖苷酶生物活性。

图2 Gelonin融合蛋白的质粒构建(A)及蛋白的SDSPAGE分析(B)
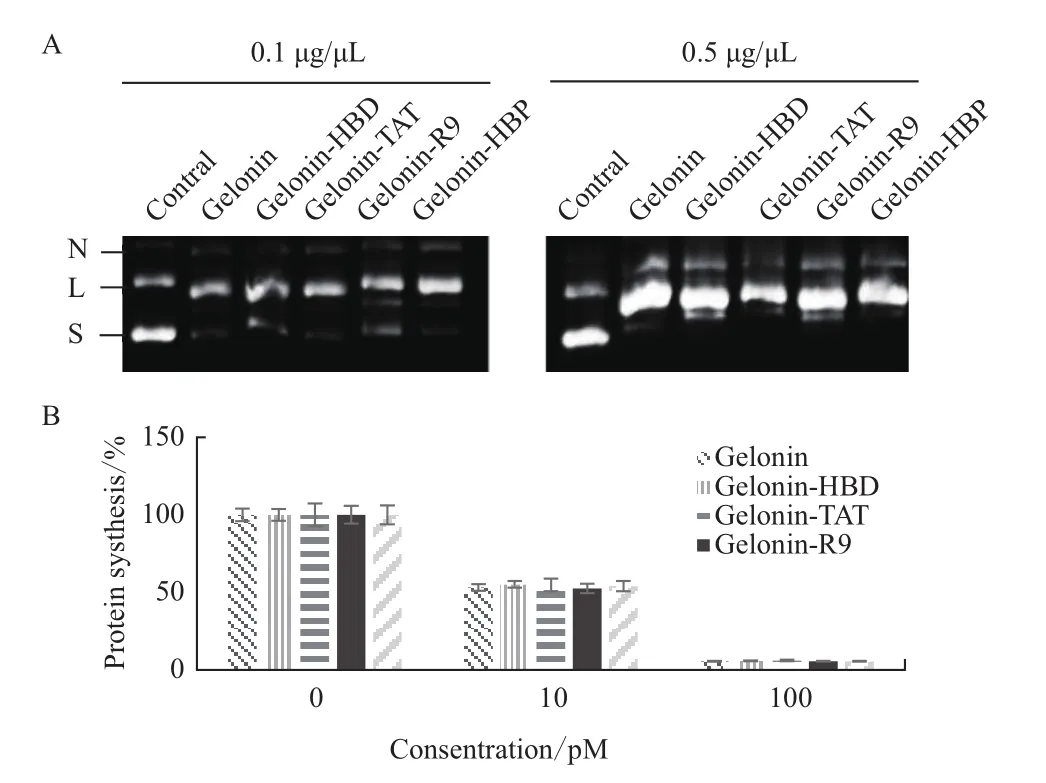
图3 Gelonin融合蛋白拓扑异构酶活性检测(A)及N-糖苷酶活性检测(B)
2.3 CPP运输Gelonin进入细胞的穿膜效率分析
上述结果表明了CPP的引入不会影响Gelonin原有生物活性,实验随后考察了4种CPP携载Gelonin的效率是否与转运EGFP效率一致。以FITC标记的各种Gelonin-CPP融合蛋白(Gelonin-HBP、Gelonin-R9、Gelonin-TAT、Gelonin-HBD 和 Gelonin)分别与HeLa细胞共孵育24 h,通过激光共聚焦扫描显微镜分析检测胞内荧光强度,结果如图4-A所示,没有融合CPP的Gelonin在HeLa细胞内没有呈现出明显的FITC荧光信号,而带有CPP 的Gelonin融合蛋白在HeLa细胞内都可观察到强烈的荧光信号,其中Gelonin-HBP在HeLa细胞内呈现的荧光信号最强。
采用流式细胞术定量分析结果与激光共聚焦检测的实验结果基本一致:与没有连接CPP的Gelonin相比,融合了CPP的Gelonin穿膜效率都明显提高,Gelonin-HBD、Gelonin-TAT、Gelonin-R9和 Gelonin-HBP穿膜效率分别提高了4.66、6.48、7.12和8.45倍,Gelonin-HBP的穿膜效率提升最显著(图4-B)。HBP高效运载Gelonin进入细胞内的实验结果与携载EGFP结果一致(图1)。
2.4 Gelonin重组蛋白抑制肿瘤细胞生长活性研究
在荧光实验结果表明连接有不同CPP的Gelonin穿膜能力都有明显提升,随后进行了细胞生长抑制实验(MTT法)来评价比较各种融合蛋白的抗肿瘤效果。将5种Gelonin融合蛋白(Gelonin、Gelonin-HBD、Gelonin-TAT、Gelonin-R9和Gelonin-HBP)通过增加剂量(0-3 μmol/L)的方式分别与肿瘤细胞共孵育来检测对细胞生长的抑制活性。与未加重组蛋白的空白对照组相比,加入重组蛋白的不同肿瘤细胞的生长都受到了不同程度的抑制,且这种抑制作用都呈现出浓度依赖性。5种Gelonin融合蛋白在同样浓度(3 μmol/L)下分别与4种肿瘤细胞共孵育,结果表明与没有连接CPP的Gelonin相比,连接有CPP的Gelonin的抗肿瘤作用都有不同程度的提高(图5),其中以Gelonin-HBP抑杀肿瘤细胞的效果最强,对于HeLa、HepG2、B16和MCF-7药效分别可提升16.4、24.6、9.6和14.0倍(表1)。

图4 FITC标记Gelonin融合蛋白的激光共聚焦检测(A)及流式细胞术检测(B)
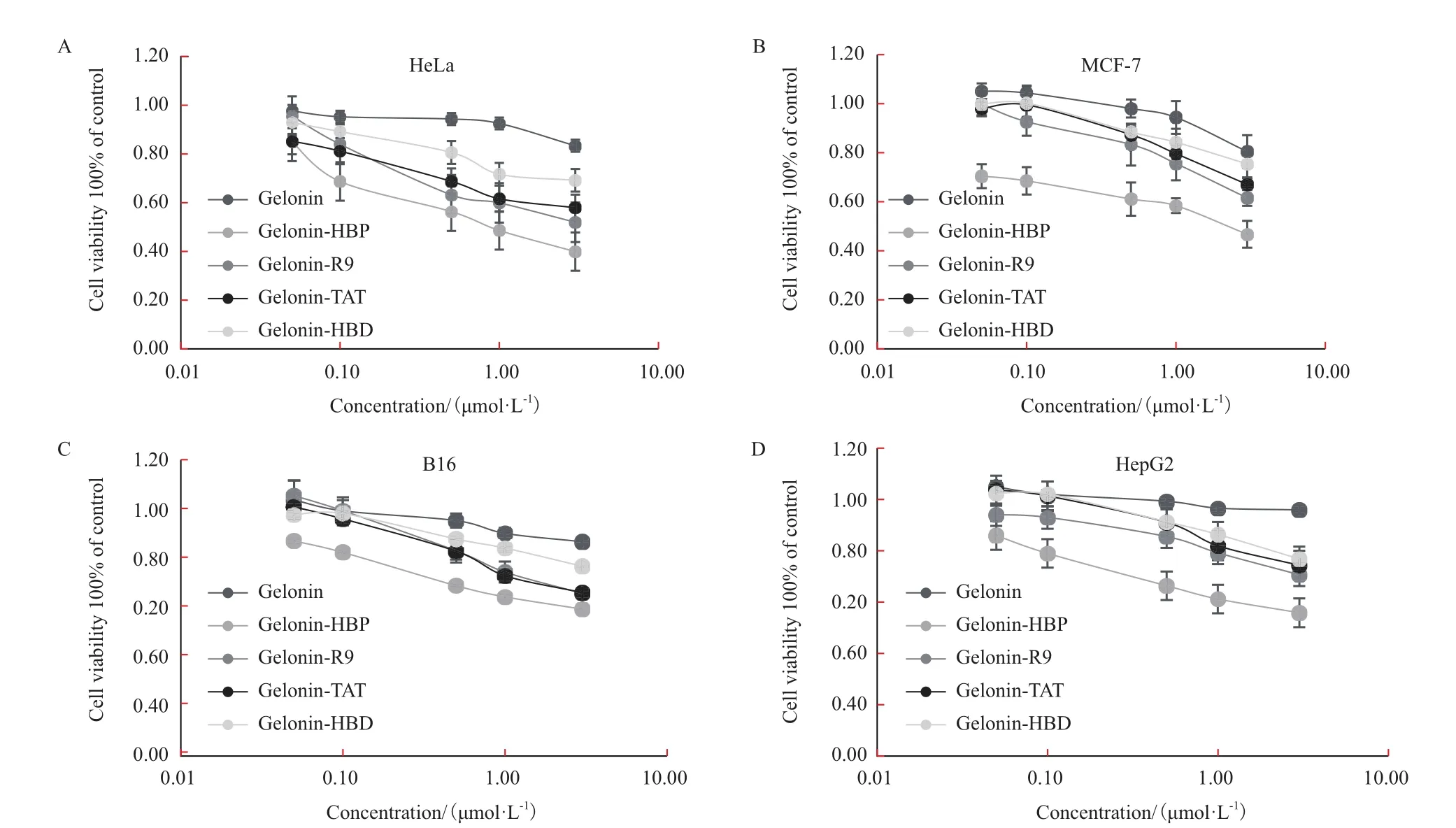
图5 Gelonin融合蛋白对细胞存活率的影响

表1 Gelonin融合蛋白对不同肿瘤细胞的半抑制浓度(IC50)
2.5 Gelonin重组蛋白对HeLa细胞的流式凋亡分析
由于Gelonin融合HBP后极大提高了Gelonin的抗肿瘤能力,为了阐明其对肿瘤细胞毒性影响的分子机制,我们将HeLa细胞分别与不同浓度(0.5、1.0 μmol/L)的Gelonin和Gelonin-HBP 孵育24 h后,以Annexin V-FITC/FACS法经流式细胞仪进行分析测定。结果如图6所示,随着Gelonin和Gelonin-HBP蛋白的浓度增加,各试验组HeLa细胞凋亡率统计分析结果为:Gelonin组的凋亡率依次为21.4%、23.5%;Gelonin-HBP组的凋亡率依次为41.3%、45.8%。这一结果表明,穿膜肽HBP的引入使得Gelonin-HBP蛋白引起细胞凋亡的作用显著增强。

图6 Gelonin重组融合蛋白对HeLa细胞的凋亡凋亡检测
2.6 Gelonin重组蛋白对HeLa细胞凋亡通路的影响
为了进一步研究Gelonin-HBP重组蛋白诱导HeLa细胞凋亡的内在分子机制,分别将1.0 μmol/L的Gelonin和Gelonin-HBP作用HeLa细胞24 h后,通过Western blot方法对相关凋亡蛋白的表达水平进行分析。如图7所示,相比于对照组,Gelonin处理组和Gelonin-HBP处理组的酶原形式(无活性)的Caspase 9、Caspase 3和Caspase 8含量均有下调,说明其被剪切,成了激活形式,其中Gelonin-HBP对Caspase 9、Caspase 3和Caspas8的激活更为显著,并且Gelonin-HBP作用于HeLa细胞后比Gelonin本身更明显上调Bax的表达,以及显著下调Bcl-2的表达。

图7 Western blot分析
3 讨论
Gelonin(I型核糖体失活蛋白)由于缺乏和细胞膜结合的结构域,导致进入细胞的效率极低,因而影响了其抗肿瘤作用[6]。因此,将Gelonin与不同的CPP进行融合表达,从中筛选到具有高效自主穿膜运输能力,同时又保留Gelonin原有生物活性的重组融合蛋白,是本研究关注的重点。CPP已被证明为在体内帮助生物大分子跨膜转运的一种有效工具,已成功开发和应用的TAT、R9等[11-12]。在这些CPP中,人源性的CPP由于其低免疫原性已得到更多地关注和应用[13-14]。将不同CPP与EGFP融合表达的穿膜效率检测实验表明,肝素结合域HBP和HBD携带大分子蛋白EGFP对HeLa的穿膜效率要强于经典CPP如TAT和R9。
本研究进一步将Gelonin与经典CPP如TAT、R9以及我们实验室开发的HBD和HBP两种人源性CPP融合后,都保留了原有的N-糖苷酶活性和拓扑异构酶活性。以FITC标记的不同Gelonin重组蛋白的穿膜效率检测实验表明,CPP可大大增强Gelonin的内化效率,且与经典的CPP如R9和TAT相比,HBP携带Gelonin的穿膜效率更高,而Gelonin-HBD的穿膜效率大幅度的降低,这表明Gelonin和肝素结合域之间的相互匹配将影响重组蛋白的穿膜效率,从而导致其抗肿瘤活性下降。HBD的引入虽然没有影响Gelonin的生物活性,但可能由于结构域之间的影响导致Gelonin-HBD的内化能力降低,说明CPP携载药物时需要考虑结构域之间的相互作用。
MTT实验结果表明,相比于Gelonin(1 μmol/L)对HeLa细 胞 的 杀 伤 为6.9%,Gelonin-HBP(1 μmol/L)抑杀HeLa细胞的效果可提升7.82倍,达到了54%。同样实验条件下流式细胞术定量分析表明Gelonin-HBP比单独Gelonin的穿膜效果提升8.45倍,推测Gelonin融合蛋白抑杀毒性的增强主要是由于CPP的引入促进了Gelonin重组蛋白对癌细胞穿膜渗透作用,其中HBP对Gelonin的穿膜运输能力最强,导致其对肿瘤细胞的抑杀作用也最明显。
流式凋亡分析实验表明HBP的引入是通过加强Gelonin在细胞内诱导凋亡的过程来实现的。线粒体途径和死亡受体途径是激活凋亡的两个主要信号通路[15]。在线粒体途径中,处于该通路上游酶原形式的Caspase 9的激活会促使通路下游酶原形式的Caspase 3被剪切成分子量小的激活形式,导致细胞凋亡。此外,作为死亡受体途径的发起者,Caspas 8的激活会导致细胞通过外在的凋亡通路发生凋亡。本研究表明,相比于Gelonin,Gelonin-HBP能更显著的激活Caspase3、Caspase-9和Caspase-8。此外,属于Bcl-2蛋白家族的Bax和Bcl-2在线粒体凋亡通路中发挥着重要的调控作用,Bax/Bcl-2比率的增加会促进细胞色素C从线粒体释放,进而激活凋亡途径[16-17]。免疫印迹实验进一步观察到Gelonin-HBP重组蛋白处理组的Bax/Bcl-2比率的上调均比单独的Gelonin蛋白更明显。以上结果表明了Gelonin融合蛋白诱导的HeLa细胞凋亡与线粒体信号通路和死亡受体信号通路相关,当融合HBP后,可显著激活Gelonin蛋白通过激活线粒体介导的和死亡受体介导的凋亡信号通路诱导更多的HeLa细胞凋亡。本研究提出了对Gelonin引入与之相互匹配且能高效携带其穿膜的肝素结合域HBP的策略,可以显著提高Gelonin的抗肿瘤治疗效果,并第一次阐明了带有CPP的Gelonin诱导凋亡的分子机制,对推动Gelonin的临床应用提供了理论依据。
4 结论
本研究通过重组表达和筛选,获得了具有高穿膜效率的Gelonin-HBP重组蛋白。肿瘤细胞生长的抑制实验表明,Gelonin-HBP在多种肿瘤细胞中表现出最好的抑杀肿瘤活性。对HeLa细胞中凋亡信号通路的分析显示这种活性的提高是通过激活线粒体和死亡受体所介导的。
[1]Lu YZ, Li PF, Li YZ, et al. Enhanced anti-tumor activity of trichosanthin after combination with a human-derived cellpenetrating peptide, and a possible mechanism of activity[J].Fitoterapia, 2016, 112:183-190.
[2]Puri M, Kaur I, Kanwar RK, et al. Ribosome inactivating proteins(RIPs)from Momordica charantia for anti viral therapy[J].Current Molecular Medicine, 2009, 9(9):1080-1094.
[3]Antignani A, Fitzgerald D. Immunotoxins:The role of the toxin[J]. Toxins, 2013, 5(8):1486-1502.
[4]Puri M, Kaur I, Perugini MA, et al. Ribosome-inactivating proteins:current status and biomedical applications[J]. Drug Discovery Today, 2012, 17(13-14):774-783.
[5]Stirpe F, Olsnes S, Pihl A. Gelonin, a new inhibitor of protein synthesis, nontoxic to intact cells. Isolation, characterization, and preparation of cytotoxic complexes with concanavalin A[J].Journal of Biological Chemistry, 1980, 255(14):6947-6953.
[6]Nimmanapalli R, Lyu MA, Du M, et al. The growth factor fusion construct containing B-lymphocyte stimulator(BLyS)and the toxin rGel induces apoptosis specifically in BAFF-R-positive CLL cells[J]. Blood, 2007, 109(6):2557-2564.
[7]Atkinson SF, Bettinger T, Seymour LW, et al. Conjugation of folate via gelonin carbohydrate residues retains ribosomal-inactivating properties of the toxin and permits targeting to folate receptor positive cells[J]. Journal of Biological Chemistry, 2001, 276(30):27930-27935.
[8]Shin MC, Zhang J, David AE, et al. Chemically and biologically synthesized CPP-modified gelonin for enhanced anti-tumor activity[J]. Journal of Controlled Release, 2013, 172(1):169-178.
[9]Snyder EL, Dowdy SF. Cell penetrating peptides in drug delivery[J]. Pharmaceutical Research, 2004, 21(3):389-393.
[10]Järver P, Langel U. The use of cell-penetrating peptides as a tool for gene regulation[J]. Drug Discovery Today, 2004, 9(9):395-402.
[11]Koren E, Torchilin VP. Cell-penetrating peptides:breaking through to the other side[J]. Trends in Molecular Medicine,2012, 18(7):385-393.
[12]Cheung CHA, Sun X, Kanwar JR, et al. A cell-permeable dominantnegative survivin protein induces apoptosis and sensitizes prostate cancer cells to TNF-α therapy[J]. Cancer Cell International,2010, 10(1):36-47.
[13]Luo Z, Cao XW, Li C, et al. The heparin-binding domain of HBEGF as an efficient cell-penetrating peptide for drug delivery[J].Journal of Peptide Science, 2016, 22(11-12):689-699.
[14]Lv Q, Yang XZ, Fu LY, et al. Recombinant expression and purification of a MAP30-cell penetrating peptide fusion protein with higher anti-tumor bioactivity[J]. Protein Expression and Purification, 2015, 111:9-17.
[15]Creagh EM. Caspase crosstalk:integration of apoptotic and innate immune signalling pathways[J]. Trends in Immunology, 2014,35(12):631-640.
[16]Danial NN, Korsmeyer S J. Cell death:critical control points[J].Cell, 2004, 116(2):205-219.
[17]Green DR, Guido K. The pathophysiology of mitochondrial cell death[J]. Science, 2004, 305(5684):626-629.

