连翘总黄酮对胃癌细胞MGC80-3增殖的影响
李平 张桂萍 胡建燃
(长治学院 生物科学与技术系,长治 046011)
连翘[Forsythia suspense(Thunb.)Vahl.]是临床常用的一味传统中药材,属木犀科植物,主要分布于河北、山西、陕西、山东、安徽西部、河南、湖北以及四川。主要有效成分有连翘酯苷、连翘苷、芦丁、右旋松脂酚等,现代药理研究显示具有抗菌、保肝、保护心脏、提高免疫力、抗氧化、抗病毒、抗肿瘤等作用。山西是我国药用连翘的主产省份,有研究表明山西所产的连翘在药理成分及药效方面具有一定优势。例如,冯帅等[1]发现山西所产的连翘含有的连翘苷和连翘酯苷A的含量均显著高于陕西、河南、河北和山东等地所产的连翘;吴婷等[2]的研究表明山西连翘提取物抗甲型流感病毒的效果整体优于河南、河北和陕西所产的连翘药材。Zhang等[3]的研究结果表明连翘提取物在模式小鼠体内能够发挥显著的抗糖尿病和抗高血脂作用;Guo等[4]发现连翘精油具有显著的抗细菌作用,Zhang等[5]则发现连翘提取物对紫色色杆菌和铜绿假单胞菌的细菌群体效应具有强烈的拮抗作用;Zhang等[6]发现连翘提取物可能通过其抗炎和抗氧化活性拮抗鱼藤酮所造成的神经毒性,从而在帕金森症等疾病中发挥一定的治疗作用;Huang等[7]发现连翘酯苷能够有效抑制PC12细胞中LPS所诱导的细胞死亡以及ROS的产生,从而发挥一定的保护功能;Wei等[8]的研究结果表明连翘苷能够有效抑制H2O2所造成的细胞氧化应激和凋亡。
本研究以山西省长治市所产的连翘为材料,利用传统方法提取其总黄酮(Forsythia flavonoids,FF),测定黄酮含量,然后探讨其对胃癌细胞MGC80-3增殖的影响,并进一步分析其可能的分子机制。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 连翘购自山西省长治市昂生大药房,产地为长治市平顺县;人胃癌细胞MGC80-3购自武汉博士德生物工程有限公司;标准品芦丁和RPMI-1640培养基购买于北京索来宝生物科技有限公司;胎牛血清购买于杭州四季青生物工程材料有限公司;四氮甲唑蓝(MTT)、二甲基亚砜(DMSO)、青链霉素等购买于北京依托华茂生物科技有限公司;兔抗mTOR抗体、兔抗LC3 II、HPR标记羊抗兔抗体均购自北京博奥森生物技术有限公司;TRIzol试剂购自Invitrogen公司;逆转录试剂盒购自TaKaRa公司。
1.1.2 仪器与设备 CO2培养箱(Thermo Fisher Scientific); 细 胞 计 数 仪Cellometer Auto1000(Nexcelom);倒置显微镜CKX41-C31BF(Olympus);多功能酶标仪SpectraMax M2(Molecular Devices);蛋白电泳系统(Bio-rad);高速冷冻离心机(HITACHI);凝胶成像系统(Bio-Rad)。
1.2 方法
1.2.1 连翘总黄酮的提取及含量测定 参考李富华等[9]报道的方法,进行适当修改,提取连翘总黄酮。具体方法如下:称取适量的连翘果实,经高速匀浆机打碎成粉,精确称取5 g药材粉末,按照料液比1∶30加入70%乙醇,利用索氏提取器在80℃下回流提取2 h。收集提取液,将提取液浓缩为膏状,加50 mL蒸馏水,37℃下充分溶解,置于250 mL分液漏斗,用等体积石油醚萃取3次,弃去石油醚相,合并水相,减压浓缩为膏状,在40℃条件下干燥至恒重,即为连翘总黄酮提取物。
参考陶波等[10]报道的方法,进行适当修改,测定连翘总黄酮含量。具体方法如下:精确称取2.5 mg芦丁标准品,用10 mL无水甲醇充分溶解,再加入蒸馏水将其体积定容至25 mL,制得标准品溶液。精确吸取芦丁标准品溶液0、1.0、2.0、3.0、4.0、5.0 mL置于不同试管中,并用70%乙醇分别定容至10 mL。分别向每根试管中加入5% NaNO2溶液1.0 mL,充分混匀后静置5 min;分别向每根试管中加入10% Al(NO3)3溶液 1.0 mL,充分混匀后静置5 min;分别向每根试管中加入4% NaOH溶液 10.0mL和蒸馏水3.0 mL,充分混匀后静置15 min。以不含芦丁的溶液为空白,利用分光光度计依次检测不同浓度标准品OD510值。以OD510值为纵坐标,芦丁标准品浓度(mg/mL)为横坐标,进行线性回归,获得回归方程。利用合适浓度的连翘总黄酮提取物溶液进行上述步骤,计算OD510值,通过回归方程计算总黄酮含量,黄酮含量为50.7±0.4 mg/g。
1.2.2 MTT实验 人胃癌细胞MGC80-3采用含10%胎牛血清的RMPI-1640培养基,在5% CO2、37℃的条件下培养,在细胞指数增长期时,用胰酶-EDTA消化液进行消化。按照1×104细胞/孔的浓度将细胞悬液接种到96孔板中,过夜培养后,加入不同浓度的FF溶液(1、0.5、0.25、0.125、0.0625、0.03125、0.025、0.0125 mg/mL)处理细胞,并设置不加药物的对照组,培养48 h后,向培养液中加入终浓度10% MTT溶液(5 mg/mL),继续培养4 h后,弃去培养基,加入150 μL DMSO,振荡10 min后,测定OD570值,计算肿瘤细胞抑制率。
1.2.3 平板集落形成实验 参考戴红良等[11]报道的方法,进行适当修改,具体步骤如下:按照5×102细胞/孔的浓度将MGC80-3细胞接种至6孔板中,在37℃、5% CO2条件下培养过夜;加入不同浓度的FF,继续培养,每隔3 d换液一次,并加入相同浓度的FF,培养14 d后,弃去培养基,无水甲醇固定5 min,用0.2%的结晶紫甲醇溶液对细胞进行染色,观察并拍照记录。
1.2.4 RT-PCR实验 利用TRIzol试剂并按照其说明书方法提取细胞总RNA,利用逆转录试剂盒合成cDNA。PCR所用引物如表1所示,扩增条件为:94℃,3 min ;94℃,30 s,60℃,30 s,72℃,20 s,30个循环;72℃,7 min。PCR产物采用1% 琼脂糖凝胶电泳,利用凝胶成像系统拍照记录结果。

表1 相关引物序列
1.2.5 Western blot实验 收集指数期生长的细胞,弃去培养液,加入RIPA裂解液(含蛋白酶抑制剂和磷酸酶抑制剂),于冰上裂解30 min后,在4℃下12 000 r/min离心15 min,收集上清液,并采用Lowry法测定蛋白浓度。经SDS-PAGE电泳、转膜、封闭、一抗孵育过夜、漂洗、二抗常温孵育1 h、漂洗,然后加入ECL试剂反应,利用Bio-Rad成像系统扫描拍照。
2 结果
2.1 FF浓度对MGC80-3细胞增殖的影响
通过MTT实验检测FF对胃癌细胞MGC80-3增殖的影响。结果如图1所示,当FF终浓度为1 mg/mL时,对MGC80-3细胞的抑制率高达86.32%,随着浓度的降低,抑制率逐渐下降,计算其IC50值为0.297 4 mg/mL,表明FF对胃癌细胞MGC80-3具有明显的抑制作用,并与药物剂量呈正相关关系。
2.2 长期低浓度FF处理对MGC80-3细胞生长的影响
为进一步探讨低浓度的FF对胃癌细胞MGC80-3长期生长的影响,取抑制率不超过10%的FF溶液(终浓度为0.03125 mg/mL,抑制率为7.90%)处理细胞,进行细胞增殖实验。结果如图2所示,从第3天,处理组细胞数量即明显少于对照组细胞(P<0.05),第4天、第5天和第6天,处理组细胞与对照组细胞相比,数量更少,差异极显著(P<0.01)。上述结果表明,长期低浓度的FF处理细胞仍能抑制其生长。
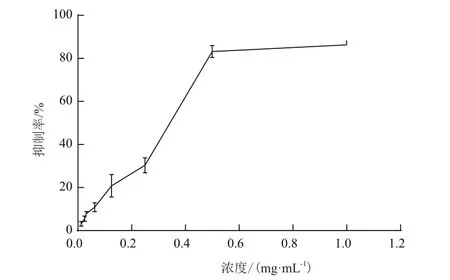
图1 FF浓度对MGC80-3细胞的抑制效应

图2 低浓度的FF对胃癌细胞MGC80-3增殖的影响
2.3 连翘总黄酮提取物对MGC80-3细胞集落形成的影响
平板细胞集落形成实验结果如表2所示,终浓度为0.05 mg/mL的FF长期处理MGC80-3细胞,导致其全部死亡,无法形成集落(P<0.01)。与对照组相比(约453个集落,形成率为90.6%),当FF终浓度为0.025 mg/mL时,大多数MGC80-3细胞死亡,平板中形成了少量细胞集落(约216个集落,形成率为43.2%),差异极显著(P<0.01);当FF终浓度为0.0125 mg/mL时,所形成的细胞集落未见明显减少(约445个集落,形成率89.0%)。
2.4 FF对MGC80-3细胞自噬相关基因表达的影响
2.4.1 半定量PCR检测相关基因mRNA表达水平 上述实验结果表明FF显著抑制了MGC80-3细胞的增殖,为进一步探讨其潜在分子机制,本研究分析了相关基因的表达情况。用不同浓度的FF处理细胞后,通过半定量RT-PCR实验检测了多个基因的mRNA水平,结果如图3-A所示。随着FF浓度从0.0125 mg/mL提高至0.4 mg/mL,LC3、Bax以及beclin的mRNA水平显著提高,而mTOR的表达则出现明显下调(图3-B)。由于上述4个基因均为细胞自噬相关基因,因此以上结果表明,FF可能促进了MGC80-3细胞的自噬,进而抑制其增殖。
2.4.2 Western blot检测相关蛋白表达 为验证半定量RT-PCR实验的结果,进一步通过Western blot实验检测细胞自噬过程关键因子mTOR和LC3 II的表达水平。结果如图4-A,B所示,当FF的浓度从0.2mg/mL提高至0.4 mg/mL时,MGC80-3细胞中mTOR蛋白水平显著降低,而LC3 II的表达明显增强。该结果与半定量RT-PCR实验结果一致,证实FF的确影响了细胞自噬过程。

表2 细胞集落形成实验
3 讨论
近年来,在肿瘤防治领域,中药材越来越受到研究者的关注。有研究表明,白花蛇舌草、半枝莲、陈皮、黄芩、菟丝子等均具有一定的抗肿瘤作用,而其主要活性成分包括黄酮醇、黄烷酮、异黄酮等天然黄酮类化合物[12]。目前,对于天然黄酮类化合物抑制肿瘤细胞的分子机制集中于影响细胞增殖、侵袭转移能力及细胞凋亡等方面[13]。黄酮也是连翘的重要成分。目前,国内外学者针对连翘黄酮的研究工作,主要集中在提取工艺及体外抗氧活性方面[14-16],尚未见有文献报道其具有抗肿瘤作用。本研究以山西长治地区生长的连翘为材料,利用传统方法提取其黄酮成分,然后通过细胞水平的MTT实验证实FF对胃癌细胞MGC80-3增殖和集落形成能力具有显著的抑制作用。
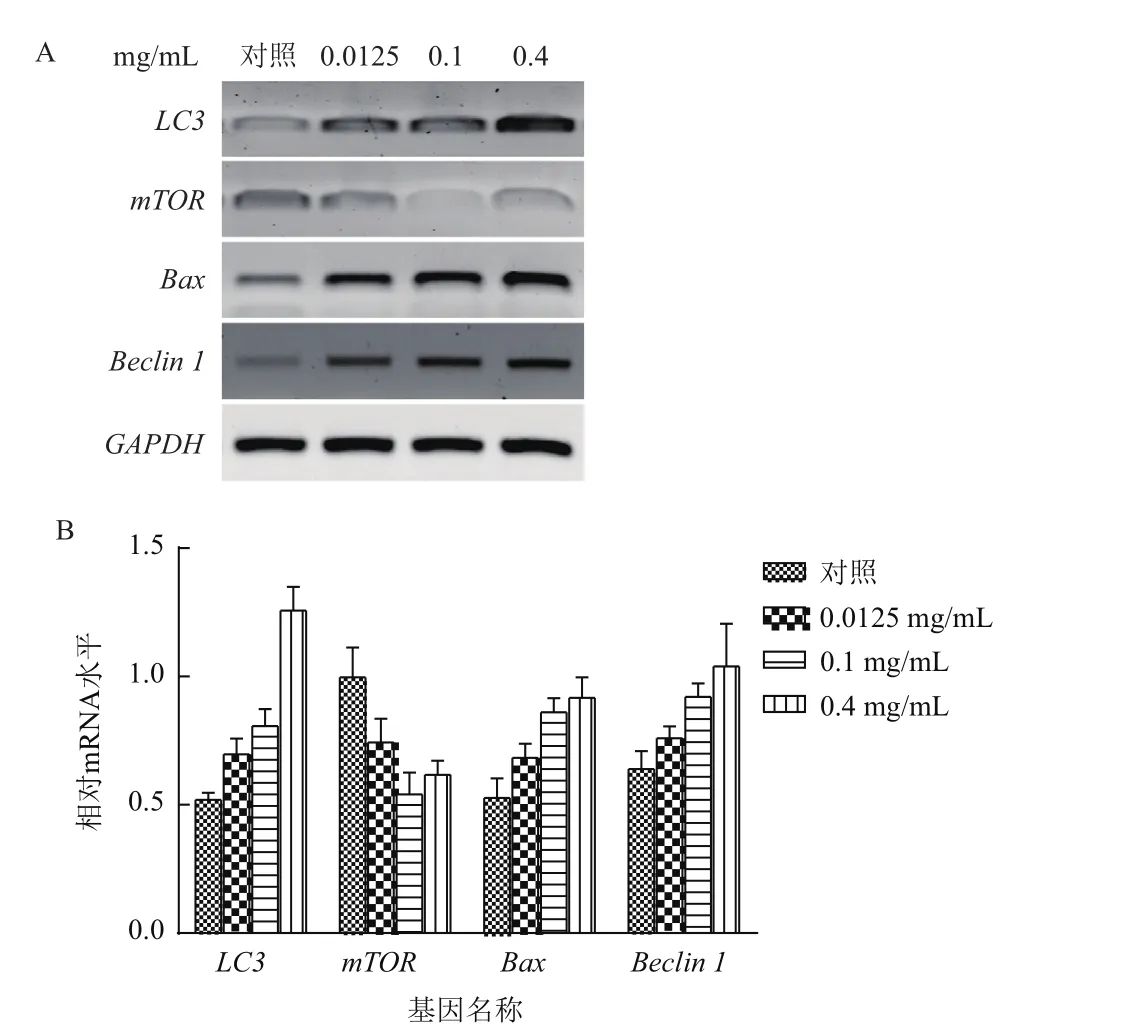
图3 半定量PCR检测相关基因表达水平

图4 Western blot实验检测相关蛋白表达水平
细胞自噬(Autophagy)一种广泛存在于真核细胞中,且在生物进化中高度保守的溶酶体依赖性的降解途径,通常使细胞适应外周环境压力,以避免细胞死亡,所作出的正常生理改变[17]。但是,在某些条件下,细胞自噬过度激活则会引发II型程序性细胞死亡,即自噬性细胞死亡。细胞内自噬平衡的打破与肿瘤的发生密切相关。自噬过程涉及多个关键因子,如mTOR、Beclin 1、自噬相关蛋白Atg、Bcl-2、NF-κB等,其中LC3(Atg 8)在自噬过程中转化为LC3 II,其蛋白水平是自噬程度的标志[18]。AMPK/TSC/mTOR 通路的活化及 PI3K/AKT/mTOR 通路的抑制是自噬过程的主要诱因,自噬调节的异常在多种癌症中均有体现[19]。本研究发现FF提高了胃癌细胞MGC80-3中自噬标志因子LC3 II的蛋白水平,以及相关蛋白基因Bax和Bcl2的表达;同时,降低了mTOR蛋白水平,进而可能抑制了mTOR相关信号通路。因此,长治连翘的黄酮成分可能通过诱导细胞自噬过程对胃癌细胞MGC80-3发挥抑制作用,为连翘在肿瘤预防和治疗方面的开发利用提供理论参考。
4 结论
连翘黄酮对胃癌细胞MGC80-3增殖具有良好的抑制作用。连翘黄酮能够显著抑制mTOR蛋白的表达,同时提高Bax、Beclin 1和LC3Ⅱ的表达水平。
[1]冯帅, 王晓燕, 李峰. 不同产地连翘的连翘苷及连翘酯苷A的含量比较[J]. 山东中医药大学学报, 2013, 37(6):514-515.
[2]吴婷, 魏珊, 李敏, 等. 山西道地连翘体外抗甲型流感病毒活性的研究[J]. 时珍国医国药, 2015, 27(1):65-66.
[3]Zhang Y, Feng F, Chen T, et al. Antidiabetic and antihyperlipidemic activities of Forsythia suspensa(Thunb.)Vahl(fruit)in streptozotocin-induced diabetes mice[J]. J Ethnopharmacol,2016, 192:256-263.
[4]Guo N, Gai QY, Jiao J, et al. Antibacterial activity of Fructus forsythia essential oil and the application of EO-loaded nanoparticles to food-borne pathogens[J]. Foods, 2016, 5(4):E73.
[5]Zhang A, Chu WH. Anti-quorum sensing activity of Forsythia suspense on chromobacterium violaceum and Pseudomonas aeruginosa[J]. Pharmacogn Mag, 2017, 13(50):321-325.
[6]Zhang S, Shao SY, Song XY, et al. Protective effects of Forsythia suspense extract with antioxidant and anti-inflammatory properties in a model of rotenone induced neurotoxicity[J]. Neurotoxicology,2016, 52:72-83.
[7]Huang C, Lin Y, Su H, et al. Forsythiaside protects against hydrogen peroxide-induced oxidative stress and apoptosis in PC12 cell[J].Neurochem Res, 2015, 40(1):27-35.
[8]Wei T, Tian W, Yan H, et al. Protective effects of phillyrin on H2O2-induced oxidative stress and apoptosis in PC12 cells[J]. Cell Mol Neurobiol, 2014, 34(8):1165-1173.
[9]李富华, 刘冬, 明建. 苦荞麸皮黄酮抗氧化及抗肿瘤活性[J].食品科学, 2014, 35(7):58-63.
[10]陶波, 方梅, 张嘉男, 等. 沙冬青种子总黄酮测定方法及纯化工艺研究[J]. 生物技术通报, 2017, 33(5):63-70.
[11]戴红良, 葛树卿, 楚明会, 等. 染料木黄酮通过抑制 VEGF人口腔癌 TCA8113 细胞增殖[J]. 中国病理生理杂志, 2016, 32(3):464-469.
[12]孙晓润, 陈苹苹, 等. 天然黄酮类化合物抗肿瘤作用靶点研究进展[J]. 中国实验方剂学杂志, 2017, 23(6):218-228.
[13]Wang G, Wang JJ, Guan R, et al. Strategies to target glucose metabolism in tumor microenvironment on cancer by flavonoids[J]. Nutr Cancer, 2017, 69(4):534-554.
[14]王燕, 王儒彬, 孙磊, 等. 不同采摘期连翘叶中总黄酮、总酚酸含量与DPPH自由基清除能力的相关性[J]. 中国实验方剂学杂志, 2011, 17(16):109-112.
[15]李艳芝, 王建安, 张辰辰. 连翘花中总黄酮提取工艺的优化[J]. 中国医院药学杂志, 2012, 32(18):1502-1504.
[16]刘梦星, 王涛, 马晶军. 微波辅助提取连翘黄酮类化合物及其抗氧化性研究[J]. 湖北农业科学, 2014, 53(3):651-656.
[17]Platini F, Péreztomás R, Ambrosio S, et al. Understanding autophagy in cell death control[J]. Curr Pharm Design, 2010, 16(1):101-113.
[18]Yang Z, Klionsky DJ. Mammalian autophagy:core molecular machinery and signaling regulation[J]. Curr Opin Cell Biol,2010, 22(2):124-131.
[19]Kim J, Kundu M, Viollet B, et al. AMPK and mTOR regulate autophagy through direct phosphorylation of Ulk1[J]. Nat Cell Biol, 2011, 13(2):132-141.

