血液透析患者血浆硫酸吲哚酚与左心室肥厚的相关性
雒 华,贺晓莉,杨小娟,刘晓华
0 引言
血液透析患者尿毒素积累,毒性增强,增加CKD患者心血管疾病(CVD)的死亡率[1],其中LVH和充血性心力衰竭是主要的死亡原因。有研究表明,对心血管有潜在影响作用的大多数是中分子物质和(或)蛋白结合类物质,其中包括硫酸吲哚酚(IS)。IS是由色氨酸被肠道细菌分解产生的吲哚经门静脉入肝经细胞色素P4502E1(CYP2E1)作用而生成,肾脏是其正常清除途径[2]。硫酸吲哚酚(IS)在慢性肾脏病患者体内显著增加,通常与阴离子蛋白白蛋白结合,但是常规透析不能将其彻底清除[3]。有研究指出,IS是预测CKD患者晚期发生CVD的重要生物标志物[4]。IS导致心血管损害主要是通过诱导全身氧化应激状态实现的,这些心肌损害包括心肌细胞变性,血管平滑肌细胞增生,血管内皮细胞功能失调,动脉钙化,最终导致心功能不全及血管硬化等病理改变[5]。虽然关于IS与心血管的研究有很多,但是IS与心室肥厚方面的研究鲜有报道,本研究将对血液透析患者血浆硫酸吲哚酚与左心室肥厚的相关性进行探讨,探究IS是否为慢性肾脏病血液透析患者左心室肥厚的独立危险因素。
1 对象与方法
1.1 研究对象 选择在我院血液净化中心进行血液透析(低通量,每周3次,每次4 h)的患者。患者入选标准:①年龄≥18岁;②透析时间≥6个月。排除标准:①合并有心脏室壁瘤的患者;②近期(3个月)发作过充血性心力衰竭的患者。入组在半年内(2016年7-12月)完成,收集符合入选标准的患者的临床资料,包括性别、年龄、透析龄、既往史等。该研究得到了我院伦理委员会的批准,所有入组患者均签署知情同意书。
1.2 方法
1.2.1 身高、透析间期体重、血压的测量及血浆标本采集 所有患者均在同一时间,穿单衣和赤脚,在同一台体重计测量身高和体重,并计算体重指数(BMI)。研究开始前1个月,记录入组患者透析期间体重增长均值。采用研究开始透析前1个月的平均血压值。血浆在周中非透析日上午采集,抗凝管采血后离心(3 000 r/min,10 min)取上层血浆,于0.5 h内分装并置于-80 ℃冰箱保存。
1.2.2 蛋白质摄入和残余肾功能评估 采用标准化蛋白氮表现率(nPNA)评估入组患者的蛋白质摄入量。依据其血尿素氮(BUN)和血肌酐(Scr)数值[6]评估患者的残余肾功能(RRF)。
1.2.3 生化检测 使用全自动生化分析仪检测血液标本,包括:高敏C反应蛋白(hsCRP)、前白蛋白、白蛋白、载脂蛋白A (Apo-A)、载脂蛋白B (Apo-B)、脂蛋白a[Lp(a)]、血红蛋白、β2微球蛋白(β2MG)、UA、BUN、Scr、碱性磷酸酶(ALP)、磷、钙、25-羟维生素D、全段甲状旁腺素(iPTH)、总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-c)、低密度脂蛋白胆固醇(LDL-c)、饱和铁结合力(TIBC)、未饱和铁结合力(UIBC)、铁蛋白、血清铁和转铁蛋白。
1.2.4 IS检测 标准品是硫酸吲哚酚钾盐(99.8%,美国Sigma-Aldrich公司),内标是氢氯噻嗪(99.5%,上海市药品检验所提供)。采用高效液相色谱-电喷雾-串联质谱技术检测血浆标本中IS含量。于2 mL的聚丙烯管中加入100 μL的血浆,加入氢氯噻嗪内标/蛋白沉淀剂,涡旋混匀1 min,12 000 r/min离心10 min。离心结束后,取100 μL上清放于聚丙烯管内,加入等体积(100 μL)的水混匀,取5 μL加入到自动进样器中。色谱分离通过Venusil XBP Phenyl色谱柱(100 mm×2.1 mm,5 μm,美国Bonna-Agela公司)完成,流动相A为含2 mmol/L醋酸铵的0.1%甲醛溶液(V/V),流动相B为甲醇,流动相(A∶B=30∶70)流速为0.3 mL/min。色谱柱温度控制在40 ℃,同时进样器温度控制在4 ℃。IS和内标的洗脱时间分别是1.8、1.4 min。质谱检测采用API3000三级四级杆质谱仪(加拿大Applied Biosystems公司),负离子扫描,电喷雾电离(ESI)源和多反应监测(MRM)模式。IS标准曲线设定为0.125、0.25、0.5、1、5、10、50、100 μg/mL,r=0.999 (n=6),检测下限为0.125 μg/mL,组内和组间差异分别为4.3%、3.3%。
1.2.5 心脏超声检查 在非透析日,由同一名心脏超声科医生对所有患者统一进行心脏超声检查(Philips IE33,Eindhoven,the Netherlands,探头频率为3.5 MHz),患者其他指标对其设盲。测定舒张期末左心室内径(LVDD)、室间隔厚度(LVS)和左心室后壁厚度(LVPWT),根据Devereux公式计算左心室质量(LVM)和左心室质量指数(LVMI)。左心室肥厚(LVH)定义为:LVMI>50 g/m2.7(男)或LVMI>47 g/m2.7(女)(采用身高的2.7次方校正后得到左心室质量指数)。

2 结果
2.1 患者临床及生化特征 本研究共入选190例患者,男117例,LVH的患病率高达65.8%,年龄(57.3±14.2)岁。190例患者分为非LVH组和LVH组,从表1、表2可见,LVH组BMI、LVMI、iPTH、收缩压、舒张压和硫酸吲哚酚(IS)均高于非LVH组,而spKt/V、Ca、Apo-A和LDL-c低于非LVH组,差异有统计学意义(P<0.05)。此外,LVH组服用CCB、ARB、α受体阻滞剂、β受体阻滞剂和活性维生素D的比例也较高。同时,LVH组和非LVH组的肾脏原发病组成不同,LVH组中,高血压肾病和糖尿病肾病比例较高,差异有统计学意义(P<0.05)。同时,LVH组糖尿病的比例较高(P<0.05)。此外,两组间的其他临床和生化指标差异无统计学意义(P>0.05)。
2.2 IS与其他临床生化指标的相关分析 采用Pearson相关或Spearman相关分析了IS与其他临床生化指标的关系。如表3所示,IS与nPNA、白蛋白、前白蛋白、BUN、Scr、UA、P、Ca×P、iPTH、β2MG呈正相关,与尿量、RRF、HDL-c、Apo-A呈负相关。
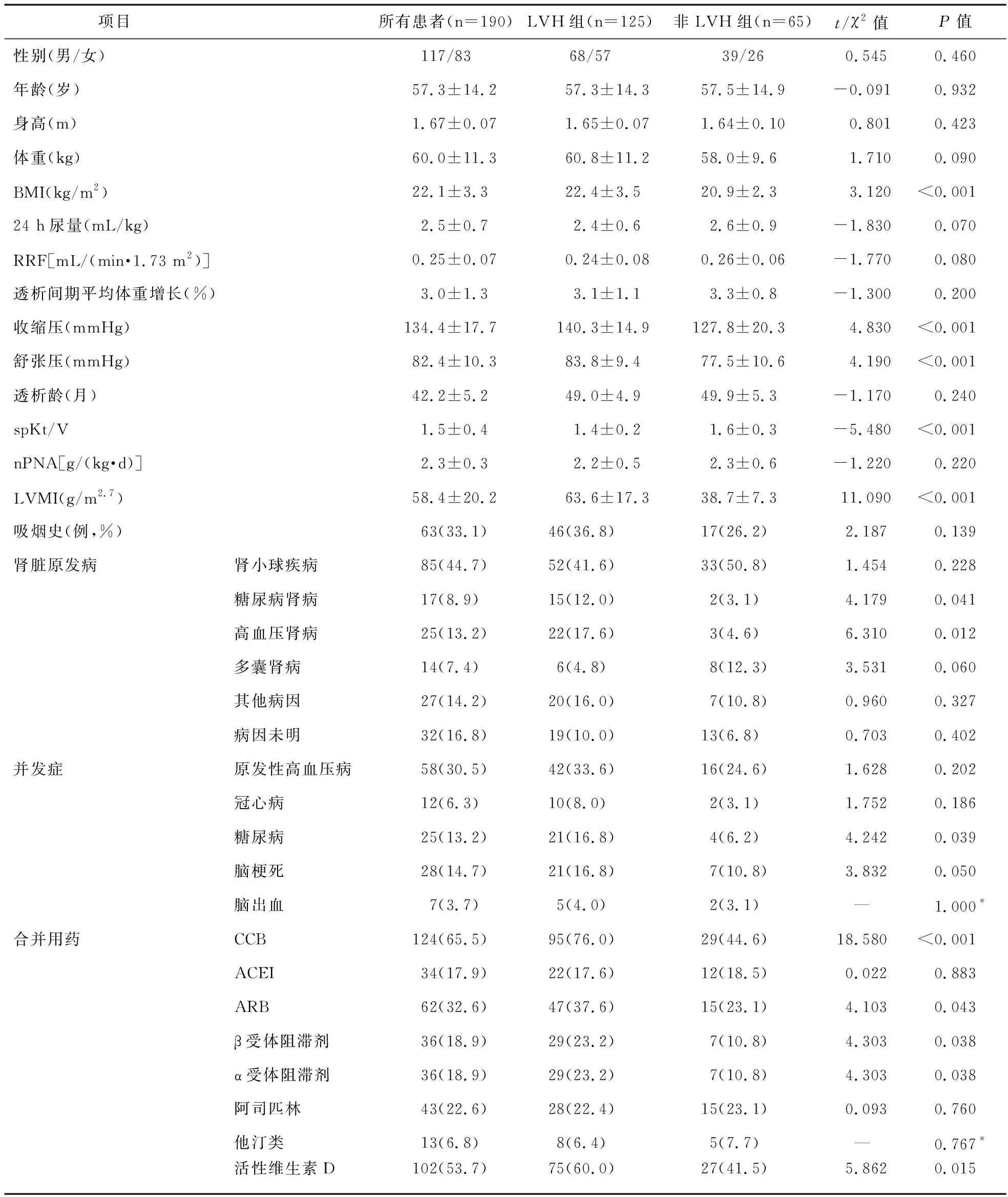
表1 190例血液透析患者的临床特征(例,%)

表2 190例血液透析患者的生化特征
2.3 IS与LVMI关系的线性回归 单因素线性回归分析显示,IS与LVMI呈正相关关系(β=7.05,P=0.01)。为了排除多种因素对LVMI和IS的影响,我们采用了系列模型进行校正,包括模型1(校正了RRF、spKt/V、透析龄和尿量)、模型2(校正了年龄、性别、BMI、吸烟史和糖尿病病史)、模型3(校正了Ca、iPTH、P)、模型4(校正了收缩压和舒张压)、模型5(校正了前白蛋白、白蛋白、nPNA、BUN、Scr、UA、hsCRP、HDL-c、Apo-A、Hcy、β2MG)。最后,我们选择单因素线性回归(以LVMI为因变量)中P<0.05的变量(包括年龄、BMI、收缩压、舒张压、spKt/V、nPNA、iPTH、hsCRP、Hcy)为协变量构建模型6,进行多因素线性回归来避免协变量间存在多重共线性。结果显示,校正各种传统和非传统危险因素后,IS与LVMI仍然呈独立正相关关系(β=4.10,P=0.02)。见表4。
2.4 IS与LVH关系的Logistic回归 单因素Logistic回归显示,IS是LVH的影响因素(β=7.16,OR=1.11,95%CI1.06~1.37,P=0.02)。此外,为了排除各种因素对IS的影响,我们采用了系列模型进行校正,包括模型1(校正了spKt/V、RRF尿量和透析龄)、模型2(校正了BMI、年龄、性别、吸烟史和糖尿病病史)、模型3(校正了iPTH、Ca、P)、模型4(校正了收缩压和舒张压)、模型5(校正了nPNA、BUN、Scr、UA、白蛋白和前白蛋白)和模型6(校正了服药史,包括钙通道阻滞剂、血管紧张素转换酶抑制剂、血管紧张素Ⅱ受体拮抗剂、阿司匹林、他汀类、β受体阻滞剂和α受体阻滞剂)。最后,以单因素Logistic回归(以LVH为因变量)中P<0.05的变量(包括nPNA、spKt/V、iPTH、BMI、糖尿病病史、收缩压和舒张压)为协变量构建模型7,进行多因素线性回归来避免协变量间存在多重共线性。结果显示,校正其他危险因素后,IS与LVH仍呈独立正相关(β=6.55,OR=0.70,95%CI0.63~0.77,P=0.03)。见表5。
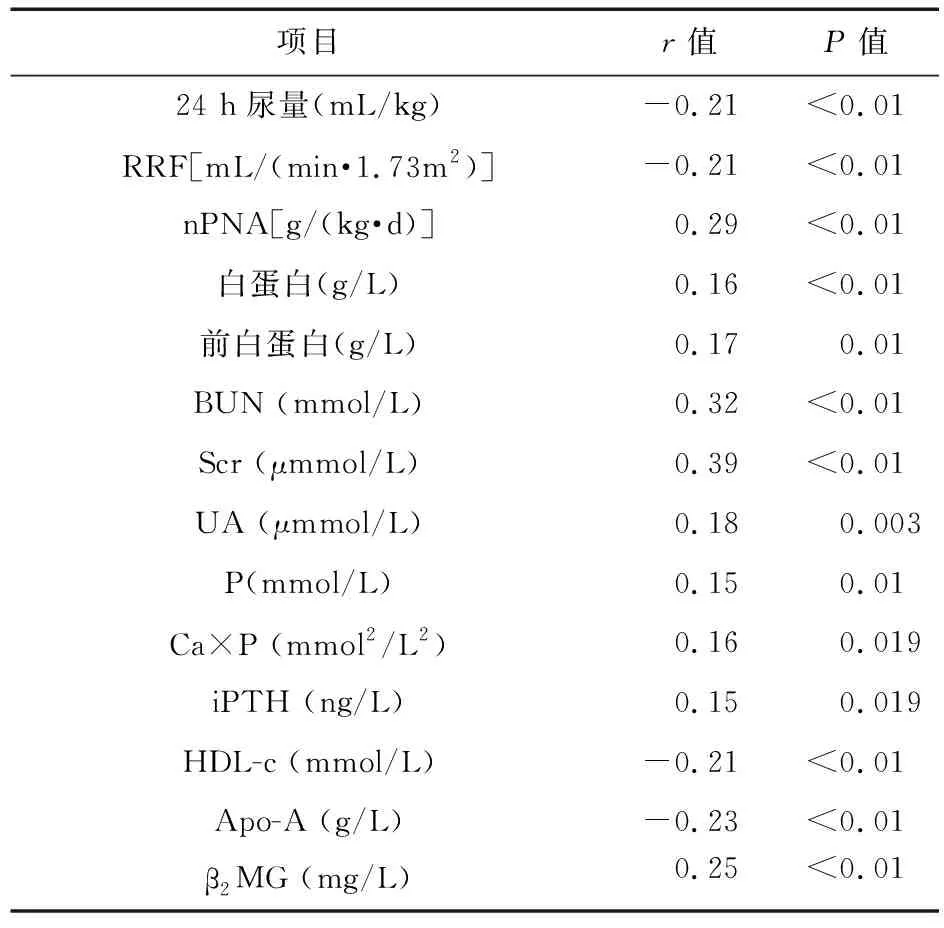
表3 IS与其他临床、生化指标的相关性分析(只列出了P<0.05的变量)
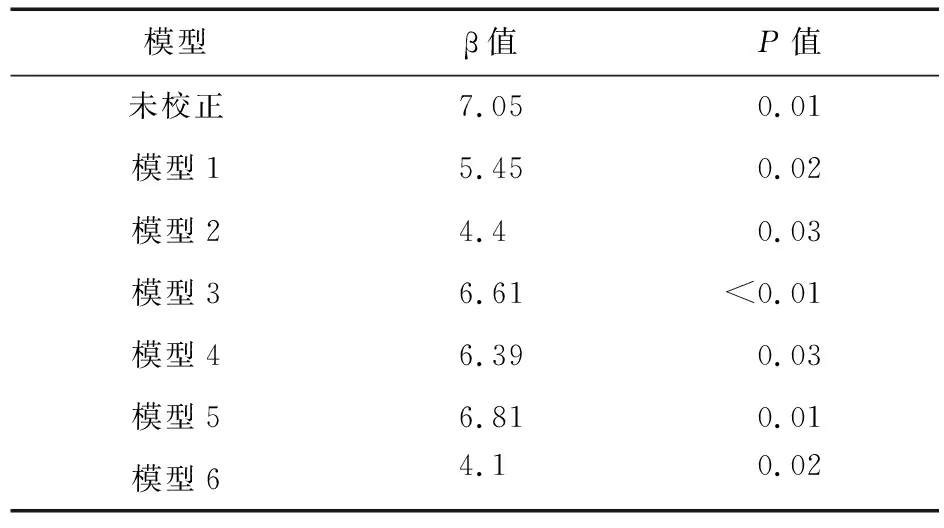
表4 IS与LVMI关系的线性回归模型(以LVMI为因变量)
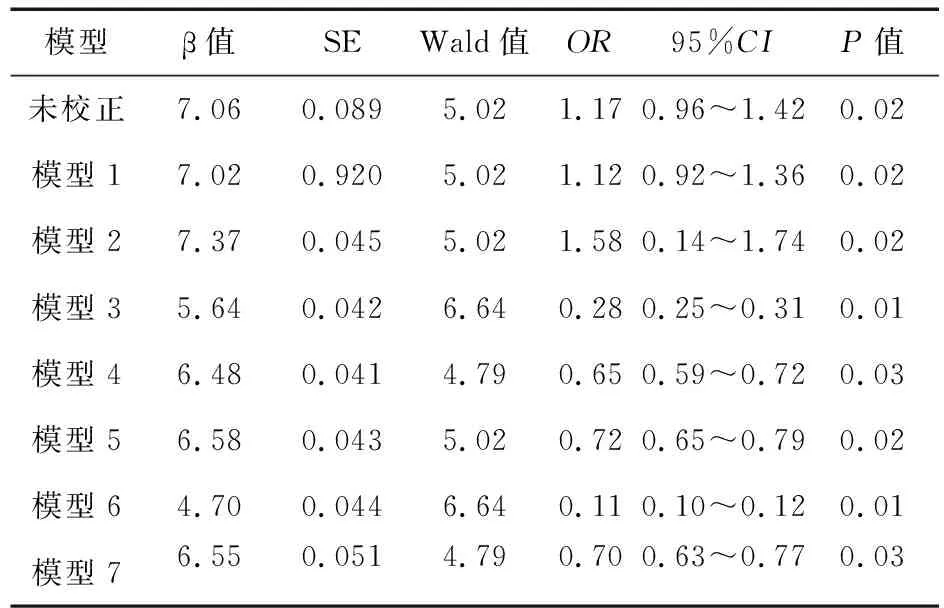
表5 IS与LVH关系的Logistic回归模型(以LVH为因变量)
3 讨论
近年来,有关CKD患者发生CVD与硫酸吲哚酚之间的关系受到研究者的重视。Fujii等[7]研究显示,CKD患者体内IS增加,使机体长期处于氧化应激状态,可以导致心肌纤维化和心肌肥厚等心脏损害。有报道,IS刺激大鼠血管平滑肌增生[8],此外IS可上调PDGF-β受体来促进PDGF介导的血管平滑肌细胞增殖和迁移,并且IS可通过NADPH氧化酶或者NADPH样氧化酶途径提高ROS水平,从而促进血管硬化过程[9]。Adijiang等[10-11]试验提示,IS可以诱发骨桥蛋白和氧化应激导致主动脉壁增厚钙化。除了作用于VSMC,IS通过氧化应激增强诱导血管内皮细胞功能失调[12]。但IS与左心室肥厚的关系尚未明确。所以,本研究旨在探讨IS与左心室重构的关系,为临床提供指导意见,预防左心室肥厚,降低左心室肥厚的发生率,同时为临床相关治疗提供依据。
大量实验数据表明,IS作为一种尿毒症毒素,可通过多种机制介导肾脏发生纤维化,从而造成肾脏损害,参与CKD进展[13]。此外,许多基础及临床实验证明,IS不仅与慢性肾脏病进展有关,还促进心血管疾病的发生与进展[4],血清IS也是一个预测心血管疾病的有价值的标志物[3]。本研究结果表明,在校正了各种因素,如年龄、BMI、收缩压和舒张压等之后,血液透析患者血浆IS与LVMI呈独立正相关,是LVH的独立危险因素。
有报道,IS正常值<1.9 μg/mL,而血液透析患者血中的IS水平可达100 μg/mL[14]。入组患者血浆IS水平显著高于普通人群,达(35.4±18.2) mg/L,这一结果符合文献报道数据。结果表明,在校正了各种因素,如:年龄、BMI、收缩压和舒张压等之后,血液透析患者血浆IS与LVMI呈独立正相关,是LVH的独立危险因素。LVH并不是一种疾病,但往往是心脏病的前兆,可导致心力衰竭,普通人群的LVMI增长主要是由于压力或容量负荷的增加,如:高血压、风湿性二尖瓣关闭不全和冠心病等。本研究中,血液透析患者LVH的患病率达65.8%,显著高于普通人群,也符合相关文献报道的结果。因此,我们推测,除了其他各种因素,IS很可能是导致LVH的重要危险因素。Fujii等[7]的研究指出,CKD患者体内IS增加,使机体长期处于氧化应激状态,可以导致心肌纤维化和心肌肥厚等心脏损害。Yisireyili等[15]发现,IS可以导致心肌细胞肥厚和纤维化。Sato等[16]研究表明,血浆IS浓度升高促使患者发生左心室舒张功能障碍。
IS来源于食物中的色氨酸,因此,人体吸收的蛋白质可以影响血浆IS浓度[17],与本研究结果一致,如:血浆IS与白蛋白、前白蛋白和BUN呈正相关。此外,本研究结果显示,IS与残余肾功能(RRF)和尿量呈负相关,表明透析治疗对血浆IS水平的影响小于残余肾功能,证实在肾功能正常时,血清IS几乎为0,而肾功能不全时,血清IS升高。并且肾脏替代治疗只能清除游离的IS,循环血液中90%以上的IS和白蛋白呈非共价结合,游离IS较少,透析后总的IS变化不明显[18],肾功能正常时主要通过有机阴离子转运系统摄取并排泄[19]。此外,IS与Ca×P、iPTH、β2MG呈正相关,与HDL-c和Apo-A呈负相关。
在非血液透析患者的普通人群中,LVH的发生与很多因素相关,如:年龄、高血压、糖尿病病史等。但慢性肾脏病血液透析患者LVH的患病率显著高于普通人群,又由于IS不容易被一般的肾脏替代疗法清除,因此,血浆中IS可能是LVH的危险因素。为了排除其他相关因素对LVH和IS的影响,本文建立了系列模型进行校正。结果显示,校正了这些相关因素后,患者血浆IS与LVMI呈独立正相关,其是LVH的独立危险因素的结果仍然有意义。
本研究仅对IS与左心室肥厚的相关性进行了探究,并没有对相关机制进行深入研究,这是本研究不足之处。之后可以通过建立动物模型,深入探讨IS对左心室肥厚的影响及机制。
综上所述,在校正了各种因素,如:年龄、BMI、收缩压和舒张压等之后,血液透析患者血浆IS与LVMI呈独立正相关,是LVH的独立危险因素。其机制值得深入研究。
参考文献:
[1] Van der Zee S,Baber U,Elmariah S,et al.Cardiovascular risk factors in patients with chronic kidney disease[J].Nat Rev Cardiol,2009,6(9):580-589.
[2] Hung SC,Kuo KL,Huang HL,et al.Indoxyl sulfate suppresses endothelial progenitor cell-mediated neovascularization[J].Kidney Int,2016,89(3):574-585.
[3] 吴逸如,刁宗礼,刘文虎.硫酸吲哚酚对肾脏和心血管毒性作用的研究新进展[J].临床和实验医学杂志,2015,14(1):69-72.
[4] 白运焕,杨媛媛,蒋亚芬,等.慢性肾病患者血硫酸吲哚酚浓度与心血管疾病相关指标的关系分析[J].中华全科医学,2016,14(7):1141-1143.
[5] 郜同心.硫酸吲哚酚诱导脐静脉内皮细胞损伤及α-硫辛酸的干预作用[D].河北医科大学,2015.
[6] Penne EL,van der Weerd NC,Grooteman MP,et al.Role of residual renal function in phosphate control and anemia management in chronic hemodialysis patients[J].Clin J Am Soc Nephrol,2011,6(2):281-289.
[7] Fujii H,Nishijima F,Goto S,et al.Oral charcoal adsorbent (AST-120) prevents progression of cardiac damage in chronic kidney disease through suppression of oxidative stress[J].Nephrol Dial Transplant,2009,24(7):2089-2095.
[8] 李峻岭,姜盛花,段颖欣,等.硫酸吲哚酚对大鼠主动脉平滑肌细胞钙化影响的实验研究[J].中华临床医师杂志(电子版),2013,7(18):8335-8338.
[9] Shimizu H,Hirose Y,Nishijima F,et al.ROS and PDGF-beta [corrected] receptors are critically involved in indoxyl sulfate actions that promote vascular smooth muscle cell proliferation and migration[J].Am J Physiol Cell Physiol,2009,297(2):C389-C396.
[10]Adijiang A,Goto S,Uramoto S,et al.Indoxyl sulphate promotes aortic calcification with expression of osteoblast-specific proteins in hypertensive rats[J].Nephrol Dial Transplant,2008,23(6):1892-1901.
[11]Muteliefu G,Enomoto A,Jiang P,et al.Indoxyl sulphate induces oxidative stress and the expression of osteoblast-specific proteins in vascular smooth muscle cells[J].Nephrol Dial Transplant,2009,24(7):2051-2058.
[12]Tumur Z,Niwa T.Indoxyl sulfate inhibits nitric oxide production and cell viability by inducing oxidative stress in vascular endothelial cells[J].Am J Nephrol,2009,29(6):551-557.
[13]余彦霖,肖堂利,刘亮,等.硫酸吲哚酚促进肾纤维化的机制研究[J].第三军医大学学报,2016,38(2):119-123.
[14]Odamaki M,Kato A,Kumagai H,et al.Counter-regulatory effects of procalcitonin and indoxyl sulphate on net albumin secretion by cultured rat hepatocytes[J].Nephrol Dial Transplant,2004,19(4):797-804.
[15]Yisireyili M,Shimizu H,Saito S,et al.Indoxyl sulfate promotes cardiac fibrosis with enhanced oxidative stress in hypertensive rats[J].Life Sci,2013,92(24-26):1180-1185.
[16]Sato B,Yoshikawa D,Ishii H,et al.Relation of plasma indoxyl sulfate levels and estimated glomerular filtration rate to left ventricular diastolic dysfunction[J].Am J Cardiol,2013,111(5):712-716.
[17]何栩,吴奕章,傅强,等.硫酸吲哚酚对人单核细胞源树突状细胞表型及功能的影响[J].实用医学杂志,2017,33(2):194-197.
[18]安凌春,高杨,黄春泉.连续性肾脏替代治疗与间歇性血液透析治疗重症急性肾功能衰竭的效果研究[J].中国当代医药,2017,24(13):60-62.
[19]奇锦峰,张娜,余文浩,等.常见可药/食用植物及其所含化学成分明显抑制小鼠肾脏主要有机阴离子转运体[C]//中国药理学会第十三次全国学术大会.2015.

